Цистиновый узел
| Домен цистинового узла | |||
|---|---|---|---|
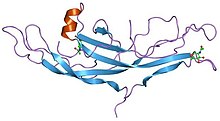 Структура хорионического гонадотропина человека. [ 1 ] | |||
| Идентификаторы | |||
| Символ | Cys_knot | ||
| Пфам | PF00007 | ||
| Пфам Клан | CL0079 | ||
| ИнтерПро | ИПР006208 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1hcn / SCOPe / СУПФАМ | ||
| |||
Цистиновый узел белка, представляет собой структурный мотив содержащий три дисульфидных мостика (образованных из пар остатков цистеина ). Участки полипептида , находящиеся между двумя из них, образуют петлю, через которую проходит третья дисульфидная связь, образуя ротаксановую субструктуру. Мотив цистинового узла стабилизирует структуру белка и сохраняется в белках различных видов. [ 2 ] [ 3 ] [ 4 ] Различают три типа цистинового узла, отличающиеся топологией дисульфидных связей: [ 5 ]
- Цистиновый узел фактора роста (GFCK)
- ингибитор цистиновый узел (ICK), распространенный в токсинах пауков и улиток
- Циклический цистиновый узел, или циклотид.
Цистиновый узел фактора роста был впервые обнаружен в структуре фактора роста нервов (NGF), решен методом рентгеновской кристаллографии и опубликован в 1991 году Томом Бланделлом в журнале Nature . [ 6 ] GFCK присутствует в четырех суперсемействах. К ним относятся фактор роста нервов, трансформирующий фактор роста бета (TGF-β), фактор роста тромбоцитов и гликопротеиновые гормоны , включая хорионический гонадотропин человека . Они структурно родственны из-за присутствия мотива цистинового узла, но различаются по последовательности. [ 7 ] Все выявленные структуры GFCK являются димерными, но режимы их димеризации в разных классах различны. [ 8 ] Подсемейство факторов роста эндотелия сосудов , относящееся к суперсемейству факторов роста тромбоцитов, включает белки, которые являются ангиогенными факторами. [ 9 ]
Наличие мотива циклического цистинового узла (CCK) было обнаружено при циклотид выделении из различных семейств растений. Мотив CCK имеет циклическую основу, трехцепочечный бета-лист и конформацию цистинового узла. [ 10 ]
Новые белки добавляются к семейству мотивов цистинового узла, также известному как белки С-концевого цистинового узла (CTCK). Они имеют примерно 90 общих аминокислотных остатков в богатых цистеином С-концевых областях. [ 9 ]
Ингибиторный цистиновый узел (ICK) представляет собой структурный мотив с трехцепочечным антипараллельным бета-листом, соединенным тремя дисульфидными связями, образующими узловатое ядро. Мотив ICK можно найти в категории типов , таких как животные и растения. Он часто встречается во многих пептидах яда , например, улиток, пауков и скорпионов. Пептид K-PVIIA, содержащий ICK, может подвергаться успешной ферментативной циклизации основной цепи . Дисульфидная связь и общий образец последовательности мотива ICK обеспечивают стабильность пептидов, поддерживающих циклизацию. [ 11 ]
Последствия употребления наркотиков
[ редактировать ]Стабильность и структура мотива цистинового узла предполагает возможность его применения в разработке лекарств . Водородная связь между дисульфидными связями мотива и структурами бета-листа приводит к высокоэффективной стабилизации структуры. Кроме того, размер мотива составляет примерно 30 аминокислотных остатков. [ 12 ] Эти две характеристики делают его привлекательной биомолекулой для доставки лекарств, поскольку он обладает термической стабильностью, химической стабильностью и протеолитической устойчивостью. Биологическая активность этих молекул частично обусловлена уникальным расположением блокировок и циклизованным пептидным остовом, который содержит консервативную последовательность, общую для циркулинов. [ 12 ] Циркулины ранее были идентифицированы при скрининге на анти-ВИЧ-активность. [ 13 ] Исследования показали, что белки цистиновых узлов можно инкубировать при температуре 65 °C или помещать в смесь 1 н. HCl/1 н. NaOH без потери структурной и функциональной целостности. [ 14 ] Его устойчивость к пероральным и некоторым кишечным протеазам предполагает возможность использования для пероральной доставки. Возможные будущие применения включают облегчение боли, а также противовирусные и антибактериальные функции. [ 14 ]
Ссылки
[ редактировать ]- ^ Ву Х, Ластбадер Дж.В., Лю Ю., Кэнфилд Р.Э., Хендриксон В.А. (июнь 1994 г.). «Структура хорионического гонадотропина человека при разрешении 2,6 А на основе MAD-анализа селенометионильного белка». Структура . 2 (6): 545–58. дои : 10.1016/s0969-2126(00)00054-x . ПМИД 7922031 .
- ^ «Цистиновые узлы» . Веб-страница циклотида . Архивировано из оригинала 5 февраля 2015 г. Проверено 24 апреля 2019 г.
- ^ Щербет, Г.В. (2011), «Семейства факторов роста» , «Факторы роста и их рецепторы в клеточной дифференцировке, раке и терапии рака» , Elsevier, стр. 3–5, doi : 10.1016/b978-0-12-387819-9.00002-5 , ISBN 9780123878199 , получено 1 мая 2019 г.
- ^ Витт, Урсула А.; Сюй, Шеу Ю.; Сюэ, Аарон Дж.В. (1 мая 2001 г.). «Эволюция и классификация гормонов, содержащих цистиновые узлы, и родственных им внеклеточных сигнальных молекул» . Молекулярная эндокринология . 15 (5): 681–694. дои : 10.1210/mend.15.5.0639 . ISSN 0888-8809 . ПМИД 11328851 .
- ^ Дейли Н.Л., Крейк DJ (июнь 2011 г.). «Биоактивные белки цистиновых узлов». Современное мнение в области химической биологии . 15 (3): 362–8. дои : 10.1016/j.cbpa.2011.02.008 . ПМИД 21362584 .
- ^ PDB : 1 ставка ; Макдональд Н.К., Лапатто Р., Мюррей-Раст Дж., Ганнинг Дж., Влодавер А., Бланделл Т.Л. (декабрь 1991 г.). «Новая складка белка, обнаруженная с помощью кристаллической структуры фактора роста нервов с разрешением 2,3 А». Природа . 354 (6352): 411–4. Бибкод : 1991Natur.354..411M . дои : 10.1038/354411a0 . ПМИД 1956407 . S2CID 4346788 .
- ^ Сан П. Д., Дэвис Д. Р. (1995). «Суперсемейство факторов роста цистиновых узлов» . Ежегодный обзор биофизики и биомолекулярной структуры . 24 (1): 269–91. дои : 10.1146/annurev.bb.24.060195.001413 . ПМИД 7663117 .
- ^ Цзян X, Диас Дж.А., Хэ X (январь 2014 г.). «Структурная биология гликопротеиновых гормонов и их рецепторов: понимание передачи сигналов» . Молекулярная и клеточная эндокринология . 382 (1): 424–451. дои : 10.1016/j.mce.2013.08.021 . ПМИД 24001578 .
- ^ Jump up to: а б Айер С., Ачарья КР (ноябрь 2011 г.). «Связывание узла: цистиновая сигнатура и процессы молекулярного распознавания семейства ангиогенных цитокинов фактора роста эндотелия сосудов» . Журнал ФЭБС . 278 (22): 4304–22. дои : 10.1111/j.1742-4658.2011.08350.x . ПМЦ 3328748 . ПМИД 21917115 .
- ^ Крейк DJ, Дейли Н.Л., Бонд Т., Уэйн С. (декабрь 1999 г.). «Растительные циклотиды: уникальное семейство циклических и узловатых белков, определяющее структурный мотив циклического цистинового узла». Журнал молекулярной биологии . 294 (5): 1327–36. дои : 10.1006/jmbi.1999.3383 . ПМИД 10600388 .
- ^ Квон, Сухён; Босманс, Фрэнк; Каас, Квентин; Шеневаль, Оливер; Синибер, Энн С; Розенгрен, К. Йохан; Ван, Конан К; Шредер, Кристина I; Крейк, Дэвид Дж. (19 апреля 2016 г.). «Эффективная ферментативная циклизация ингибирующего пептида, содержащего цистиновый узел» . Биотехнология и биоинженерия . 113 (10): 2202–2212. дои : 10.1002/бит.25993 . ПМК 5526200 . ПМИД 27093300 .
- ^ Jump up to: а б Кольмар, Харальд. «Биологическое разнообразие и терапевтический потенциал природных и сконструированных минипротеинов цистинового узла». Текущее мнение в фармакологии, вып. 9, нет. 5, 2009, стр. 608–614., doi:10.1016/j.coph.2009.05.004.
- ^ КР Густавсон, Р. К. Соудер II, Л. Е. Хендерсон, И. К. Парсонс, Ю. Кашман, Дж. Х. Карделлина II, Дж. Б. МакМахон, Р. В. Бакхейт-младший, Л. К. Паннелл, М. Р. Бойд Циркулины A и B: новые макроциклические пептиды, ингибирующие ВИЧ, из тропического дерева Chassalia parvifolia. Дж. Ам. хим. Соц., 116 (1994), стр. 9337-9338.
- ^ Jump up to: а б Крейк, Дэвид Дж. и др. «Мотив цистинового узла в токсинах и его значение для разработки лекарств». Токсикон, об. 39, нет. 1, 2001, стр. 43–60, doi:10.1016/s0041-0101(00)00160-4.