Фф-фаги

Фаги Ff (для F- фагов ) специфичных нитчатых представляют собой группу практически идентичных нитчатых фагов (род Inovirus ), включающих фаги f1 , fd, M13 и ZJ/2, которые инфицируют бактерии несущие фактор фертильности F. , [ 1 ] [ 2 ] [ 3 ] [ 4 ] [ 5 ] [ 6 ] [ 7 ] Вирион (вирусная частица) представляет собой гибкую нить размером примерно 6 на 900 нм, содержащую цилиндрическую белковую трубку, защищающую в своем ядре одноцепочечную кольцевую молекулу ДНК. Фаг кодирует всего 11 генных продуктов и является одним из самых простых известных вирусов. Он широко использовался для изучения фундаментальных аспектов молекулярной биологии. Джордж Смит и Грег Винтер использовали f1 и fd в своей работе по фаговому дисплею , за которую им была присуждена доля Нобелевской премии по химии 2018 года . [ 8 ] В ранних экспериментах с фагами Ff M13 использовался для определения функций генов. [ 9 ] [ 10 ] а М13 тоже разрабатывалась как машина-клонатор, [ 11 ] поэтому название M13 иногда используется как неофициальный синоним всей группы фагов Ff.
Структура
[ редактировать ]
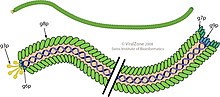
Вирион представляет собой гибкую нить ( червеобразную цепочку ) диаметром около 6 нм и длиной 900 нм. Несколько тысяч копий небольшой (50 аминокислотных остатков) удлиненной альфа-спиральной субъединицы основного белка оболочки (продукт гена 8, или p8) в перекрывающейся черепицеобразной матрице образуют полый цилиндр, заключающий в себе кольцевой одноцепочечный ДНК-геном. . Каждая субъединица р8 имеет набор основных остатков возле С-конца удлиненного белка и кислотных остатков возле N-конца; эти две области разделены примерно 20 гидрофобными (неполярными) остатками. Расположение, напоминающее черепицу, помещает кислотные остатки p8 вблизи внешней поверхности цилиндра, где они заставляют вирусную частицу заряжаться отрицательно; неполярные области вблизи неполярных областей соседних субъединиц р8, где неполярные взаимодействия способствуют заметной физической стабильности вирусной частицы; и основные остатки вблизи центра цилиндра, где они взаимодействуют с отрицательно заряженными фосфатами ДНК в ядре вириона. дольше [ 12 ] (или короче [ 13 ] ) Молекулы ДНК могут быть упакованы, поскольку во время сборки можно добавить больше (или меньше) субъединиц р8, что необходимо для защиты ДНК, что делает фаг полезным для генетических исследований. (Этот эффект не следует путать с полифагом , который может упаковывать несколько отдельных и различных молекул ДНК). Около 5 копий каждого из четырех второстепенных белков покрывают два конца вириона. [ 14 ]
вириона Молекулярная структура капсида (сборка белков субъединицы p8) была определена методом дифракции рентгеновских лучей , а структурные модели были депонированы в Банке данных белков . В частности, серии вирионных структур fd и Pf1, хранящиеся в PDB на протяжении десятилетий, иллюстрируют усовершенствования методов сбора данных дифракции волокон и компьютерного анализа. Структуры капсидного белка p3 и белка репликации/сборки p5 также были определены с помощью рентгеновской кристаллографии и депонированы в PDB. [ нужна ссылка ]
Генетика
[ редактировать ]Последовательность ДНК генома fd состоит из 6408 нуклеотидов, включающих 9 генов, но геном имеет 11 открытых рамок считывания, производящих 11 белков, поскольку два гена, ген 2 и ген 1, имеют внутренние внутрирамочные старты трансляции, генерируя два дополнительных белка, p10. и п11. Геном также содержит короткую некодирующую межгенную последовательность. [ 15 ] Последовательности M13 и f1 немного отличаются от fd. У них обоих всего 6407 нуклеотидов; f1 отличается от fd по 180 позициям (только 10 из этих изменений отражаются на аминокислотных изменениях в продуктах гена) [ 16 ] а M13 имеет только 59 нуклеотидных отличий от f1. Для многих целей фаги группы Ff можно считать взаимозаменяемыми.
В состав вириона входят пять генных продуктов: основной белок оболочки (p8) и второстепенные белки, покрывающие два конца: p3 и p6 на одном конце и p7 и p9 на другом конце. Три генных продукта (p2, p5 и p10) представляют собой цитоплазматические белки, необходимые для синтеза ДНК, а остальные — мембранные белки, участвующие в сборке вириона. [ 17 ]
| иновирус | |
|---|---|
| Классификация вирусов | |
| (без рейтинга): | Вирус |
| Область : | Моноднавирия |
| Королевство: | Лебвира |
| Тип: | Хофнейвирикота |
| Сорт: | Фасервирицетес |
| Заказ: | Тубулавирусы |
| Семья: | Иновириды |
| Род: | иновирус |
Ген, кодирующий p1, использовался в качестве консервативного маркерного гена вместе с тремя другими признаками, специфичными для геномов иновирусов, в автоматическом подходе машинного обучения для идентификации более 10 000 иновирусоподобных последовательностей из микробных геномов. [ 18 ]
Жизненный цикл
[ редактировать ]Инфекция
[ редактировать ]Белок p3 прикреплен к одному концу вириона с помощью C-концевого домена p3. Инфицирование бактерий-хозяев включает взаимодействие двух разных N-концевых областей р3 с двумя разными участками бактерий-хозяев. Сначала домен N2 р3 прикрепляется к внешнему кончику F-пилуса , и пилус втягивается в клетку. Это втягивание может включать деполимеризацию сборки субъединицы ворсинок в клеточную мембрану у основания ворсинок путем обращения вспять процесса роста и полимеризации ворсинок. [ 1 ] [ 19 ] [ 20 ] Когда кончик пилуса, несущий p3, приближается к клеточной стенке, домен N1 p3 взаимодействует с бактериальным белком TolQRA, завершая инфекцию и высвобождая геном в цитоплазму хозяина. [ 21 ] [ 22 ]
Репликация
[ редактировать ]После того как одноцепочечная вирусная ДНК попадает в цитоплазму, она служит матрицей для синтеза комплементарной цепи ДНК. Этот синтез инициируется в межгенной области последовательности ДНК хозяином РНК-полимеразой, которая синтезирует короткий РНК-праймер на инфицирующей ДНК в качестве матрицы. ДНК-полимераза III хозяина затем использует этот праймер для синтеза полной комплементарной цепи ДНК, образуя двухцепочечный круг, иногда называемый репликативной формой (RF) ДНК. Комплементарная цепь RF является матрицей транскрипции белков, кодируемых фагом, особенно p2 и p10, которые необходимы для дальнейшей репликации ДНК. [ нужна ссылка ]
Белок р2 расщепляет вирусную цепь РФ ДНК, а ДНК-полимераза III хозяина синтезирует новую вирусную цепь. Старая вирусная цепь вытесняется по мере синтеза новой. Когда круг замыкается, ковалентно связанный р2 разрезает смещенную вирусную цепь на стыке старой и вновь синтезированной ДНК, повторно лигирует два конца и высвобождает р2. RF реплицируется с помощью этого механизма вращающегося круга , создавая десятки копий RF. [ нужна ссылка ]
Когда концентрация фаговых белков увеличивается, новые цепи вируса покрываются белком репликации/сборки p5, а не комплементарными нитями ДНК. P5 также ингибирует трансляцию p2, так что производство и упаковка оцДНК потомства вируса происходят синхронно. [ 6 ]
Сборка и экструзия
[ редактировать ]Инфекция не убивает бактерии-хозяева, [ 23 ] в отличие от большинства других семейств фагов. Потомство фага собирается при выходе через мембрану растущей бактерии, вероятно, в местах адгезии, соединяющих внутреннюю и внешнюю мембраны. Пять фаговых белков, образующих оболочку готового фага, проникают во внутреннюю мембрану; для p8 и p3 N-концевые лидерные последовательности (позже удаленные) помогают белкам проникать в бактериальную мембрану, при этом их N-концы направлены от цитоплазмы к периплазме. В сборке также участвуют три других белка фаговой мембраны , которых нет в фаге: p1, p11 и p4. Репликация RF-ДНК преобразуется в производство оцДНК фага путем покрытия ДНК p5 с образованием удлиненного комплекса репликации/сборки p5/ДНК, который затем взаимодействует с мембраносвязанными фаговыми белками. В процессе экструзии захватываются белки p7 и p9, которые образуют внешний кончик фага-потомка. Когда р5 отделяется от ДНК, ДНК потомства выдавливается через мембрану и заворачивается в спиральную оболочку из р8, к которой в конце сборки добавляются р3 и р6. Белок p4 может образовывать экструзионную пору во внешней мембране. [ 14 ]
Взаимодействие сигнала двухцепочечной упаковочной ДНК с комплексом p1-тиоредоксин на внутренней мембране хозяина запускает образование поры. Белок p1 содержит мотивы Уокера , которые необходимы для сборки фага. [ 24 ] предполагая, что p1 является молекулярным мотором, участвующим в сборке фага. Белок p1 имеет трансмембранный гидрофобный домен с N-концевой частью в цитоплазме и C-концевой частью в периплазме (ориентация обратна р8). Рядом с цитоплазматической стороной трансмембранного домена находится последовательность из 13 остатков р1, имеющая структуру основных остатков, близко соответствующую структуре основных остатков вблизи С-конца р8, но инвертированную по отношению к этой последовательности. [ 25 ]
Промежуточные сборки р8 можно получить обработкой фага хлороформом. [ 26 ] [ 27 ] [ 28 ] Спиральное содержание р8 в этих промежуточных формах аналогично таковому в фаге, что позволяет предположить, что структурные изменения во время сборки могут включать просто скольжение опоясывающих субъединиц р8 относительно их соседей в сборке. [ 29 ] [ 30 ]
Приложения
[ редактировать ]Науки о жизни и медицина
[ редактировать ]Фаги Ff были созданы для применения в биологических и медицинских науках. Многие приложения основаны на экспериментах. [ 12 ] показывающие, что последовательность ДНК, определяющая устойчивость к антибиотику канамицину, может быть вставлена в функциональной форме в некодирующую межгенную последовательность ДНК фага fd. Такой модифицированный фаг, соответственно, длиннее, чем нитчатый fd дикого типа, поскольку более длинная ДНК покрыта соответственно большим количеством белков оболочки гена 8, но жизненный цикл фага в противном случае не нарушается. С другой стороны, традиционный «головастик» или фаг изометрической формы, имеющий капсид ограниченного размера, не может быть так легко использован для инкапсида более крупной молекулы ДНК. Модифицированный фаг можно выбрать путем инфицирования чувствительных к канамицину бактерий модифицированным фагом для придания устойчивости к канамицину и выращивания инфицированных бактерий в среде, содержащей в противном случае летальную концентрацию канамицина. [ нужна ссылка ]
Этот результат был расширен за счет вставки чужеродной ДНК, экспрессирующей чужеродный пептид, в ген 3 фага fd, а не в межгенную последовательность, так что чужеродный пептид появляется на поверхности фага как часть адсорбционного белка гена 3. [ 31 ] [ 32 ] [ 33 ] Фаг, несущий чужеродный пептид, затем можно обнаружить с помощью соответствующих антител. Обратной стороной этого подхода является вставка ДНК, кодирующей антитела, в ген 3 и обнаружение их присутствия с помощью соответствующих антигенов. [ 34 ]
Эти методы с годами расширялись разными способами, например, путем вставки чужеродной ДНК в гены, кодирующие белки фаговой оболочки, отличные от гена 3, и/или дублирования интересующего гена для модификации только некоторых из соответствующих генных продуктов. Технология фагового дисплея широко используется для многих целей. [ 35 ] [ 36 ] [ 37 ]
Материаловедение и нанотехнологии
[ редактировать ]Фаги Ff были разработаны для таких применений, как восстановительные, электрохимические, фотоэлектрические, каталитические, сенсорные устройства и устройства цифровой памяти, особенно Анжелой Белчер и ее коллегами. [ 6 ] [ 38 ] [ 39 ] [ 40 ] [ 41 ] [ 42 ] [ 43 ] [ 44 ] [ 45 ] [ чрезмерное цитирование ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Рашед I, Оберер Э (декабрь 1986 г.). «Ff-колифаги: структурные и функциональные взаимоотношения» . Микробиологические обзоры . 50 (4): 401–27. дои : 10.1128/MR.50.4.401-427.1986 . ПМК 373080 . ПМИД 3540571 .
- ^ Май-Прохнов А., Хуэй Дж.Г., Кьеллеберг С., Раконьяк Дж., Макдугалд Д., Райс С.А. (июль 2015 г.). « Большие вещи в маленьких упаковках: генетика нитчатых фагов и влияние на приспособленность их хозяина » . Обзоры микробиологии FEMS . 39 (4): 465–87. дои : 10.1093/femsre/fuu007 . HDL : 10453/65260 . ПМИД 25670735 .
- ^ Раконьяк Дж., Бас Б., Дерда Р., ред. (2017). Нитчатый бактериофаг в био/нано/технологиях, бактериальном патогенезе и экологии . Темы исследования границ. Фронтирс Медиа С.А. дои : 10.3389/978-2-88945-095-4 . ISBN 978-2-88945-095-4 .
- ^ Мораг О., Абрамов Г., Голдборт А. (декабрь 2011 г.). «Сходства и различия внутри членов семейства Ff вирусов нитчатых бактериофагов» . Журнал физической химии Б. 115 (51): 15370–9. дои : 10.1021/jp2079742 . ПМИД 22085310 .
- ^ Hay ID, Литгоу Т. (июнь 2019 г.). «Нитчатые фаги: мастера микробной экономики совместного использования» . Отчеты ЭМБО . 20 (6). дои : 10.15252/эмбр.201847427 . ПМК 6549030 . ПМИД 30952693 .
- ^ Перейти обратно: а б с Раконжак Дж., Беннетт Нью-Джерси, Спаньоло Дж., Гагич Д., Рассел М. (2011). «Нитчатый бактериофаг: биология, фаговый дисплей и применение нанотехнологий». Актуальные проблемы молекулярной биологии . 13 (2): 51–76. ПМИД 21502666 .
- ^ Раконьяк Дж., Рассел М., Ханум С., Брук С.Дж., Райич М. (2017). «Нитчатый фаг: структура и биология». В Лим Т.С. (ред.). Рекомбинантные антитела к инфекционным заболеваниям . Достижения экспериментальной медицины и биологии. Том. 1053. Чам: Springer International Publishing. стр. 1–20. дои : 10.1007/978-3-319-72077-7_1 . ISBN 978-3-319-72076-0 . ПМИД 29549632 .
- ^ «Нобелевская премия по химии 2018» . NobelPrize.org . Проверено 10 апреля 2021 г.
- ^ Пратт Д., Цаголов Х., Эрдал В.С. (ноябрь 1966 г.). «Условно-летальные мутанты малого нитчатого колифага М13. I. Выделение, комплементация, уничтожение клеток, время действия цистронов». Вирусология . 30 (3): 397–410. дои : 10.1016/0042-6822(66)90118-8 . ПМИД 5921643 .
- ^ Пратт Д., Цаголов Х., Бодуэн Дж. (сентябрь 1969 г.). «Условно-летальные мутанты малого нитчатого колифага M13. II. Два гена белков оболочки». Вирусология . 39 (1): 42–53. дои : 10.1016/0042-6822(69)90346-8 . ПМИД 5807970 .
- ^ Мессинг Дж. (апрель 1991 г.). «Клонирование фага М13 или как лучше всего использовать биологию». Джин . 100 : 3–12. дои : 10.1016/0378-1119(91)90344-б . ПМИД 2055478 .
- ^ Перейти обратно: а б Херрманн Р., Нойгебауэр К., Центграф Х., Шаллер Х. (февраль 1978 г.). «Транспозиция последовательности ДНК, определяющей устойчивость к канамицину, в одноцепочечный геном бактериофага fd». Молекулярная и общая генетика . 159 (2): 171–8. дои : 10.1007/BF00270890 . ПМИД 345091 . S2CID 22923713 .
- ^ Саттар С, Беннетт, Нью-Джерси, Вен В.С., Гатри Дж.М., Блэквелл Л.Ф., Конвей Дж.Ф., Раконжак Дж. (2015). «Ff-нано, короткие функционализированные наностержни, полученные из нитчатого бактериофага Ff (f1, fd или M13)» . Границы микробиологии . 6 : 316. дои : 10.3389/fmicb.2015.00316 . ПМЦ 4403547 . ПМИД 25941520 .
- ^ Перейти обратно: а б Штраус С.К., Бо Х.Э. (2018). «Белки и сборка нитевидных бактериофагов». Вирусные белки и нуклеопротеиновые комплексы . Субклеточная биохимия. Том. 88. стр. 261–279. дои : 10.1007/978-981-10-8456-0_12 . ISBN 978-981-10-8455-3 . ПМИД 29900501 .
- ^ Бек Э., Зоммер Р., Ауэрсвальд Э.А., Курц С., Цинк Б., Остербург Г. и др. (декабрь 1978 г.). «Нуклеотидная последовательность ДНК бактериофага» . Исследования нуклеиновых кислот . 5 (12): 4495–503. дои : 10.1093/нар/5.12.4495 . ПМЦ 342768 . ПМИД 745987 .
- ^ Бек Э., Цинк Б. (декабрь 1981 г.). «Нуклеотидная последовательность и организация генома нитчатых бактериофагов fl и fd». Джин . 16 (1–3): 35–58. дои : 10.1016/0378-1119(81)90059-7 . ПМИД 6282703 .
- ^ Рассел М., Линдерот Н.А., Сали А. (июнь 1997 г.). «Сборка нитчатых фагов: вариация на тему экспорта белка». Джин . 192 (1): 23–32. дои : 10.1016/s0378-1119(96)00801-3 . ПМИД 9224870 .
- ^ Ру С., Крупович М., Дейли Р.А., Борхес А.Л., Найфач С., Шульц Ф. и др. (ноябрь 2019 г.). «Загадочные иновирусы, как выяснилось, широко распространены среди бактерий и архей во всех биомах Земли» . Природная микробиология . 4 (11): 1895–1906. дои : 10.1038/s41564-019-0510-x . ПМК 6813254 . ПМИД 31332386 .
- ^ Лоули Т.Д., Климке В.А., Габбинс М.Дж., Фрост Л.С. (июль 2003 г.). «Конъюгация F-фактора представляет собой настоящую систему секреции IV типа» . Письма FEMS по микробиологии . 224 (1): 1–15. дои : 10.1016/S0378-1097(03)00430-0 . ПМИД 12855161 .
- ^ Крейг Л., Форест К.Т., Майер Б. (июль 2019 г.). «Пили IV типа: динамика, биофизика и функциональные последствия». Обзоры природы. Микробиология . 17 (7): 429–440. дои : 10.1038/s41579-019-0195-4 . ПМИД 30988511 . S2CID 115153017 .
- ^ Беннетт, Нью-Джерси, Раконяк Дж. (февраль 2006 г.). «Разблокирование вириона нитчатого бактериофага во время инфекции опосредуется доменом C pIII». Журнал молекулярной биологии . 356 (2): 266–73. дои : 10.1016/j.jmb.2005.11.069 . ПМИД 16373072 .
- ^ Хоффманн-Томс С., Якоб Р.П., Шмид FX (апрель 2014 г.). «Энергетическая связь между функциональными участками гена-3-белка при заражении фагом fd». Журнал молекулярной биологии . 426 (8): 1711–22. дои : 10.1016/j.jmb.2014.01.002 . ПМИД 24440124 .
- ^ Хоффманн Берлинг Х., Мейз Р. (март 1964 г.). «Высвобождение мужских бактериофагов из выживших бактерий-хозяев БАКТЕРИИ». Вирусология . 22 (3): 305–13. дои : 10.1016/0042-6822(64)90021-2 . ПМИД 14127828 .
- ^ Ло Б., Хаазе М., Мюллер Л., Кун А., Лептин С. (апрель 2017 г.). «Белок трансмембранного морфогенеза gp1 нитчатых фагов содержит мотивы Walker A и Walker B, необходимые для сборки фага» . Вирусы . 9 (4): 73. дои : 10.3390/v9040073 . ПМЦ 5408679 . ПМИД 28397779 .
- ^ Рапоза MP, Webster RE (май 1995 г.). «Продукты гена I и перекрывающегося внутрирамочного гена XI необходимы для сборки нитчатого фага». Журнал молекулярной биологии . 248 (3): 627–38. дои : 10.1006/jmbi.1995.0247 . ПМИД 7752229 .
- ^ Гриффит Дж., Мэннинг М., Данн К. (март 1981 г.). «Нитчатый бактериофаг сжимается в полые сферические частицы при воздействии на границу раздела хлороформ-вода». Клетка . 23 (3): 747–53. дои : 10.1016/0092-8674(81)90438-4 . ПМИД 7226228 . S2CID 46531024 .
- ^ Мэннинг М., Гриффит Дж. (январь 1985 г.). «Ассоциация I-форм М13 и сфероидов с липидными везикулами». Архив биохимии и биофизики . 236 (1): 297–303. дои : 10.1016/0003-9861(85)90629-0 . ПМИД 3966795 .
- ^ Стопар Д., Спруйт Р.Б., Вольфс К.Дж., Хемминга М.А. (июль 1998 г.). «Имитирование начальных взаимодействий разборки белка оболочки бактериофага M13 в модельных мембранных системах». Биохимия . 37 (28): 10181–7. дои : 10.1021/bi9718144 . ПМИД 9665724 .
- ^ Робертс Л.М., Данкер А.К. (октябрь 1993 г.). «Структурные изменения, сопровождающие сокращение нитчатого фага fd, вызванное хлороформом». Биохимия . 32 (39): 10479–88. дои : 10.1021/bi00090a026 . ПМИД 8399194 .
- ^ Сюэ, Бин; Блокель, Дэвид; Хабчи, Джонни; Уверский, Алексей Васильевич; Курган, Лукаш; Уверский Владимир Н.; Лонги, Соня (2014). «Структурное нарушение вирусных белков» . Химические обзоры . 114 (13): 6880–6911. дои : 10.1021/cr4005692 . ISSN 0009-2665 . ПМИД 24823319 .
- ^ Смит, Г. (1985). «Нитевидный слитый фаг: новые векторы экспрессии, которые отображают клонированные антигены на поверхности вириона» . Наука . 228 (4705): 1315–1317. Бибкод : 1985Sci...228.1315S . дои : 10.1126/science.4001944 . ISSN 0036-8075 . ПМИД 4001944 .
- ^ Пармли, Стивен Ф.; Смит, Джордж П. (1988). «Выбираемые антителами нитчатые фаговые векторы fd: аффинная очистка генов-мишеней» . Джин . 73 (2): 305–318. дои : 10.1016/0378-1119(88)90495-7 . ISSN 0378-1119 . ПМИД 3149606 .
- ^ Вебстер, RE, 2001. Биология нитчатых фагов. В: Барбас III, К.Ф., Бертон, Д.Р., Скотт, Дж.К., Сильверман, Г.Дж. (ред.), Фаговый дисплей: Лабораторное руководство. Лабораторное издательство Колд-Спринг-Харбор, Колд-Спринг-Харбор, Нью-Йорк, стр. 1.1–1.37.
- ^ Зима, Грег; Гриффитс, Эндрю Д.; Хокинс, Роберт Э.; Хугенбум, Хенни Р. (1994). «Создание антител с помощью технологии фагового дисплея» . Ежегодный обзор иммунологии . 12 (1): 433–455. дои : 10.1146/annurev.iy.12.040194.002245 . ISSN 0732-0582 . ПМИД 8011287 .
- ^ Приско А., Де Берардинис П. (2012). «Нитчатый бактериофаг ФД как система доставки антигена при вакцинации» . Международный журнал молекулярных наук . 13 (4): 5179–94. дои : 10.3390/ijms13045179 . ПМЦ 3344273 . ПМИД 22606037 .
- ^ Генри К.А., Арбаби-Гахруди М., Скотт Дж.К. (2015). «За пределами фагового дисплея: нетрадиционные применения нитчатого бактериофага в качестве носителя вакцин, терапевтических биологических препаратов и каркаса для биоконъюгации» . Границы микробиологии . 6 : 755. дои : 10.3389/fmicb.2015.00755 . ПМЦ 4523942 . ПМИД 26300850 .
- ^ Сиуд М (апрель 2019 г.). «Библиотеки фагового дисплея: от связующих к адресной доставке лекарств и терапии человека». Молекулярная биотехнология . 61 (4): 286–303. дои : 10.1007/s12033-019-00156-8 . ПМИД 30729435 . S2CID 73434013 .
- ^ Догич З (2016). «Нитевидные фаги как модельная система в физике мягких веществ» . Границы микробиологии . 7 : 1013. дои : 10.3389/fmicb.2016.01013 . ПМЦ 4927585 . ПМИД 27446051 .
- ^ О Д, Ци Дж, Лу Ю.К., Чжан Ю., Шао-Хорн Ю., Белчер А.М. (2013). «Биологически улучшенная конструкция катода для увеличения емкости и срока службы литий-кислородных батарей» . Природные коммуникации . 4 (1): 2756. Бибкод : 2013NatCo...4.2756O . дои : 10.1038/ncomms3756 . ПМК 3930201 . ПМИД 24220635 .
- ^ Дорваль Куршен Н.М., Клуг М.Т., Хуанг К.Дж., Вайдман М.С., Канту В.Дж., Чен П.Ю. и др. (2015). «Создание многофункциональных нанопористых композитов с вирусным шаблоном для тонкопленочных солнечных элементов: вклад морфологии и оптики в генерацию фототока». Журнал физической химии C. 119 (25): 13987–14000. дои : 10.1021/acs.jpcc.5b00295 . hdl : 1721.1/102981 . ISSN 1932-7447 .
- ^ Ли С.В., Белчер А.М. (2004). «Вирусное изготовление микро- и нановолокон методом электропрядения». Нано-буквы . 4 (3): 387–390. Бибкод : 2004NanoL...4..387L . дои : 10.1021/nl034911t . ISSN 1530-6984 .
- ^ Кейси Дж.П., Барберо Р.Дж., Хелдман Н., Белчер А.М. (ноябрь 2014 г.). «Универсальная активность ферментов de novo в капсидных белках из сконструированной библиотеки бактериофагов M13». Журнал Американского химического общества . 136 (47): 16508–14. дои : 10.1021/ja506346f . ПМИД 25343220 .
- ^ Чжан Г., Вэй С., Белчер А.М. (2018). «Биомаблоны нановолокон сульфида цинка как анодные материалы для натрий-ионных батарей». ACS Прикладные наноматериалы . 1 (10): 5631–5639. дои : 10.1021/acsanm.8b01254 . hdl : 1721.1/126086 . ISSN 2574-0970 . S2CID 104742577 .
- ^ Ли Л., Белчер А.М., Локи Д.К. (декабрь 2020 г.). «Моделирование избирательного связывания биологического шаблона с наноразмерной архитектурой: основная концепция сборки N-концевого домена на основе зажима с преимуществом связывающего кармана». Наномасштаб . 12 (47): 24214–24227. дои : 10.1039/D0NR07320B . ПМИД 33289758 . S2CID 227950477 .
- ^ Броган А.П., Хелдман Н., Халлетт Дж.П., Белчер А.М. (сентябрь 2019 г.). «Термически устойчивые биожидкости бактериофага М13, не содержащие растворителей, разработанные для высокой совместимости с безводными ионными жидкостями». Химические коммуникации . 55 (72): 10752–10755. дои : 10.1039/C9CC04909F . hdl : 1721.1/125988 . ПМИД 31432818 . S2CID 201115233 .