Кудрявый
| Канал секреции Керли | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Организм | |||
| Символ | CsgG | ||
| Входить | 945619 | ||
| ПДБ | 3X2R | ||
| RefSeq (мРНК) | NC_000913.3 | ||
| RefSeq (защита) | НП_415555.1 | ||
| ЮниПрот | P0AEA2 | ||
| Другие данные | |||
| хромосома | Геномный: 1,1 - 1,1 Мб | ||
| |||
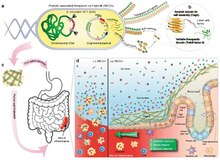
Белок Curli представляет собой тип амилоидных волокон, вырабатываемых некоторыми штаммами энтеробактерий . Это внеклеточные волокна, расположенные на таких бактериях, как E. coli и Salmonella spp. [ 2 ] Эти волокна способствуют поведению клеточного сообщества посредством образования биопленок во внеклеточном матриксе . Амилоиды связаны с несколькими нейродегенеративными заболеваниями человека, такими как болезнь Альцгеймера, болезнь Хантингтона, болезнь Паркинсона и прионные заболевания. [ 2 ] [ 3 ] Изучение кудрей может помочь понять болезни человека, которые, как считается, возникают из-за неправильного образования амилоидных волокон. [ 2 ] Курчавые пили обычно собираются посредством внеклеточного пути преципитации нуклеации . [ 4 ]
Биосинтез и регуляция генов
[ редактировать ]Удобный способ идентифицировать гены, важные для производства завитков, — это выращивание курчавых бактерий на чашках с добавлением диазокрасителя Конго красный, который вызывает красное смещение. [ 5 ] Волокна Curli и, следовательно, белок Curli кодируются двумя дивергентно транскрибируемыми оперонами E. coli: оперонами csgBAC и csgDEFG. Всего эти опероны кодируют как минимум семь белков. Опероны agfBA и agfDEFG, идентифицированные у видов Salmonella, гомологичны оперонам csgBAC и csgDEFG. [ 6 ] [ 7 ] Оперон csgBAC отвечает за кодирование трех белков CsgB, CsgA и CsgC — все они ответственны либо за образование основной субъединицы внутри волокна курли, либо за его ингибирование. [ 7 ] Оперон csgDEFG кодирует белки CsgD, CsgE, CsgF и CsgG и отвечает за сборку, транслокацию и регуляцию белка curli. [ 7 ]
CsgD является положительным регулятором транскрипции оперона csgBAC, но не регулирует его собственную экспрессию. Оперон csgBA кодирует основную структурную субъединицу Curli, CsgA, а также белок-нуклеатор CsgB. Дальнейшие исследования все еще необходимы, чтобы увидеть, что стимулирует экспрессию или активность CsgD, но некоторые данные свидетельствуют о том, что его активация вызвана фосфорилированием остатка аспарагиновой кислоты N-концевого принимающего домена. Поскольку CsgD должен присутствовать для активности промотора csgBA, предполагается, что регуляторы экспрессии CsgD также влияют на экспрессию csgBA. [ 2 ]
Многие факторы окружающей среды играют роль в экспрессии генов Curli. Долгое время считалось, что рост бактерий при температуре ниже 30 °C способствует экспрессии гена curli. [ 2 ] Однако теперь известно, что экспрессия Curli зависит от штамма и состояния. Например, мутации промотора CsgD могут привести к экспрессии curli при 37 °C. [ 8 ] Кроме того, при недостатке соли и питательных веществ, таких как азот, фосфат или железо, стимулируется экспрессия генов Curli. [ 2 ]
Функции
[ редактировать ]Амилоиды связаны с такими заболеваниями, как болезнь Альцгеймера, Паркинсона, Хантингтона, волчанка и многими другими. [ 7 ] [ 9 ] Белок Curli считается PAMP ( молекулярный образец, связанный с патогеном ); его структура β-листа распознается врожденной иммунной системой и активирует TLR2 (Toll-подобный рецептор 2). [ 7 ] Затем это вызывает ответную реакцию, вызывая провоспалительную реакцию, при которой провоспалительные цитокины и хемокины привлекаются для инициации воспалительной реакции. [ 7 ]
Однако Керли имеет дополнительные функции (поэтому его называют «функциональным амилоидом»). [ 9 ] ), в том числе является основным компонентом биопленки, образуемой грамотрицательными бактериями, такими как E. coli и Salmonella spp. [ 6 ] [ 7 ] [ 9 ] Эти биопленки позволяют грамотрицательным бактериям лучше колонизироваться в данной среде, защищая их от окислительного стресса и обезвоживания. [ 6 ] [ 7 ] Однако эти биопленки вызывают серьезную озабоченность. Поскольку эти биопленки позволяют бактериям выживать в условиях химического и физического стресса в окружающей среде, они не только делают пациентов более восприимчивыми к инфекции при использовании общих бытовых приборов, но и, как было показано, кудряшки и другие биопленки снижают иммунный ответ инфицированных людей и снижают действие противомикробных препаратов. . [ 6 ] Белки Curli и биопленки очень устойчивы к химическим стрессорам до такой степени, что требуется более сильная предварительная обработка, чтобы Curli разложились или растворились в додецилсульфате натрия ( SDS ). [ 6 ]
Образующиеся волокна Керли участвуют во многих различных типах и функциях в клетке, например, в агрегации клеток, действуют как клей для различных белков на поверхности клетки, используются в образовании биопленок определенных бактерий и содержат химические вещества для определения кворума, а также играет важную роль в воспалительной реакции у людей. [ 10 ] Образование Curli также необходимо строго регулировать, поскольку его накопление приводит к агрегации амилоидных белков в организме, что приводит к разрушению пути и мешает передаче сигналов клетками. [ 11 ]
Структура
[ редактировать ]Основные компоненты (субъединицы) белка curli состоят из белков CsgA и CsgB.
CsgA
[ редактировать ]CsgA является основной субъединицей белка Curli и весит примерно 13,1 килодальтон. Этот белок состоит из трех доменов, которые имеют тенденцию агрегироваться и образовывать амилоидные фибриллы: одиночный пептид, N-концевая последовательность из 22 аминокислот (используется для секреции) и основной амилоидный домен на С-концевой последовательности. [ 6 ] [ 9 ] Коровой амилоидный домен состоит из 5 повторяющихся (но не точных) последовательностей, вращающихся вокруг последовательности: Ser-X 5 -Gln-X-Gly-X-Gly-Asn-X-Ala-X 3 -Gln. [ 9 ] Эта повторяющаяся последовательность является характерной субъединицей, которая образует агрегируемый β-лист . [ 9 ]
КсгБ
[ редактировать ]CsgB, также известный как минорная субъединица, необходим для зарождения и организации CsgA в завитковые волокна на поверхности клеток. [ 7 ] CsgB имеет повторяющуюся последовательность, очень похожую на CsgA, за исключением того, что одна из 5 повторяющихся последовательностей содержит дополнительные аминокислоты: Lys133, Arg140, Arg14 и Arg151. [ 6 ] Это изменение в последней субъединице (известной как субъединица R5) необходимо. Без присутствия субъединицы R5 или изменений внутри субъединицы CsgA секретируется из клетки в неполимеризованной форме и не может должным образом формироваться на клеточных поверхностях. [ 6 ] [ 9 ]
CsgC
[ редактировать ]Лишь недавно было обнаружено, что субъединица CsgC предотвращает агрегацию и полимеризацию белка CsgA. Без него существует вероятность образования амилоидных фибрилл и даже гибели клеток. [ 7 ] Многочисленные эксперименты по выделению CsgC отдельно от субъединиц CsgA и CsgB привели к агрегации CsgA в фибриллы, что, возможно, может привести к последующим эффектам, наблюдаемым при таких заболеваниях, как болезнь Альцгеймера. [ 6 ] Молярное соотношение, необходимое для того, чтобы CsgC ингибировал CsgA, составляет 1:500, что означает, что только 1 белок CsgC необходим для ингибирования 500 белков CsgA в формировании структур амилоидных фибрилл. [ 6 ] [ 12 ] Предполагается, что CsgC поэтому считается шапероном, поскольку он предотвращает дальнейшее зарождение CsgA и позволяет CsgA формироваться в его правильную структуру вместо агрегации. [ 6 ]
Ссылки
[ редактировать ]- ^ Правешотинунт П., Дурадж-Татте А.М., Гельфат И., Бахл Ф., Чоу Д.Б., Джоши Н.С. (декабрь 2019 г.). «Разработал E. coli Nissle 1917 для доставки привязанных к матрице терапевтических доменов в кишечник» . Природные коммуникации . 10 (1): 5580. Бибкод : 2019NatCo..10.5580P . дои : 10.1038/s41467-019-13336-6 . ПМК 6898321 . ПМИД 31811125 .
- ^ Jump up to: а б с д и ж Барнхарт М.М., Чепмен М.Р. (2006). «Биогенез и функция курли» . Ежегодный обзор микробиологии . 60 : 131–147. дои : 10.1146/annurev.micro.60.080805.142106 . ПМЦ 2838481 . ПМИД 16704339 .
- ^ Чепмен М.Р., Робинсон Л.С., Пинкнер Дж.С., Рот Р., Хойзер Дж., Хаммар М. и др. (февраль 2002 г.). «Роль оперонов Escherichia coli curli в управлении образованием амилоидных волокон» . Наука . 295 (5556): 851–855. Бибкод : 2002Sci...295..851C . дои : 10.1126/science.1067484 . ПМЦ 2838482 . ПМИД 11823641 .
- ^ Хаммар М., Биан З., Нормарк С. (июнь 1996 г.). «Нуклеатор-зависимая межклеточная сборка адгезивных органелл курли в Escherichia coli» . Труды Национальной академии наук Соединенных Штатов Америки . 93 (13): 6562–6566. Бибкод : 1996PNAS...93.6562H . дои : 10.1073/pnas.93.13.6562 . ПМК 39064 . ПМИД 8692856 .
- ^ Коллинсон С.К., Дойг ПК, Доран Дж.Л., Клотье С., Траст Т.Дж., Кей В.В. (январь 1993 г.). «Тонкие агрегированные фимбрии опосредуют связывание Salmonella enteritidis с фибронектином» . Журнал бактериологии . 175 (1): 12–18. дои : 10.1128/jb.175.1.12-18.1993 . ЧВК 196092 . ПМИД 8093237 .
- ^ Jump up to: а б с д и ж г час я дж к Ван Гервен Н., Кляйн Р.Д., Хультгрен С.Дж., Ремаут Х. (ноябрь 2015 г.). «Бактериальное образование амилоида: структурное понимание биогенеза курли» . Тенденции в микробиологии . 23 (11): 693–706. дои : 10.1016/j.tim.2015.07.010 . ПМЦ 4636965 . ПМИД 26439293 .
- ^ Jump up to: а б с д и ж г час я дж Tursi SA, Tükel Ç (декабрь 2018 г.). «Керли-содержащие кишечные биопленки внутри и снаружи: состав матрицы, иммунное распознавание и последствия заболеваний» . Обзоры микробиологии и молекулярной биологии . 82 (4): e00028–18, /mmbr/82/4/e00028–18.atom. дои : 10.1128/MMBR.00028-18 . ПМК 6298610 . ПМИД 30305312 .
- ^ Улич Г.А., Кин Дж.Э., Старейшина Р.О. (май 2001 г.). «Мутации в промоторе csgD, связанные с вариациями экспрессии curli в некоторых штаммах Escherichia coli O157:H7» . Прикладная и экологическая микробиология . 67 (5): 2367–2370. Бибкод : 2001ApEnM..67.2367U . дои : 10.1128/АЕМ.67.5.2367-2370.2001 . ПМК 92880 . ПМИД 11319125 .
- ^ Jump up to: а б с д и ж г Эванс М.Л., Чепмен М.Р. (август 2014 г.). «Биогенез курли: порядок из беспорядка» . Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1843 (8): 1551–1558. дои : 10.1016/j.bbamcr.2013.09.010 . ПМЦ 4243835 . ПМИД 24080089 .
- ^ Ботянски, Зофия; Тай, Пей Кун Р.; Нгуен, Питер К.; Нуссбаумер, Мартин Г.; Джоши, Нил С. (октябрь 2015 г.). «Сконструированные каталитические биопленки: сайт-специфическая иммобилизация ферментов на нановолокнах Curli E. coli: каталитические биопленки с использованием инженерных волокон Curli» . Биотехнология и биоинженерия . 112 (10): 2016–2024. дои : 10.1002/бит.25638 . ПМИД 25950512 . S2CID 9350467 .
- ^ Эванс, Марджери Л.; Чепмен, Мэтью Р. (август 2014 г.). «Биогенез курли: порядок из беспорядка» . Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1843 (8): 1551–1558. дои : 10.1016/j.bbamcr.2013.09.010 . ISSN 0006-3002 . ПМЦ 4243835 . ПМИД 24080089 .
- ^ Эванс М.Л., Чорелл Э., Тейлор Дж.Д., Оден Дж., Гётесон А., Ли Ф. и др. (февраль 2015 г.). «Бактериальная система курли обладает мощным и селективным ингибитором образования амилоида» . Молекулярная клетка . 57 (3): 445–455. doi : 10.1016/j.molcel.2014.12.025 . ПМЦ 4320674 . ПМИД 25620560 .
Дальнейшее чтение
[ редактировать ]- Дема Б., Чарльз Н. (январь 2016 г.). «Аутоантитела при СКВ: особенности, изотипы и рецепторы» . Антитела . 5 (1): 2. дои : 10.3390/antib5010002 . ПМК 6698872 . ПМИД 31557984 .
- Галло П.М., Рапсински Г.Дж., Уилсон Р.П., Оппонг Г.О., Шрирам У., Гулиан М. и др. (июнь 2015 г.). «Амилоидно-ДНК-композиты бактериальных биопленок стимулируют аутоиммунитет» . Иммунитет . 42 (6): 1171–1184. doi : 10.1016/j.immuni.2015.06.002 . ПМК 4500125 . ПМИД 26084027 .
- Коно Д.Х., Баккала Р., Теофилопулос А.Н. (декабрь 2013 г.). «TLR и интерфероны: центральная парадигма аутоиммунитета» . Современное мнение в иммунологии . 25 (6): 720–727. дои : 10.1016/j.coi.2013.10.006 . ПМК 4309276 . ПМИД 24246388 .
- Турси С.А., Ли Э.Ю., Медейрос Н.Дж., Ли М.Х., Никастро Л.К., Буттаро Б. и др. (апрель 2017 г.). «Бактериальные амилоидные курли действуют как носитель ДНК, вызывая аутоиммунный ответ через TLR2 и TLR9» . ПЛОС Патогены . 13 (4): e1006315. дои : 10.1371/journal.ppat.1006315 . ПМК 5406031 . ПМИД 28410407 .