Официальное обвинение

В химии формальный заряд ( FC или q* ) с ковалентной точки зрения химической связи — это гипотетический заряд, приписываемый атому в молекуле , при условии, что электроны во всех химических связях распределяются поровну между атомами, независимо от относительной электроотрицательности. . [1] [2] Проще говоря, формальный заряд — это разница между количеством валентных электронов атома в нейтральном свободном состоянии и числом, присвоенным этому атому в структуре Льюиса . При определении наилучшей структуры Льюиса (или преобладающей резонансной структуры ) для молекулы структура выбирается такая, чтобы формальный заряд каждого из атомов был как можно ближе к нулю. [2]
Формальный заряд любого атома в молекуле можно рассчитать по следующему уравнению:
где V — число валентных электронов нейтрального атома изолированно (в основном состоянии); L — число несвязывающих валентных электронов, принадлежащих этому атому в льюисовской структуре молекулы; B — общее число электронов , находящихся в связях с другими атомами молекулы. [2] Его также можно найти визуально, как показано ниже.
Формальный заряд и степень окисления присваивают номер каждому отдельному атому в составе соединения. Они сравниваются и противопоставляются в разделе ниже.
Примеры
[ редактировать ]- Пример: CO 2 — нейтральная молекула с 16 валентными электронами . Существуют разные способы нарисовать структуру Льюиса.
- Углерод одинарно связан с обоими атомами кислорода (углерод = +2, кислород = -1 каждый, общий формальный заряд = 0)
- Углерод связан одинарной связью с одним кислородом и двойной связью с другим (углерод = +1, двойной кислород = 0, одинарный кислород = -1, общий формальный заряд = 0)
- Углерод связан двойной связью с обоими атомами кислорода (углерод = 0, кислород = 0, общий формальный заряд = 0)
Несмотря на то, что все три структуры дали нам общий заряд, равный нулю, окончательная структура является лучшей, поскольку в молекуле вообще нет зарядов.
Изобразительный метод
[ редактировать ]Следующее эквивалентно:
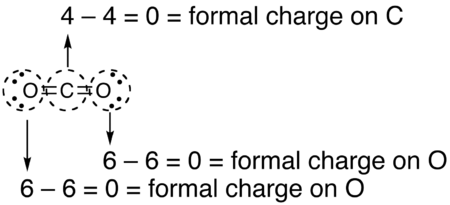
- Нарисуйте круг вокруг атома, для которого требуется формальный заряд (как в случае с диоксидом углерода, ниже).
- Подсчитайте количество электронов в «круге» атома. Поскольку круг разрезает ковалентную связь «пополам», каждая ковалентная связь считается за один электрон вместо двух.
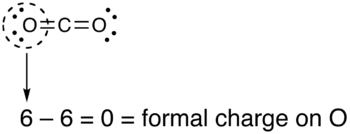
- Вычтите количество электронов в круге из числа валентных электронов изолированного нейтрального атома (в его основном состоянии), чтобы определить формальный заряд.
- Формальные заряды, рассчитанные для остальных атомов в этой структуре Льюиса диоксида углерода, показаны ниже.
Важно иметь в виду, что формальные обвинения являются именно формальными в том смысле, что данная система является формализмом. Формальная система зарядов — это всего лишь метод отслеживания всех валентных электронов, которые каждый атом приносит с собой при образовании молекулы.
Соглашения об использовании
[ редактировать ]В соответствии с соглашением органической химии формальные заряды являются важной особенностью правильно воспроизведенной структуры Льюиса-Кекуле , а структура, в которой отсутствуют ненулевые формальные заряды, считается неправильной или, по крайней мере, неполной. Формальные заряды располагаются в непосредственной близости от атома, несущего заряд. Для ясности они могут быть заключены в круг, а могут и не быть заключены в него.
Напротив, в неорганической химии это соглашение не соблюдается . Многие работники металлоорганических предприятий и большинство работников координационной химии опускают формальные обвинения, если только они не нужны для акцентирования внимания или для того, чтобы подчеркнуть конкретный момент. [3] Вместо этого верхний правый угол ⌝ будет нарисован после ковалентно связанного заряженного объекта, за которым, в свою очередь, сразу же следует общий заряд.

Верхний правый угол ⌝ иногда заменяется квадратными скобками, в которых заключены все заряженные виды, причем общий заряд снова указан в правом верхнем углу, сразу за скобками.
Это различие на практике проистекает из относительно простого определения порядка связей, количества валентных электронов и, следовательно, формального заряда для соединений, содержащих только элементы основной группы (хотя олигомерные соединения, такие как литийорганические реагенты и еноляты, имеют тенденцию изображаться в чрезмерно упрощенной и идеализированной манере). ), но переходные металлы имеют неопределенное количество валентных электронов, поэтому не существует однозначного способа присвоить формальные заряды.
Формальный заряд по сравнению со степенью окисления
[ редактировать ]Формальный заряд — это инструмент для оценки распределения электрического заряда внутри молекулы. [1] [2] Концепция состояний окисления представляет собой конкурирующий метод оценки распределения электронов в молекулах. Если сравнить формальные заряды и степени окисления атомов углекислого газа , можно получить следующие значения:
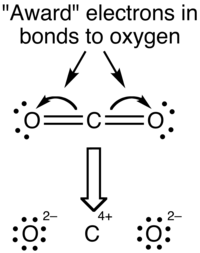
Причина разницы между этими значениями заключается в том, что формальные заряды и состояния окисления представляют собой фундаментально разные взгляды на распределение электронов между атомами в молекуле. При наличии формального заряда предполагается, что электроны в каждой ковалентной связи разделены точно поровну между двумя атомами в связи (отсюда и деление на два в методе, описанном выше). Формальный заряд молекулы CO 2 по существу показан ниже:
Ковалентный (совместный) аспект связи переоценивается при использовании формальных зарядов, поскольку в действительности вокруг атомов кислорода существует более высокая электронная плотность из-за их более высокой электроотрицательности по сравнению с атомом углерода. Наиболее эффективно это можно визуализировать на карте электростатического потенциала.
Согласно формализму степени окисления, электроны в связях «присуждаются» атому с большей электроотрицательностью . Вид степени окисления молекулы CO 2 показан ниже:
Состояния окисления переоценивают ионную природу связи; разница в электроотрицательности между углеродом и кислородом недостаточна, чтобы считать связи ионными по природе.
В действительности распределение электронов в молекуле находится где-то между этими двумя крайностями. Неадекватность простого представления о структуре Льюиса молекул привела к развитию более общеприменимой и точной теории валентных связей Слейтера , , Полинга и др., а затем и теории молекулярных орбиталей разработанной Малликеном и Хундом .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Хардингер, Стив. «Официальные обвинения» (PDF) . Калифорнийский университет, Лос-Анджелес . Архивировано из оригинала (PDF) 12 марта 2016 года . Проверено 11 марта 2016 г.
- ^ Перейти обратно: а б с д «Формальное обвинение» . Королевское химическое общество . Проверено 10 декабря 2021 г.
- ^ «Глава 48 Металлоорганическая химия» . Органическая химия . Клейден, Джонатан. Оксфорд: Издательство Оксфордского университета. 2001. С. 1311-1314 . ISBN 0198503474 . OCLC 43338068 .
{{cite book}}: CS1 maint: другие ( ссылка )