Глутаминолиз
Глутаминолиз ( глутамин + -лиз в ходе которых аминокислота глютамин расщепляется до глутамата , , аспартата , CO 2 , пирувата , лактата ) представляет собой серию биохимических реакций , аланина и цитрата . [1] [2]
Глутаминолитический путь
[ редактировать ]Глутаминолиз частично задействует этапы реакции цикла лимонной кислоты и малатно-аспартатного челнока .
Этапы реакции глутамина в α-кетоглутарат
[ редактировать ]Превращение аминокислоты глютамин в α-кетоглутарат происходит в две стадии реакции:
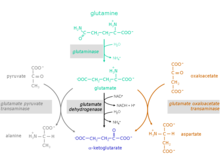
1. Гидролиз аминогруппы глютамина с образованием глутамата и аммония .Катализирующий фермент: глутаминаза (EC 3.5.1.2)
2. Глутамат может выводиться из организма или метаболизироваться до α-кетоглутарата.
Для превращения глутамата в α-кетоглутарат возможны три различные реакции:
Катализирующие ферменты:
- глутаматдегидрогеназа (GlDH), EC 1.4.1.2
- глутаматпируваттрансаминаза (GPT), также называемая аланинтрансаминазой (АЛТ), EC 2.6.1.2
- глутамат-оксалоацетат-трансаминаза (GOT), также называемая аспартат-трансаминазой (AST), EC 2.6.1.1 (компонент малат-аспартатного челнока)
Рекрутированные стадии реакции цикла лимонной кислоты и малат-аспартатного челнока
[ редактировать ]
- α-кетоглутарат + НАД + + КоАГ → сукцинил-КоА + НАДН+Н + + СО 2
катализирующий фермент: комплекс α-кетоглутаратдегидрогеназы
- сукцинил-КоА + GDP + P i → сукцинат + GTP
катализирующий фермент: сукцинил-КоА-синтетаза, КФ 6.2.1.4
- сукцинат + ФАД → фумарат + ФАДН 2
катализирующий фермент: сукцинатдегидрогеназа , EC 1.3.5.1
- фумарат + H 2 O → малат
катализирующий фермент: фумараза , EC 4.2.1.2
- малат + НАД + → оксалоацетат + НАДН + H +
катализирующий фермент: малатдегидрогеназа , EC 1.1.1.37 (компонент малат-аспартатного челнока)
- оксалоацетат + ацетил-КоА + H 2 O → цитрат + CoASH
катализирующий фермент: цитратсинтаза , EC 2.3.3.1
Этапы реакции от малата до пирувата и лактата
[ редактировать ]Превращение малата в пируват и лактат катализируется
- НАД(Ф)-зависимая малатдекарбоксилаза (яблочный фермент; EC 1.1.1.39 и 1.1.1.40) и
- лактатдегидрогеназа (ЛДГ; EC 1.1.1.27)
согласно следующим уравнениям:
- малат + НАД(П) + → пируват + НАД(Ф)H + H + + СО 2
- пируват + НАДН + Н + → молочные продукты + НАД +
Внутриклеточная компартментализация глутаминолитического пути
[ редактировать ]Реакции глутаминолитического пути протекают частично в митохондриях и частично в цитозоле (ср. схему метаболизма глутаминолитического пути).
Важный источник энергии в опухолевых клетках
[ редактировать ]Глутаминолиз происходит во всех пролиферирующих клетках. [3] такие как лимфоциты , тимоциты , колоноциты, адипоциты и особенно в опухолевых клетках. [1] Глутаминолиз использовался в терапевтических целях. [4] В опухолевых клетках цикл лимонной кислоты усекается из-за ингибирования фермента аконитазы (EC 4.2.1.3) высокими концентрациями активных форм кислорода (АФК). [5] [6] Аконитаза катализирует превращение цитрата в изоцитрат. С другой стороны, опухолевые клетки сверхэкспрессируют фосфатзависимую глутаминазу и НАД(Ф)-зависимую малатдекарбоксилазу. [7] [8] [9] [10] которые в сочетании с остальными стадиями реакции цикла лимонной кислоты от α-кетоглутарата до цитрата открывают возможность нового пути производства энергии - разложения аминокислоты глутамина до глутамата, аспартата, пирувата CO 2 , лактата и цитрата.
Помимо гликолиза в опухолевых клетках, еще одним важным элементом производства энергии является глутаминолиз. Высокие внеклеточные концентрации глютамина стимулируют рост опухоли и необходимы для трансформации клеток. [9] [11] С другой стороны, снижение уровня глютамина коррелирует с фенотипической и функциональной дифференцировкой клеток. [12]
Энергетическая эффективность глутаминолиза в опухолевых клетках
[ редактировать ]- один АТФ путем прямого фосфорилирования ВВП
- два АТФ от окисления ФАДН 2
- три АТФ одновременно для НАДН + Н + образуется в результате реакции α-кетоглутаратдегидрогеназы, реакции малатдегидрогеназы и реакции малатдекарбоксилазы.
Из-за низкой активности глутаматдегидрогеназы и глутаматпируваттрансаминазы в опухолевых клетках превращение глутамата в альфа-кетоглутарат происходит главным образом посредством глутаматоксалоацетаттрансаминазы. [13]
Преимущества глутаминолиза в опухолевых клетках
[ редактировать ]- Глутамин является наиболее распространенной аминокислотой в плазме и дополнительным источником энергии в опухолевых клетках, особенно когда производство гликолитической энергии низкое из-за большого количества димерной формы M2-PK .
- Глутамин и продукты его распада глутамат и аспартат являются предшественниками синтеза нуклеиновых кислот и серина .
- Глутаминолиз нечувствителен к высоким концентрациям активных форм кислорода (АФК). [14]
- Из-за укорочения цикла лимонной кислоты количество ацетил-КоА, проникающего в цикл лимонной кислоты, является низким, и ацетил-КоА доступен для синтеза жирных кислот и холестерина de novo . Жирные кислоты могут быть использованы для синтеза фосфолипидов или могут быть высвобождены. [15]
- Жирные кислоты представляют собой эффективное средство хранения водорода. Таким образом, высвобождение жирных кислот является эффективным способом избавиться от цитозольного водорода, образующегося в реакции гликолитической глицеральдегид-3-фосфатдегидрогеназы (ГАФД; ЕС 1.2.1.9). [16]
- Глутамат и жирные кислоты обладают иммунодепрессивным действием. Высвобождение обоих метаболитов может защитить опухолевые клетки от иммунных атак. [17] [18] [19]
- Обсуждалось, что пул глутамата может стимулировать эндергоническое поглощение других аминокислот системой ASC. [8]
- Глутамин может быть преобразован в цитрат без образования НАДН, что разобщает производство НАДН от биосинтеза. [3]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Кребс, штат Ха; Беллами Д. (1960). «Взаимное превращение глутаминовой кислоты и аспарагиновой кислоты в дышащих тканях» . Биохимический журнал . 75 (3): 523–529. дои : 10.1042/bj0750523 . ПМК 1204504 . ПМИД 14411856 .
- ^ Джин, Л; Алези, Дж.Н.; Канг, С. (14 июля 2016 г.). «Глутаминолиз как мишень терапии рака» . Онкоген . 35 (28): 3619–25. дои : 10.1038/onc.2015.447 . ПМК 5225500 . ПМИД 26592449 .
- ^ Jump up to: а б Фернандес-де-Коссио-Диас, Хорхе; Васкес, Алексей (18 октября 2017 г.). «Пределы аэробного метаболизма в раковых клетках» . Научные отчеты . 7 (1): 13488. Бибкод : 2017NatSR...713488F . дои : 10.1038/s41598-017-14071-y . ISSN 2045-2322 . ПМЦ 5647437 . ПМИД 29044214 .
- ^ «Повышение эффективности ингибиторов метаболизма глютамина в терапии рака» . Тенденции рака .
- ^ Гарднер, PR; Райнери I; Эпштейн Л.Б.; Белый CW (1995). «Супероксидный радикал и железо модулируют активность аконитазы в клетках млекопитающих» . Журнал биологической химии . 270 (22): 13399–13405. дои : 10.1074/jbc.270.22.13399 . ПМИД 7768942 .
- ^ Ким, К.Х.; Родригес А.М.; Каррико ПМ; Мелендес Дж.А. (2001). «Потенциальные механизмы ингибирования роста опухолевых клеток супероксиддисмутазой марганца». Антиоксиданты и окислительно-восстановительная сигнализация . 3 (3): 361–373. дои : 10.1089/15230860152409013 . ПМИД 11491650 .
- ^ Мацуно, Т; Гото I (1992). «Активность глутаминазы и глутаминсинтетазы при цирротической печени человека и гепатоцеллюлярной карциноме». Исследования рака . 52 (5): 1192–1194. ПМИД 1346587 .
- ^ Jump up to: а б Аледо Х.К., Сегура Х.А., Медина М.А., Алонсо Ф.Дж., Нуньес де Кастро I, Маркес Х. (1994). «Экспрессия фосфат-активируемой глутаминазы во время развития опухоли» . Письма ФЭБС . 341 (1): 39–42. дои : 10.1016/0014-5793(94)80236-X . ПМИД 8137919 . S2CID 12702894 .
- ^ Jump up to: а б Лобо С, Руис-Беллидо М.А., Аледо Х.С., Маркес Х., Нуньес Де Кастро I, Алонсо Ф.Дж. (2000). «Ингибирование экспрессии глутаминазы антисмысловой мРНК снижает рост и туморогенность опухолевых клеток» . Биохимический журнал . 348 (2): 257–261. дои : 10.1042/0264-6021:3480257 . ПМК 1221061 . ПМИД 10816417 .
- ^ Мазурек, С; Гримм Х; Оемке М; Вайсе Г; Тейгелькамп С; Эйгенбродт Э (2000). «Опухоль M2-PK и глутаминолитические ферменты в метаболическом сдвиге опухолевых клеток». Противораковые исследования . 20 (6Д): 5151–5154. ПМИД 11326687 .
- ^ Туровский, Джорджия; Рашид З; Хонг Ф; Мадри Дж.А.; Бассон, доктор медицинских наук (1994). «Глутамин модулирует фенотип и стимулирует пролиферацию клеточных линий рака толстой кишки человека». Исследования рака . 54 (22): 5974–5980. ПМИД 7954430 .
- ^ Спиттлер, А; Олер Р; Гетцингер П; Хольцер С; Рейсснер CM; Лейтмезер Дж; Рат В; Врба Ф; Фюггер Р; Больц-Нитулеску Г; Рот Э (1997). «Низкие концентрации глютамина индуцируют фенотипическую и функциональную дифференцировку миеломоноцитарных клеток U937» . Журнал питания . 127 (11): 2151–2157. дои : 10.1093/jn/127.11.2151 . ПМИД 9349841 .
- ^ Мацуно, Т (1991). «Путь окисления глутамата и его регуляция в линии HuH13 клеток гепатомы человека». Журнал клеточной физиологии . 148 (2): 290–294. дои : 10.1002/jcp.1041480215 . ПМИД 1679060 . S2CID 30893440 .
- ^ Стивен Дж. Ральф; Рафаэль Морено-Санчес; Иржи Неузил; Сара Родригес-Энрикес (24 августа 2011 г.). «Ингибиторы сукцината: хинонредуктаза/комплекс II регулируют выработку митохондриальными активных форм кислорода и защищают нормальные клетки от ишемического повреждения, но вызывают специфическую гибель раковых клеток» . Фармацевтические исследования . 28 (2695): 2695–2730. дои : 10.1007/s11095-011-0566-7 . ПМИД 21863476 . S2CID 21836546 . Проверено 1 ноября 2021 г.
В отличие от аконитазы, глутаминолиз относительно нечувствителен к уровню АФК.
- ^ Парло, РА; Коулман П.С. (1984). «Увеличенная скорость экспорта цитрата из митохондрий гепатомы, богатых холестерином. Укороченный цикл Кребса и другие метаболические разветвления холестерина митохондриальных мембран» . Журнал биологической химии . 259 (16): 9997–10003. дои : 10.1016/S0021-9258(18)90917-8 . ПМИД 6469976 .
- ^ Мазурек, С; Гримм Х; Бошек КБ; Ваупель П; Эйгенбродт Э (2002). «Пируваткиназа типа М2: перекресток в метаболоме опухоли» . Британский журнал питания . 87 : С23–С29. дои : 10.1079/BJN2001455 . ПМИД 11895152 .
- ^ Эк, HP; Дрингс П; Дрёге В. (1989). «Уровни глутамата в плазме, реактивность лимфоцитов и смерть у пациентов с бронхиальной карциномой». Журнал исследований рака и клинической онкологии . 115 (6): 571–574. дои : 10.1007/BF00391360 . ПМИД 2558118 . S2CID 23057794 .
- ^ Гримм, Х; Тибелл А; Норрлинд Б; Блехер С; Уилкер С; Швеммле К (1994). «Иммунорегуляция родительскими липидами: влияние соотношения жирных кислот n-3 и n-6». Журнал парентерального и энтерального питания . 18 (5): 417–421. дои : 10.1177/0148607194018005417 . ПМИД 7815672 .
- ^ Цзян, РГ; Брайс Р.П.; Хуробин Д.Ф. (1998). «Незаменимые жирные кислоты: молекулярная и клеточная основа их противоракового действия и клиническое значение». Критические обзоры по онкологии/гематологии . 27 (3): 179–209. дои : 10.1016/S1040-8428(98)00003-1 . ПМИД 9649932 .