SCIMP-белок
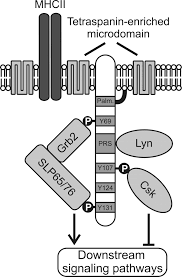
SLP65/SLP76, Csk -взаимодействующий мембранный белок, названный SCIMP, принадлежит к семейству трансмембранных адаптерных белков (TRAP), которые не связываются напрямую с рецепторами, такими как LAT , NTAL , LIME или LAX . [ 1 ] [ 2 ] [ 3 ] [ 4 ] SCIMP экспрессируется в антигенпрезентирующих клетках (APC), а именно В-клетках , дендритных клетках костного мозга и макрофагах .
Структура и взаимодействия
[ редактировать ]Как и другие TRAP, SCIMP имеет незначительный внеклеточный домен и трансмембранный домен, за которым следует внутриклеточный домен, содержащий несколько тирозинов и одну богатую пролином область (PRR). При фосфорилировании эти тирозины служат стыковочными доменами для белков, содержащих домены SH2 . В отличие от фосфотирозинов, богатые пролином области обычно менее восприимчивы к посттрансляционным модификациям и скорее являются мишенями конститутивных взаимодействий с домены SH3 . белками, содержащими [ 5 ] Было показано, что SCIMP взаимодействует через домены SH2 с киназой Csk, негативным регулятором киназ семейства Src , а также с адаптерами Slp65 /76 и Grb2 , которые являются ключевыми просигнальными растворимыми адаптерными белками в сигнальной сети лимфоцитов. SCIMP конститутивно связан с киназой Lyn через домен SH3.
Мембранная локализация
[ редактировать ]Некоторые из TRAP пальмитоилированы в пограничной области между трансмембранным и внутриклеточным доменом. Алифатическая цепь пальмитиновой кислоты прикреплена к бислою мембраны и, таким образом, влияет на нацеливание белка на микродомены мембраны . SCIMP также пальмитоилирован и связан с микродоменами, обогащенными тетраспанином (TEM). ТЕМ, в отличие от липидных рафтов , основаны больше на белок-белковых взаимодействиях, чем на взаимодействиях липид-липид/липид-белок. [ 6 ] Одним из резидентных белков ТЕМ является молекула MHC класса II . SCIMP присутствует в иммунологическом синапсе во время презентации антигена между Т-клеткой и антигенпрезентирующей клеткой (APC).
Исследования in vitro и предполагаемая функция
[ редактировать ]SCIMP становится сильно фосфорилированным после стимуляции MHC II. Исследования, проведенные со слитым белком CD25 -SCIMP, показали его способность индуцировать высвобождение кальция и фосфорилирование Erk при лечении антителами против CD25. Высвобождение кальция было еще сильнее в мутантном белке CD25-SCIMP на стороне связывания Csk. Указание на петлю отрицательной обратной связи, выполняемую киназой Csk. Слитые белки обычно используются для изучения сигнальной способности белков с небольшим внеклеточным доменом, скрытым для антител в мембранном гликокаликсе . Однако нокдаун SCIMP не влиял на высвобождение кальция после лечения антителами против MHC II, а только снижал уровень фосфорилирования Erk в более длительный момент времени (10 минут). [ 7 ]
Ссылки
[ редактировать ]- ^ Брдичка, Т.; Имрих, М.; Ангелисова, П.; Брдичкова Н.; Хорват, О.; Спика, Дж.; Хильгерт, И.; Луськова П.; Драбер, П.; Новак П.; Энгельс, Н.; Винандс, Дж.; Симеони, Л.; Остеррайхер, Дж.; Агуадо, Э.; Малиссен, М.; Шравен, Б.; Хорейси, В. (9 декабря 2002 г.). «Линкер активации не-Т-клеток (NTAL): трансмембранный белок-адаптер, участвующий в передаче сигналов иммунорецепторов» . Журнал экспериментальной медицины . 196 (12): 1617–1626. дои : 10.1084/jem.20021405 . ПМК 2196071 . ПМИД 12486104 .
- ^ Хур, ЭМ; Сын, М.; Ли, О.-Х.; Чой, Ю.Б.; Парк, К.; Ли, Х.; Юн, Ю. (10 ноября 2003 г.). «LIME, новый трансмембранный адаптерный белок, связывается с p56lck и опосредует активацию Т-клеток» . Журнал экспериментальной медицины . 198 (10): 1463–1473. дои : 10.1084/jem.20030232 . ПМК 2194117 . ПМИД 14610044 .
- ^ Вебер-младший (6 апреля 1998 г.). «Молекулярное клонирование кДНК, кодирующей pp36, тирозин-фосфорилированный адаптерный белок, избирательно экспрессируемый Т-клетками и естественными клетками-киллерами» . Джей Эксп Мед . 187 (7): 1157–1161. дои : 10.1084/jem.187.7.1157 . ПМК 2212210 . ПМИД 9529333 .
- ^ Чжу, М. (30 сентября 2002 г.). «Молекулярное клонирование нового гена, кодирующего мембраносвязанный адаптерный белок (LAX) в передаче сигналов лимфоцитов» . Журнал биологической химии . 277 (48): 46151–46158. дои : 10.1074/jbc.M208946200 . ПМИД 12359715 .
- ^ Уильямсон, член парламента (15 января 1994 г.). «Структура и функции богатых пролином участков белков» . Биохим. Дж . 297 (Часть 2) (2): 249–60. дои : 10.1042/bj2970249 . ПМЦ 1137821 . ПМИД 8297327 .
- ^ Степанек, Ондрей; Драбер, Питер; Хорейси, Вацлав (май 2014 г.). «Пальмитоилированные трансмембранные адаптерные белки в передаче сигналов лейкоцитов». Сотовая сигнализация . 26 (5): 895–902. doi : 10.1016/j.cellsig.2014.01.007 . ПМИД 24440308 .
- ^ Драбер, П.; Вонкова И.; Степанек, О.; Хрдинка, М.; Куцова, М.; Скопкова Т.; Отахал, П.; Ангелисова, П.; Хорейси, В.; Юнг, М.; Вайс, А.; Брдичка, Т. (19 сентября 2011 г.). «SCIMP, трансмембранный адаптерный белок, участвующий в передаче сигналов класса II главного комплекса гистосовместимости» . Молекулярная и клеточная биология . 31 (22): 4550–4562. дои : 10.1128/MCB.05817-11 . ПМК 3209250 . ПМИД 21930792 .