Кетоацилсинтаза
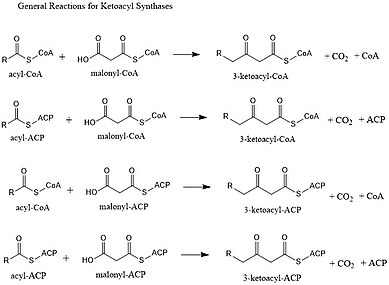
Кетоацилсинтазы (KSs) катализируют реакцию конденсации ацил-СоА или ацил-ацил-АПБ с малонил-СоА с образованием 3-кетоацил-КоА или с малонил-АПБ с образованием 3-кетоацил-АПБ. Эта реакция является ключевым этапом цикла синтеза жирных кислот, поскольку образующаяся ацильная цепь на два атома углерода длиннее, чем раньше. KS существуют как отдельные ферменты, как при синтезе жирных кислот типа II и синтезе поликетидов типа II, или как домены в крупных многодоменных ферментах, таких как синтазы жирных кислот типа I (FAS) и поликетидсинтазы (PKS). КС делятся на пять семейств: КС1, КС2, КС3, КС4 и КС5. [1]
Мультидоменные ферментные системы
[ редактировать ]Синтаза жирных кислот
[ редактировать ]Синтаза жирных кислот (FAS) — это ферментная система, участвующая в синтезе жирных кислот de novo. ФАС представляет собой итерационный мультифермент, состоящий из нескольких ферментов-компонентов, одним из которых является кетоацилсинтаза. Существует два типа ФАС: тип I и тип II. FAS типа I представляют собой высокоинтегрированные многодоменные ферменты. Они содержат дискретные функциональные домены, ответственные за специфическую каталитическую активность реакционной последовательности, либо на одной полипептидной цепи, либо на двух разных многофункциональных белках. ФАС типа II представляют собой диссоциированные системы, то есть составляющие их ферменты представляют собой независимые белки, кодируемые рядом отдельных генов. [2]
Поликетидсинтаза
[ редактировать ]Поликетидсинтазы (ПКС) структурно и функционально связаны с ФАС, которые представляют собой ферменты, катализирующие конденсацию активированных первичных метаболитов, таких как ацетил-КоА и малонил-КоА.
Основная реакция, которую они катализируют: [3]
- CO 2 -CH 2 -CO-S-CoA + CH 3 -CO-S-PKS → CH 3 -CO-CH 2 -CO-S-PKS + CoA-H + CO 2
Как и FAS, PKS будут использовать β-кетоацилсинтазу (KS), необязательную (малонил)ацилтрансферазу (MAT/AT) и фосфопантетиенилированный ацильный белок-носитель (ACP) или кофермент A (CoA). Они также оба использовали кеторедуктазу, дегидратазу и еноилредуктазу для создания полностью насыщенного ацильного остова. Однако, в отличие от FAS, PKS обычно используют большее количество биосинтетических строительных блоков и образуют более разнообразное количество длин хвостов. Шаги по сокращению, которые используют FAS, также не являются обязательными для PKS. Потенциально исключая их, можно создать более сложную модель функционализации. [4]
Существует три основных типа поликетидов: тип I, тип II и тип III. Тип I очень похож на FAS типа I, поскольку он содержит линейно выровненные и ковалентно слитые каталитические домены внутри крупных многофункциональных ферментов. Тип II имеет тенденцию представлять собой более диссоциируемый комплекс с монофункциональными ферментными доменами. Еще одно отличие ПКС заключается в том, что у них есть еще один тип — Тип III. ПКС III типа многофункциональны при выборе стартового узла, сборке цепи и содействии складыванию. [4]
Семейство кетоацилсинтазы 1
[ редактировать ]Почти все члены KS1 производятся бактериями, некоторые из них образованы эукариотами и только один - археей. Существует 12 подсемейств. Доминирующим ферментом в семействе KS1 является 3-кетоацил-АПЦ-синтаза III (KAS III), также известная как 3-оксоацил-АПФ-синтаза III и β-кетоацил-АПФ-синтаза III, и определяется как EC 2.3.1.180. [5] [1]
β-кетоацил-АСР-синтаза III
[ редактировать ]
Характерная реакция β-кетоацил-АПБ-синтазы III — малонил-АПБ + ацетил-КоА => ацетоацил-АПБ + СО 2 + КоА. Цистеин, гистидин и аспарагин образуют каталитическую триаду в KAS III, которая использует кинетический механизм пинг-понга. [1]
В Escherichia coli обычно обнаруживается один организм KAS III, KAS III слабо ингибируется тиолактомицином. [6] В одном и том же организме KAS III будет иметь оптимальный pH 7 и оптимальную температуру 30–37 °C. [7] Ингибиторы каждого организма, оптимальный pH и оптимальные температуры будут незначительно различаться. Однако эти цифры достаточно показательны для идеального окружения фермента в целом.
Семейство кетоацилсинтазы 2
[ редактировать ]Все ферменты KS2 производятся эукариотами, причем почти все из растений. Наиболее распространенными ферментами этого семейства являются 3-кетоацил-КоА-синтазы, элонгазы жирных кислот и ферменты, конденсирующие очень длинноцепочечные жирные кислоты. Наиболее распространенной общей характеристикой этих ферментов является EC 2.3.1.-; однако некоторые из них определены как 2.3.1.119. Большинство ферментов семейства KS2 катализируют реакции с образованием жирных кислот с очень длинной цепью. KS2 можно разделить на 10 подсемейств. [1]
3-кетоацил-КоА-синтаза I
[ редактировать ]3-кетоацил-КоА-синтаза I у Arabidopsis thaliana участвует в синтезе жирных кислот с очень длинной цепью, которые играют роль в биосинтезе воска. [8] Фермент катализирует следующую реакцию:
очень длинноцепочечный ацил-КоА + малонил-КоА ⇒ очень длинноцепочечный 3-оксоацил-КоА + КоА + CO 2 [9]
Это элонгаза, которая, по-видимому, участвует в производстве жирных кислот с очень длинной цепью, состоящей из 26 атомов углерода и длиннее. [10] Мефлюидид и перфлуидон являются селективными ингибиторами этого фермента. [11]
Семейство кетоацилсинтазы 3
[ редактировать ]Семейство KS3 — самое большое семейство в системе KS, состоящее из 14 подсемейств. Ферменты KS3 в основном производятся бактериями, а также небольшим количеством эукариот и архей. KS в этом семействе содержат домены KS, присутствующие как в FAS типа I, так и в модульном PKS типа I. Хотя в этом семействе есть много немного разных ферментов, наиболее распространенными являются два 3-кетоацил-АСР-синтаза I и синтаза II. [1]
3-кетоацил-АСР-синтаза I
[ редактировать ]3-Кетоацил-АСР-синтаза I ( EC 2.3.1.41 ) участвует в процессе удлинения цепи при ФАС II типа. Следствием отсутствия этого фермента будет дефицит ненасыщенных жирных кислот. В качестве субстратов он использует жирноацилтиоэфиры АСР и КоА и имеет специфичность, близкую к специфичности бета-кетоацил-АПФ-синтазы II. [12]
Обычно этот фермент используется в реакциях конденсации, а также декарбоксилирования и переноса ацильной группы.
Реакция протекает так:
- ацил-[белок-ацил-носитель] + малонил-[белок-ацил-носитель] → 3-оксоацил-[белок-ацил-носитель] + CO2 + [белок-ацил-носитель]
Например, в Escherichia coli этот фермент используется для построения жирных ацильных цепей посредством трехстадийной реакции конденсации Кляйзена. Реакция начнется с транс-тиоэтерификации субстрата ацильного праймера. Донорный субстрат затем декарбоксилируется, образуя промежуточный карбанион, который атакует C1 праймерного субстрата и создает удлиненную ацильную цепь. [13]
Известно, что ряд молекул являются ингибиторами синтазы I. Например, в некоторых случаях сам ацил-КоА ингибирует фермент в высоких концентрациях в Escherichia coli. Известно, что церуленин ингибирует синтазу I у Carthamustinctorius , Spinacia oleracea , Brassica napus , Allium ampeloprasu , Streptococcus pneumoniae , Escherichia coli , Mycobacterium Tuberculosis и многих других. В Mycobacterium Tuberculosis пальмитоил-КоА является ингибитором, а тиолактомицин также присутствует в ряде организмов. [12]
Оптимальный диапазон pH сильно варьируется от организма к организму, но в целом обычно находится в пределах 5,5–8,5. Оптимальная температура та же: 20 °C на одном конце спектра и 37 °C на другом.
3-кетоацил-АСР-синтаза II
[ редактировать ]3-кетоацил-АСР-синтаза II [14] участвует в ФАС II типа, которая встречается у растений и бактерий. Хотя он очень похож на бета-кетоацил-АСР-синтазу I, между ними есть небольшая разница. Одним из основных отличий является то, что синтаза II может легко использовать пальмитолеоил-АСР в качестве субстрата, а синтаза I — нет. Это позволяет контролировать температурно-зависимое регулирование жирнокислотного состава. [15]

Реакция протекает так:
- ( Z )-гексадек-11-еноил-[белок-ацил-носитель] + малонил-[белок-ацил-носитель] → ( Z )-3-оксооктадек-13-еноил-[белок-ацил-носитель] + CO 2 + [ацил -белок-носитель
у Streptococcus pneumoniae Например, синтаза II используется в качестве фермента, конденсирующего элонгацию. Он содержит каталитическую триаду Cys134, His337 и His303, а также Phe396 и молекулу воды, связанную с активным центром. Нуклеофильный цистеин необходим для образования ацил-фермента и участвует в общей конденсационной активности. Его 337 также используется для конденсационной активности, в частности, для стабилизации отрицательного заряда карбонила малонилтиоэфира в переходном состоянии. His303 используется для ускорения катализа путем депротонирования молекулы воды, чтобы обеспечить нуклеофильную атаку малоната, тем самым высвобождая бикарбонат. Phe396 действует как привратник, контролирующий порядок добавления субстрата. [16]
Известно несколько молекул, ингибирующих этот фермент. Например, церуленин ингибирует синтазу II у Spinacia oleracea , Allium ampelprasum , Escherichia coli и Streptococcus pneumonia . Ингибиторами Escherichia coli также являются платенсимицин, тиолактомицин и йодацетамид. [15]
Оптимальный диапазон pH будет варьироваться в зависимости от организма. У Escherichia coli диапазон составляет 5,5–6,1. У Streptococcus pneumoniae — 6,8–7, у Plasmodium falciparum — 7,5 и у Spinacia oleracea — 8,1–8,5. Оптимальная температура будет варьироваться, но по большей части останется в диапазоне 30–37 °C. [15]
Семейство кетоацилсинтазы 4
[ редактировать ]Большинство ферментов KS4 существует в эукариотических организмах, а остальные — в бактериях. Эти ферменты обычно классифицируются как халконсинтазы, стильбенсинтазы или ПКС типа III. Всего в KS4 существует 10 различных подсемейств. Обычно члены KS4 имеют каталитическую триаду Cys-His-Asn. И халконсинтазы, и стильбенсинтазы будут катализировать те же стадии ацильного переноса, декарбоксилирования и конденсации, что и в KS1. Однако они также будут дополнительно циклизировать и ароматизировать реакции до того, как образуется конечный халконовый продукт. [1]
Халконсинтаза
[ редактировать ]Халконсинтаза ( EC 2.3.1.74 ), также известная как нарингенин-халконсинтаза, отвечает за реакцию:
- 3 малонил-КоА + 4-кумароил-КоА → 4 КоА + нарингенин халкон + 3 CO 2
Например, у Medicago sativa реакция происходит в ходе стадии загрузки, стадии декарбоксилирования и, наконец, стадии элонгации. [17]
Ряд ингибиторов включает церуленин в Sinapis alba, Daucus carota и Phaseolus vulgaris , апигенин в Secale зерновых и Avena sativa и эриодиктиол в злаках Decale, Daucus carota и Xanthisma gracile. [17]
Оптимальный уровень pH, при котором может функционировать этот фермент, варьируется в зависимости от организма, но обычно находится где-то между 6 и 8. То же самое касается оптимальной температуры 30–45 °C. [17]
Семейство кетоацилсинтазы 5
[ редактировать ]Все члены семейства KS5 присутствуют в эукариотических клетках, в основном животных. Большинство этих ферментов можно отнести к элонгазам жирных кислот. Известно, что эти ферменты используются для удлинения жирных кислот с очень длинной цепью. KS5 имеет 11 подсемейств. О семействе KS5 пока мало что известно. В настоящее время ни один из конкретных ферментов не имеет номеров ЕС. Остатки каталитической триады не подтверждены. Были обнаружены консервативные остатки гистидина и аспарагина, причем гистидин находится в трансмембранной области. Однако консервативные остатки цистеина пока не известны. [1]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г Чен, Инфэй; Келли, Эрин Э.; Маслюк, Райан П.; Нельсон, Чарльз Л.; Канту, Дэвид К.; Рейли, Питер Дж. (1 октября 2011 г.). «Структурная классификация и свойства кетоацилсинтаз» . Белковая наука . 20 (10): 1659–1667. дои : 10.1002/pro.712 . ISSN 1469-896X . ПМЦ 3218358 . ПМИД 21830247 .
- ^ Швейцер, Экхарт; Хофманн, Йорг (1 сентября 2004 г.). «Микробные синтазы жирных кислот I типа (FAS): основные игроки в сети клеточных систем FAS» . Обзоры микробиологии и молекулярной биологии . 68 (3): 501–517. дои : 10.1128/MMBR.68.3.501-517.2004 . ISSN 1092-2172 . ПМК 515254 . ПМИД 15353567 .
- ^ «Поликетидсинтазы» . www.rasmusfrandsen.dk . Проверено 4 мая 2016 г.
- ^ Перейти обратно: а б Хертвек, Кристиан (15 июня 2009 г.). «Биосинтетическая логика поликетидного разнообразия». Angewandte Chemie, международное издание . 48 (26): 4688–4716. дои : 10.1002/anie.200806121 . ISSN 1521-3773 . ПМИД 19514004 .
- ^ «ЭНЗИМНАЯ запись 2.3.1.180» . expasy.org . Проверено 25 февраля 2017 г. .
- ^ Хандекар, СС; Джентри, ДР; Ван Аллер, GS; Уоррен, П; Сян, Х; Сильверман, К; Дойл, ML; Чемберс, Пенсильвания; Константинидис, АК; Брандт, М; Дэйнс, РА; Лонсдейл, Джей Ти (10 августа 2001 г.). «Идентификация, субстратная специфичность и ингибирование бета-кетоацил-ацил-протеин-синтазы-переносчика Streptococcus pneumoniae III (FabH)» . Журнал биологической химии . 276 (32): 30024–30. дои : 10.1074/jbc.M101769200 . ПМИД 11375394 .
- ^ «БРЕНДА - Информация о EC 2.3.1.180 - бета-кетоацил-[ацил-белок-носитель] синтаза III» . www.brenda-enzymes.org . Проверено 4 мая 2016 г.
- ^ Тодд, Дж.; Пост-Бейтенмиллер, Д.; Яворски, Дж. Г. (1 января 1999 г.). «KCS1 кодирует элонгазу жирных кислот 3-кетоацил-КоА-синтазу, влияющую на биосинтез воска у Arabidopsis thaliana» . Заводской журнал . 17 (2): 119–130. дои : 10.1046/j.1365-313x.1999.00352.x . ISSN 0960-7412 . ПМИД 10074711 .
- ^ «KCS1 - 3-кетоацил-КоА-синтаза 1 - Arabidopsis thaliana (кресс-салат мышиного уха) - ген и белок KCS1» . www.uniprot.org . Проверено 4 мая 2016 г.
- ^ Блэклок, Бренда Дж.; Яворски, Ян Г. (28 июля 2006 г.). «Субстратная специфичность 3-кетоацил-КоА-синтаз арабидопсиса». Связь с биохимическими и биофизическими исследованиями . 346 (2): 583–590. дои : 10.1016/j.bbrc.2006.05.162 . ПМИД 16765910 .
- ^ Треш, Стефан; Хейльманн, Моника; Кристиансен, Николь; Лузер, Ральф; Гроссманн, Клаус (01 апреля 2012 г.). «Ингибирование биосинтеза насыщенных жирных кислот с очень длинной цепью мефлюидидом и перфлуидоном, селективными ингибиторами 3-кетоацил-КоА-синтазы». Фитохимия . 76 : 162–171. doi : 10.1016/j.phytochem.2011.12.023 . ISSN 1873-3700 . ПМИД 22284369 .
- ^ Перейти обратно: а б «БРЕНДА - Информация о EC 2.3.1.41 - бета-кетоацил-[ацил-белок-носитель] синтаза I» . www.brenda-enzymes.org . Проверено 4 мая 2016 г.
- ^ фон Веттштайн-Ноулз, Пенни; Олсен, Йохан Г.; Макгуайр, Кирстен А.; Хенриксен, Анетт (1 февраля 2006 г.). «Синтез жирных кислот» . Журнал ФЭБС . 273 (4): 695–710. дои : 10.1111/j.1742-4658.2005.05101.x . ISSN 1742-4658 . ПМИД 16441657 .
- ^ «ЭНЗИМНАЯ запись 2.3.1.179» . expasy.org . Проверено 25 февраля 2017 г. .
- ^ Перейти обратно: а б с «БРЕНДА - Информация о EC 2.3.1.179 - бета-кетоацил-[ацил-белок-носитель] синтаза II» . www.brenda-enzymes.org . Проверено 4 мая 2016 г.
- ^ Чжан, Юн-Мэй; Херлберт, Джейсон; Уайт, Стивен В.; Рок, Чарльз О. (23 июня 2006 г.). «Роль воды активного центра, гистидина 303 и фенилаланина 396 в каталитическом механизме конденсирующего фермента элонгации Streptococcus pneumoniae» . Журнал биологической химии . 281 (25): 17390–17399. дои : 10.1074/jbc.M513199200 . ISSN 0021-9258 . ПМИД 16618705 .
- ^ Перейти обратно: а б с «БРЕНДА - Информация о EC 2.3.1.74 - нарингенин-халконсинтаза» . www.brenda-enzymes.org . Проверено 4 мая 2016 г.