Внутримолекулярная доставка агликона
Внутримолекулярная доставка агликонов представляет собой синтетическую стратегию построения гликанов . Этот подход обычно используется для образования сложных гликозидных связей .
Введение
[ редактировать ]Реакции гликозилирования — очень важные реакции в химии углеводов , приводящие к синтезу олигосахаридов , предпочтительно стереоселективным способом. Показано, что на стереоселективность этих реакций влияют как природа, так и конфигурация защитной группы при С-2 гликозильного донорного кольца. Хотя 1,2- транс -гликозиды (например, α-маннозиды и β-глюкозиды) можно легко синтезировать в присутствии участвующей группы (такой как OAc или NHAc) в положении C-2 гликозильного донорного кольца, 1 ,2- цис -гликозиды получить сложнее. 1,2- цис -гликозиды с α-конфигурацией (например, глюкозиды или галактозиды) часто можно получить с использованием неучаствующей защитной группы (такой как Bn или All) на гидроксигруппе C-2. Однако 1,2- цис -гликозиды с β-конфигурацией получить труднее всего и представляют собой наибольшую проблему в реакциях гликозилирования.
Один из самых последних подходов к получению 1,2- цис -β-гликозидов стереоспецифичным способом называется « Внутримолекулярная доставка агликона », и на основе этого подхода были разработаны различные методы. [ 1 ] В этом подходе гликозильный акцептор на первом этапе привязывается к C-2-O-защитной группе (X). При активации гликозильной донорной группы (Y) (обычно группы SR, OAc или Br) на следующем этапе связанный агликон захватывает образующийся ион оксокарбения в положении C-1 и переносится с той же стороны, что и OH-2. стереоспецифично образуя гликозидную связь. Выход этой реакции падает по мере увеличения объемности спирта.

Методы внутримолекулярной доставки агликона (IAD)
[ редактировать ]Углеродная привязка
[ редактировать ]Кислотно-катализируемое связывание с эфирами енолов
[ редактировать ]В этом методе донор гликозила защищен в положении C-2 группой OAc. Защитная группа C-2-OAc преобразуется в эфир енола с помощью реагента Теббе (Cp 2 Ti=CH 2 ), а затем гликозильный акцептор присоединяется к эфиру енола в условиях кислотного катализа с образованием смешанного ацеталя. На следующем этапе β-маннозид образуется при активации аномерной уходящей группы (Y) с последующей обработкой. [ 2 ]

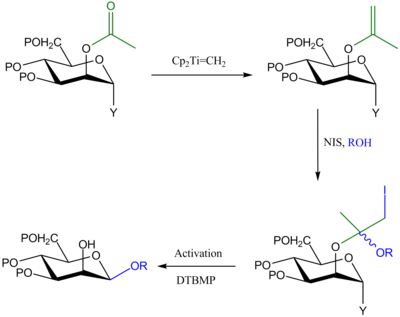
Привязка йода к эфирам енолов
[ редактировать ]Этот метод аналогичен предыдущему методу тем, что донор гликозила защищен у C-2 группой OAc, которая превращается в еноловый эфир с помощью реагента Теббе . Однако в этом подходе N -йодсукцинимид (NIS) используется для присоединения акцептора гликозила к еноловому эфиру, а на втором этапе активация аномерной уходящей группы приводит к внутримолекулярной доставке агликона к C-1 и образованию продукт 1,2- цис -гликозид. [ 3 ]
Привязка йода к проп-1-ениловым эфирам
[ редактировать ]Донор гликозила защищен у С-2 группой OAll. Затем аллильную группу изомеризуют в проп-1-ениловый эфир с использованием гидрида родия, полученного на катализаторе Уилкинсона ((PPh 3 ) 3 RhCl) и бутиллития (BuLi). Полученный еноловый эфир затем обрабатывают NIS и гликозильным акцептором с образованием смешанного ацеталя. Продукт 1,2- цис (например, β-маннозил) образуется на последней стадии путем активации аномерной уходящей группы, доставки агликона из смешанного ацеталя и, наконец, гидролитической обработки для удаления остатков пропенилового эфира из О-2. [ 4 ]

Окислительное связывание с пара -метоксибензиловыми (ПМБ) эфирами
[ редактировать ]В этом методе донор гликозила защищен у C-2 пара -метоксибензильной (ПМБ) группой. Гликозильный акцептор затем привязывается к бензильному положению защитной группы ПМБ в присутствии 2,3-дихлор-5,6-дициано-1,4-бензохинона (DDQ). Затем аномерная уходящая группа (Y) активируется, и образующийся ион оксокарбения захватывается связанным агликоновым спиртом (OR) с образованием 1,2 -цис -β-гликозидного продукта. [ 5 ]

Окислительное связывание на твердом носителе с пара -алкоксибензиловыми эфирами
[ редактировать ]Это модификация метода окислительного связывания с пара -метоксибензиловым эфиром. Отличие здесь в том, что пара -алкоксибензильная группа присоединена к твердой основе; Продукт β-маннозида высвобождается в фазу раствора на последнем этапе, в то время как побочные продукты остаются прикрепленными к твердой фазе. Это облегчает очистку β-гликозида; он формируется как почти эксклюзивный продукт. [ 6 ]

Кремниевая привязка
[ редактировать ]Начальная стадия этого метода включает образование силилового эфира у C-2-гидроксигруппы гликозильного донора при добавлении диметилдихлорсилана в присутствии сильного основания, такого как бутиллитий (BuLi); затем добавляется гликозильный акцептор с образованием смешанного силакеталя. Активация аномерной уходящей группы в присутствии затрудненного основания приводит затем к β-гликозиду. [ 7 ]

Модифицированный метод присоединения кремния включает смешивание донора гликозила с акцептором гликозила и диметилдихлорсиланом в присутствии имидазола с получением смешанного силакеталя в одном сосуде. Активация связанного промежуточного продукта затем приводит к образованию β-гликозидного продукта. [ 8 ]

См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Кампсти, И. Карбогидр. Рез. 2008 , 343 , 1553–1573
- ^ Баррези, Ф.; Хиндсгаул, O.J. Am. хим. Грязный. 1991 , 113 , 9376–9377
- ^ Эннис, Южная Каролина; Фэрбенкс, Эй Джей; Слинн, Калифорния; Теннант-Эйлс, Р.Дж.; Йейтс, HS Тетраэдр 2001 , 57 , 4221–4230
- ^ Сьюард, CMP; Кампсти, И.; Алуи, М.; Эннис, Южная Каролина; Редгрейв, Эй Джей; Фэрбенкс, AJ Chem. Коммун. 2000 , 1409–1410 гг .
- ^ Ито, Ю.; Огава, Т. Сан. хим. Межд. К. англ. 1994 , 33 , 1765–1767
- ^ Ito, Y.; Ogawa, T. J. Am. Chem. Soc. 1997 , 119 , 5562–5566
- ^ Stork, G.; Kim, G. J. Am. Chem. Soc. 1992 , 114 , 1087-1088
- ^ Аист, Г.; Ла Клер, Джей Джей Дж. Ам. хим. Соц. 1996 , 118 , 247–248
