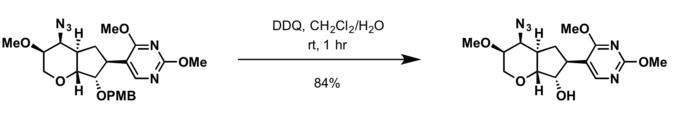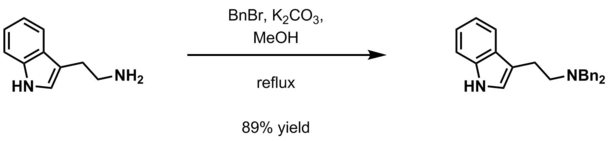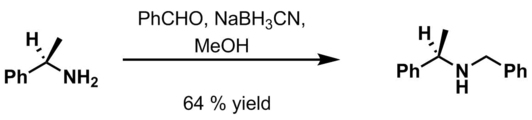Бензильная группа
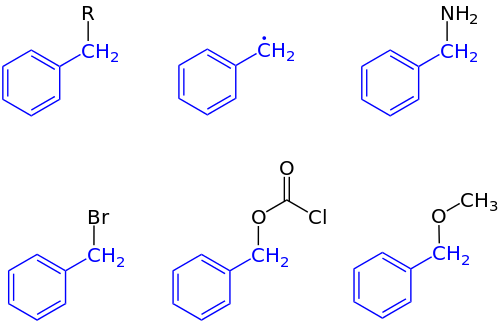
В органической химии бензил — заместитель или молекулярный фрагмент, имеющий структуру R-CH 2 -C 6 ЧАС 5 . Бензил имеет бензольное кольцо ( C 6 H 6 ), присоединенный к метиленовой группе ( −CH 2 − ) группа. [ 1 ]
Номенклатура
[ редактировать ]В номенклатуре ИЮПАК префикс бензил относится к Заместитель C 6 H 5 CH 2 , например бензилхлорид или бензилбензоат . Бензил не следует путать с фенилом , имеющим формулу С 6 Ч 5 . Термин «бензиловый» используется для описания положения первого углерода, связанного с бензольным или другим ароматическим кольцом. Например, (С 6 Н 5 )(СН 3 ) 2 С + называют «бензильным» карбокатионом. Свободный бензиловый радикал имеет формулу С 6 Н 5 СН 2 • . Бензильный катион или ион фенилкарбения представляет собой карбокатион с формулой С 6 Н 5 СН + 2 ; бензил-анион или фенилметанид-ион представляет собой карбанион формулы C 6 ЧАС 5 CH - 2 . Ни один из этих видов не может образовываться в значительных количествах в фазе раствора при нормальных условиях, но они являются полезными ориентирами для обсуждения механизмов реакции и могут существовать в качестве реакционноспособных промежуточных продуктов.
Сокращения
[ редактировать ]Бензил чаще всего обозначается сокращением Bn. Например, бензиловый спирт можно представить как BnOH. Менее распространенными сокращениями являются Bzl и Bz, последнее из которых неоднозначно, поскольку оно также является стандартным сокращением бензоильной группы . С 6 ЧАС 5 С(О)- . Точно так же не следует путать бензил с фенильной группой. C 6 H 5 − , сокращенно Ph.
Реакционная способность бензильных центров
[ редактировать ]Повышенная реакционная способность бензильных позиций объясняется низкой энергией диссоциации бензильных связей C-H. В частности, облигация C 6 H 5 CH 2 –H примерно на 10–15% слабее других видов связей C–H. Соседнее ароматическое кольцо стабилизирует бензильные радикалы. В данных, представленных в таблице ниже, сравниваются силы бензильной связи C-H с соответствующей силой связи C-H.
| Связь | Связь | Энергия диссоциации связи [ 2 ] [ 3 ] | Комментарий | |
|---|---|---|---|---|
| (ккал/моль) | (кДж/моль) | |||
| С 6 Н 5 СН 2 -Н | бензильная связь C-H | 90 | 377 | сродни аллильным связям C-H такие облигации демонстрируют повышенную реактивность |
| Н 3 С-Н | метильная связь C-H | 105 | 439 | одна из самых прочных алифатических связей C-H |
| С 2 Н 5 -Н | этиловая связь C-H | 101 | 423 | немного слабее, чем Н 3 С-Н |
| С 6 Н 5 -Н | связь фенил C-H | 113 | 473 | сравним с виниловым радикалом, редко |
| СН 2 =СНСН 2 -Н | аллильная связь C–H | 89 | 372 | похож на бензиловый CH |
| (С 6 Н 4 ) 2 СН-Н | флуоренильная связь C–H | 80 | более активирован по сравнению с дифенилметилом ( pKa = 22,6) | |
| (С 6 Н 5 ) 2 СН-Н | дифенилметильная связь C–H | 82 | «двойной бензиловый» ( pKa = 32,2) | |
| (С 6 Н 5 ) 3 С-Н | тритильная связь C–H | 81 | 339 | «тройной бензиловый» |
Слабость связи C-H отражает стабильность бензильного радикала. По связанным с этим причинам бензильные заместители проявляют повышенную реакционную способность, например, при окислении , свободнорадикальном галогенировании или гидрогенолизе . Практический пример: в присутствии подходящих катализаторов п - ксилол окисляется исключительно по бензильным положениям с образованием терефталевой кислоты :
Этим методом ежегодно производятся миллионы тонн терефталевой кислоты. [ 4 ]
Функционализация в бензильном положении
[ редактировать ]В некоторых случаях эти бензильные превращения происходят в условиях, подходящих для лабораторного синтеза. Реакция Волья-Циглера приведет к бромированию бензильной связи C–H: ( ArCHR 2 → ArCBrR 2 ). [ 5 ] Любая нетретичная бензильная алкильная группа окисляется до карбоксильной группы водным перманганатом калия ( KMnO 4 ) или концентрированной азотной кислоты ( ДЕНЬ 3 ):( ArCHR 2 → ArCOOH ). [ 6 ] Наконец, комплекс триоксида хрома и 3,5-диметилпиразола ( CrO 3 -dmpyz ) будет избирательно окислять бензильную метиленовую группу до карбонила: ( ArCH 2 R → ArC(O)R ). [ 7 ] 2-йодоксибензойная кислота в ДМСО ведет себя аналогично. [ 8 ]
Как защитная группа
[ редактировать ]Бензильные группы иногда используются в качестве защитных групп в органическом синтезе. Их установка и особенно их снятие требуют относительно суровых условий, поэтому бензил обычно не используется для защиты. [ 9 ]
Защита от алкоголя
[ редактировать ]Бензил обычно используется в органическом синтезе в качестве надежной защитной группы для спиртов и карбоновых кислот .
- Обработка спирта сильным основанием, например порошкообразным гидроксидом калия или гидридом натрия и бензилгалогенидом ( BnCl или BnBr ). [ 9 ] [ 10 ]
- Монобензилирование диолов может быть достигнуто с использованием Ag 2 O в диметилформамиде (ДМФ) при температурах от окружающей до повышенных. [ 11 ]
- Первичные спирты можно селективно бензилировать в присутствии фенольных функциональных групп с помощью Cu(acac) 2 [ 12 ]
Методы снятия защиты
[ редактировать ]Бензиловые эфиры можно удалить в восстановительных условиях , окислительных . и при использовании Льюиса кислот [ 9 ]
- Удаляется с помощью гидрогенолиза. [ 13 ]
- Одноэлектронный процесс с Na / NH 3 или Li /NH 3
- Бензильные защитные группы можно удалить с помощью широкого спектра окислителей, включая:
- CrO 3 / уксусная кислота при температуре окружающей среды
- Озон
- N -Бромсукцинимид (NBS)
- N -Йодосукцинимид (НИС)
- Триметилсилилиодид (Me 3 SiI) в дихлорметане при температуре окружающей среды (селективность может быть достигнута при определенных условиях)
п - метоксибензила Защитная группа
[ редактировать ]п -Метоксибензил ( ПМБ ) используется в качестве защитной группы для спиртов в органическом синтезе ( 4-метоксибензилтиол используется для защиты тиолов).
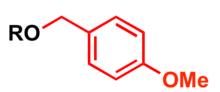
- Сильное основание, такое как порошкообразный гидроксид калия или гидрид натрия и п -метоксибензилгалогенид (хлорид или бромид). [ 14 ] [ 15 ]
- 4-метоксибензил-2,2,2-трихлорацетимидат можно использовать для установки группы ПМБ в присутствии:
- Трифлат скандия (III) (Sc(OTf) 3 ) в толуоле при 0 °C [ 16 ]
- Трифторметансульфоновая кислота (TfOH) в дихлорметане при 0 °C [ 17 ]
Методы снятия защиты
[ редактировать ]- 2,3-Дихлор-5,6-дициано- п -бензохинон (DDQ) [ 18 ]
- Условия снятия защиты с бензильной группы применимы для отщепления защитной группы ПМБ.
Аминовая защита
[ редактировать ]Бензильная группа иногда используется в качестве защитной группы для аминов в органическом синтезе . Существуют и другие методы. [ 9 ]
- Водный карбонат калия и бензилгалогенид ( BnCl , BnBr ) в метаноле. [ 19 ]
- Бензальдегид , 6 М HCl и NaBH 3 CN в метаноле. [ 20 ]
Методы снятия защиты
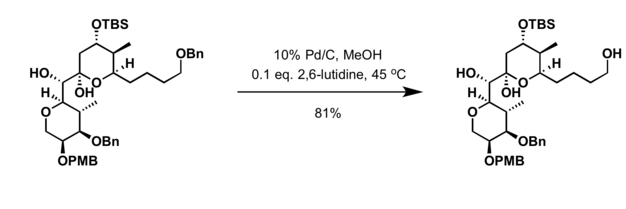
[ редактировать ]- Гидрирование в присутствии палладиевого катализатора [ 21 ]

См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Кэри, ФА; Сундберг, Р.Дж. (2008). Продвинутая органическая химия, Часть A: Структура и механизмы (5-е изд.). Нью-Йорк, штат Нью-Йорк: Спрингер. стр. 806–808 , 312–313. ISBN 9780387448978 .
- ^ Сюэ, Сяо-Сун; Цзи, Пэнджу; Чжоу, Биин; Ченг, Джин-Пей (2017). «Основная роль энергетики связей в активации/функционализации C – H». Химические обзоры . 117 (13): 8622–8648. doi : 10.1021/acs.chemrev.6b00664 . ПМИД 28281752 .
- ^ Чжан, Сянь-Мань; Бордвелл, Фредерик Г. (1992). «Энергии гомолитической диссоциации бензильных углерод-водородных связей в анион-радикалах и катион-радикалах, полученных из флуоренов, трифенилметанов и родственных соединений». Журнал Американского химического общества . 114 (25): 9787–9792. дои : 10.1021/ja00051a010 .
- ^ Шихан, Ричард Дж. «Терефталевая кислота, диметилтерефталат и изофталевая кислота». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a26_193 . ISBN 978-3527306732 .
- ^ К., Воллхардт, К. Питер (29 января 2018 г.). Органическая химия: строение и функции . Шор, Нил Эрик, 1948- (8-е изд.). Нью-Йорк. ISBN 9781319079451 . OCLC 1007924903 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Чендлер), Норман, ROC (Ричард Освальд (1993). Принципы органического синтеза . Коксон, Дж. М. (Джеймс Моррисс), 1941- (3-е изд.). Лондон: Blackie Academic & Professional. ISBN 978-0751401264 . ОСЛК 27813843 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Джонстон, Джеффри Н. (2001), «Оксид хрома (VI) – 3,5-диметилпиразол», Энциклопедия реагентов для органического синтеза , Американское онкологическое общество, номер документа : 10.1002/047084289x.rc170 , ISBN 9780470842898
- ^ Бэран, Фил С.; Чжун, Юн-Ли (1 апреля 2001 г.). «Селективное окисление углерода, примыкающего к ароматическим системам, с помощью IBX». Журнал Американского химического общества . 123 (13): 3183–3185. дои : 10.1021/ja004218x . ISSN 0002-7863 . ПМИД 11457049 .
- ^ Jump up to: а б с д Вутс, Питер ГМ; Грин, Теодора В. (2006). Защитные группы Грина в органическом синтезе (4-е изд.). Интернет-библиотека Уайли. дои : 10.1002/0470053488 . ISBN 9780470053485 . S2CID 83393227 .
- ^ Фукудзава, Акио; Сато, Хидеаки; Масамунэ, Тадаси (1 января 1987 г.). «Синтез (±)-препиннатерпена, бромдитерпена из красной водоросли Ямада». тетраэдра Буквы 28 (37): 4303–4306. дои : 10.1016/S0040-4039(00) 96491-8
- ^ Ван Хейфте, Люк; Литтл, Р. Дэниел (1 октября 1985 г.). «Реакции внутримолекулярного захвата 1,3-диила. Формальный полный синтез (±)-кориолина». Журнал органической химии . 50 (20): 3940–3942. дои : 10.1021/jo00220a058 . ISSN 0022-3263 .
- ^ Сиркеджиоглу, Окан; Карлига, Бекир; Талинли, Нацие (10 ноября 2003 г.). «Бензилирование спиртов с использованием бис[ацетилацетонато]меди в качестве катализатора». Буквы тетраэдра . 44 (46): 8483–8485. дои : 10.1016/j.tetlet.2003.09.106 .
- ^ Смит, Амос Б.; Чжу, Вэньюй; Сираками, Сёхей; Сфуггатакис, Крис; Даути, Виктория А.; Беннетт, Клэй С.; Сакамото, Ясухару (01 марта 2003 г.). «Полный синтез (+)-спонгистатина 1. Эффективная конструкция второго поколения усовершенствованной соли Виттига EF, объединение фрагментов и окончательная разработка». Органические письма . 5 (5): 761–764. дои : 10.1021/ol034037a . ISSN 1523-7060 . ПМИД 12605509 .
- ^ Марко, Хосе Л.; Уэсо-Родригес, Хуан А. (1 января 1988 г.). «Синтез оптически чистых производных 1-(3-фурил)-1,2-дигидроксиэтана». Буквы тетраэдра . 29 (20): 2459–2462. дои : 10.1016/S0040-4039(00)87907-1 .
- ^ Такаку, Хироши; Камайке, Кадзуо; Цучия, Хиромичи (1 января 1984 г.). «Синтез олигонуклеотидов. Часть 21. Синтез рибоолигонуклеотидов с использованием 4-метоксибензильной группы в качестве новой защитной группы для 2'-гидроксильной группы». Журнал органической химии . 49 (1): 51–56. дои : 10.1021/jo00175a010 . ISSN 0022-3263 .
- ^ Трост, Барри М.; Васер, Джером; Мейер, Арндт (1 ноября 2007 г.). «Полный синтез (-)-псевдоларовой кислоты B» . Журнал Американского химического общества . 129 (47): 14556–14557. дои : 10.1021/ja076165q . ISSN 0002-7863 . ПМК 2535803 . ПМИД 17985906 .
- ^ Мукаяма, Теруаки; Шина, Математика; Знаешь, Хаято; Сайто, Масахиро; Нисимура, Тошихиро; Окава, Наото; Сакко, Хироки; Нисимура, Кодзи; Тани, Юичиро (4 января 1999 г.). «Асимметричный полный синтез таксола\R» . Химия – Европейский журнал . 5 (1): 121–161. doi : 10.1002/(SICI)1521-3765(19990104)5:1<121::AID-CHEM121>3.0.CO;2-O . ISSN 1521-3765 .
- ^ Ханессян, Стивен; Маркотт, Стефан; Мачаалани, Роджер; Хуан, Гобинь (1 ноября 2003 г.). «Полный синтез и структурное подтверждение малаямицина А: нового бициклического С -нуклеозида из Streptomyces malaysiensis». Органические письма . 5 (23): 4277–4280. дои : 10.1021/ol030095k . ISSN 1523-7060 . ПМИД 14601979 .
- ^ Кюне, Мартин Э.; Сюй, Фэн (1 декабря 1993 г.). «Полный синтез алкалоидов стрихнана и аспидосперматана. 3. Полный синтез (±)-стрихнина». Журнал органической химии . 58 (26): 7490–7497. дои : 10.1021/jo00078a030 . ISSN 0022-3263 .
- ^ Каин, Кристиан М.; Казинс, Ричард ПК; Кумбаридес, Грег; Симпкинс, Найджел С. (1 января 1990 г.). «Асимметричное депротонирование прохиральных кетонов с использованием хиральных оснований амида лития». Тетраэдр . 46 (2): 523–544. дои : 10.1016/S0040-4020(01)85435-1 .
- ^ Чжоу, Хао; Ляо, Сюэбин; Кук, Джеймс М. (1 января 2004 г.). «Региоспецифический, энантиоспецифичный общий синтез 12-алкоксизамещенных индольных алкалоидов, (+)-12-метокси-Na-метилвеллозимина, (+)-12-метоксиаффинизина и (-)-фуксиаэфолина». Органические письма . 6 (2): 249–252. дои : 10.1021/ol0362212 . ISSN 1523-7060 . ПМИД 14723540 .
- ^ Ронг, Йи; Аль-Харби, Ахмед; Паркин, Джерард (2012). «Сильно переменные углы связи Zr – CH2 – Ph в тетрабензилцирконии: анализ режимов координации бензильных лигандов». Металлоорганические соединения . 31 (23): 8208–8217. дои : 10.1021/om300820b .
Внешние ссылки
[ редактировать ] Химический портал
Химический портал  Цитаты, связанные с бензильной группой, в Wikiquote
Цитаты, связанные с бензильной группой, в Wikiquote