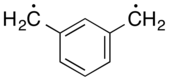
Ксилилен
 |
 |
 |
В органической химии ксилол имеющих (иногда хинондиметид ) представляет собой любой из конституционных изомеров, формулу C 6 H 4 (CH 2 ) 2 . Эти соединения родственны соответствующим хинонам и хинонметидам заменой атомов кислорода на группы CH 2 . орто- и пара -ксилилены наиболее известны, хотя ни один из них не является стабильным ни в твердой, ни в жидкой форме. Мета - форма представляет собой дирадикал . Однако некоторые замещенные производные ксилиленов, такие как тетрацианохинодиметан и дихлориды ксилила , очень стабильны .
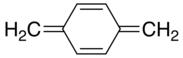
п-ксилилен
[ редактировать ]п -ксилол образуется при пиролизе п - ксилола или, что проще, α-замещенных производных. п -ксилилен димеризуется с умеренной эффективностью с образованием п - циклофана : [ 1 ]

Дальнейшее нагревание п -циклофана дает поли( пара -ксилилен) .
о-ксилилены
[ редактировать ]о-ксилилены ( о -хинодиметаны) часто образуются на месте. [ 2 ] например, пиролизом соответствующего сульфона. [ 3 ] Другой метод включает 1,4-элиминирование ортобензильных силанов. [ 4 ] или станнаны, [ 5 ] [ 6 ] [ 7 ]

α,α'- ортоксилолдибромиды хорошо разработаны для получения о-ксилолов. [ 8 ] Например, реакция тетрабром-о-ксилола (C 6 H 4 (CHBr 2 ) 2 ) с йодидом натрия дает α,α'-дибром-о-ксилилен, который можно улавливать с образованием производных нафтилена. В отсутствие улавливающих агентов ксилол релаксирует до α,α’-дибромбензоциклобутан: [ 9 ]
- C 6 H 4 (CHBr 2 ) 2 + 2 NaI → C 6 H 4 (=CHBr) 2 + 2 NaBr + I 2
- C 6 H 4 (=CHBr) 2 → C 6 H 4 (CHBr) 2
Циклоприсоединения этих о-ксилиленов обеспечивают путь к образованию аценов . [ 10 ]
Диеновое звено , образованное двумя экзоциклическими алкеновыми звеньями орто- изомера, может служить лигандом в координационных комплексах . Например, реакция α,α'-дибром- о -ксилола с карбонилами железа дает низкие выходы ксилиленового комплекса Fe(CO) 3 [η 4 -C 6 H 4 (CH 2 ) 2 ]. Этот продукт структурно аналогичен Fe(CO) 3 [η 4 - 1,3-бутадиен ]. [ 11 ]
При высоких температурах бензоциклобутены подвергаются электроциклическому раскрытию кольца с образованием о -ксилиленов. Этот и другие синтезы о -ксилиленов и их последующая димеризация путем [4+4] -циклоприсоединения с образованием циклоктильных структур неоднократно использовались при синтезе суперфана . [ 12 ]
Электронная структура
[ редактировать ]Несмотря на наблюдаемую химию пара-ксилилена (т.е. его быструю полимеризацию в поли-п-ксилилен), которая предполагает, что соединение существует в виде бирадикала, физические данные единогласно заключают, что низшее электронное состояние п-ксилилена представляет собой синглет с закрытой оболочкой. Кроме того, несколько вычислительных методов подтверждают это назначение. [ 13 ] И наоборот, мета -ксилилен представляет собой молекулу, не принадлежащую Кекуле , которая имеет триплетное основное состояние. [ 14 ]
Ссылки
[ редактировать ]- ^ HE Winberg, FS Fawcett «[2.2] Органический синтез парациклофана» , Coll. Том. 5, с.883 ( 1973 ); Том. 42, с.83 ( 1962 ) Ссылка .
- ^ Клундт, Иллинойс (1970). «Бензоциклобутен и его производные». Химические обзоры . 70 (4): 471–487. дои : 10.1021/cr60266a002 .
- ^ Николау, КЦ; Снайдер, SA; Монтаньон, Т.; Вассиликояннакис, Г. (2002). «Реакция Дильса-Альдера в полном синтезе». Angewandte Chemie, международное издание . 41 (10): 1668–1698. doi : 10.1002/1521-3773(20020517)41:10<1668::AID-ANIE1668>3.0.CO;2-Z . ПМИД 19750686 .
- ^ Ито, Ю.; Накацука, М.; Саэгуса, Т. (1982). -хинодиметанов нового поколения «Синтез полициклических кольцевых систем на основе о ». Журнал Американского химического общества . 104 (26): 7609–7622. дои : 10.1021/ja00390a036 .
- ^ Сано, Х.; Оцука, Х.; Мигита, Т. (1988). «Удобный метод получения о -хинодиметанов путем протон-индуцированного 1,4-отщепления о- (1-гидроксиалкил)бензилтрибутилстаннанов». Журнал Американского химического общества . 110 (6): 2014–2015. дои : 10.1021/ja00214a083 .
- ^ Скоро, HW (1993). «Новый метод получения о -хинодиметана путем селен-индуцированной фрагментации о -винилбензилтрибутилстаннана». Буквы тетраэдра . 34 (47): 7587–7590. дои : 10.1016/S0040-4039(00)60407-0 .
- ^ Скоро, HW (1994). «Поколение α-окси- о- хинодиметанов, стимулируемое кислотой Льюиса, и реакции циклоприсоединения». Буквы тетраэдра . 35 (23): 3975–3978. дои : 10.1016/S0040-4039(00)76717-7 .
- ^ Руботтом, генеральный директор; Уэй, Дж. Э. (1984). «Улучшенный метод получения о -хинодиметанов». Синтетические коммуникации . 14 (6): 507–514. дои : 10.1080/00397918408059572 .
- ^ Кава, член парламента; Дина, А.А.; Мут, К. (1959). «Конденсированные циклобутановые ароматические соединения. VIII. Механизм образования 1,2-дибромбензоциклобутена; новый синтез Дильса-Альдера». Журнал Американского химического общества . 81 (24): 6458–6460. дои : 10.1021/ja01533a032 .
- ^ Паддон-Роу, Майкл Н.; Патни, Хариш К. (1986). «Эффективная синтетическая стратегия аннелирования нафталина норборненологических систем». Синтез . 1986 (4): 328–330. дои : 10.1055/s-1986-31603 .
- ^ Кербер, Роберт С.; Рыбакове, Эверетт К. (1991). «Образование карбонильных комплексов железа с реакционноспособными полиенами из дигалогенидов с участием свободного полиена». Металлоорганические соединения . 10 (8): 2848–2853. дои : 10.1021/om00054a059 .
- ^ Секин, Ю.; Браун, М.; Букельхайде, В. (1979). «[2.2.2.2.2.2](1,2,3,4,5,6)Циклофан: суперфан». Журнал Американского химического общества . 101 (11): 3126–3127. дои : 10.1021/ja00505a053 .
- ^ Монтгомери, Л.К., Хаффман, Дж.К., Юрчак, Э.А. и Грендзе, М.П. Молекулярные структуры углеводородов Тиле и Чичибабина. Дж. Ам. хим. Соц. 108, 6004–6011 (1986) doi:10.1021/ja00279a056
- ^ Стеглич, Матиас; Кастодис, Виктория Б.Ф.; Тревитт, Адам Дж.; да Силва, Габриэль; Тело, Эндрю; Хембергер, Патрик (2017). «Фотоэлектронный спектр и энергетика мета -ксилиленового дирадикала » Дж. Ам. хим. Соц . 139 (41): 14348–14351. дои : 10.1021/jacs.7b06714 . ПМИД 28965395 .