Циклоизомеризация
Циклоизомеризация — это любая изомеризация , при которой циклический изомер субстрата образуется в координате реакции. Самым большим преимуществом реакций циклоизомеризации является ее экономичность атомов : по замыслу ничего не тратится впустую, поскольку каждый атом исходного материала присутствует в продукте. В большинстве случаев эти реакции опосредованы катализатором на основе переходного металла , в редких случаях — органокатализаторами и редко они протекают в термических условиях. Эти циклизации во многих случаях могут осуществляться с превосходным уровнем селективности и превратили циклоизомеризацию в мощный инструмент для уникального и сложного молекулярного конструирования. [ 1 ] Циклоизомеризация — очень широкая тема в органическом синтезе, и существует множество реакций, которые можно отнести к такой категории. Двумя основными классами этих реакций являются внутримолекулярные реакции присоединения Михаэля и внутримолекулярные Дильса-Альдера реакции . В рамках циклоизомеризации наиболее широко используемыми и изучаемыми реакциями являются циклоизомеризация енина и родственных ему олефинов. [ 2 ]
Внутримолекулярное присоединение Михаэля
[ редактировать ]Достаточно интуитивным путем к циклическим изомерам является внутримолекулярное сопряженное присоединение к α,β-ненасыщенным карбонилам (внутримолекулярное присоединение по Михаэлю или IMA). Компетентные акцепторы Михаэля включают конъюгированные еноны, энали или производные нитроалкенов, а примеры других акцепторов редки. [ 3 ] Несмотря на то, что реакции IMA повсеместно распространены в синтезе, существует очень мало примеров асимметричных превращений IMA. [ 2 ]
Было показано, что катализаторы из тиомочевины с подвесными хиральными остовами активируют системы со связанными нитроалкановыми и сложноэфирными мотивами, вызывая асимметричную IMA. [ 3 ] [ 4 ] Полезность этой трансформации была продемонстрирована при синтезе предшественников циклических γ-аминокислот (рисунок 1). [ 3 ] Предполагается, что активация происходит за счет Н-связывания как нитроната, так и сложного эфира с тиомочевинным катализатором, что объясняет интересную селективность в отношении E -эфира. [ 3 ]

Функциональная стереодивергентная органокатализируемая трансформация IMA/ лактонизация при синтезе замещенных дигидрофуранов и тетрагидрофуранов была изучена на предмет ее способности создавать важные структурные мотивы во многих природных продуктах (рисунок 2). [ 5 ] Когда простые эфиры, такие как 3, подвергаются воздействию (S)-(-)-тетрамизол гидрохлорида ( 4 ) в качестве катализатора, в результате образуется син -2,3-замещенный ТГФ, в то время как дополнительный анти -продукт легко доступен через алкалоидный катализатор хинного дерева, такой как 7 . [ 5 ]

Внутримолекулярный метод Дильса-Альдера.
[ редактировать ]Внутримолекулярные реакции Дильса-Альдера (IMDA) соединяют связанные диены и диенофилы по схеме [4+2], наиболее распространенным из которых является терминальное замещение. Эти преобразования популярны в полном синтезе и заранее широко используются для решения многочисленных сложных синтетических задач. [ 6 ] Одним из таких применений является применение энантиоселективной трансформации IMDA в асимметричном синтезе морского токсина (-)-изопуло'упона ( 10 ). [ 7 ]

Синтез (–)– изопуло'упона продемонстрировал возможность использования катионного комплекса Cu(II)бис(оксазолина), катализируемого IMDA, для получения бициклических продуктов с четырьмя соседними стереогенными центрами (рисунок 3). [ 7 ] Сравнительно недавним применением реакций IMDA в синтезе сложных молекул является подход IMDA к трициклическому ядру алкалоидов палхинин ликоподия, класса натуральных продуктов, выделенных из кивающего плауна. [ 8 ]
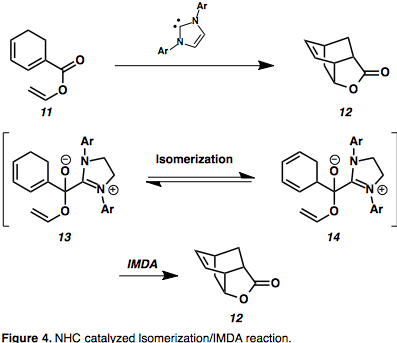
N-гетероциклические карбены (NHC) представляют собой новый класс органокатализаторов, которые способны индуцировать реакционную способность Умполунга , а также превращения нормальной полярности, однако до недавнего времени они не использовались широко в полном синтезе из-за ограниченного количества субстратов. [ 9 ] Интересным расширением использования этих органокатализаторов является каскадная реакция изомеризации олефинов/IMDA, катализируемая NHC, с получением уникальных бициклических каркасов. [ 10 ] [ 11 ] Диениловые эфиры, такие как 11, были превращены в замещенные бицикло[2.2.2]октаны посредством стадии изомеризации, стабилизированной промежуточным соединением полуацеталя азолия ( 13 ). [ 11 ] Активационный барьер изомеризации 1,3-гексадиена посредством [1,5]-сдвига составляет 41 Ккал/моль и, как ожидается, будет увеличиваться по мере конъюгации со сложным эфиром, поэтому некатализируемая изомеризация маловероятна. [ 11 ] Это дает преимущество обхода высокого барьера активации, обеспечивая доступ к ранее недоступным производным IMDA.
Эниновая циклоизомеризация
[ редактировать ]Циклоизомеризация енинов, алкиновый вариант реакции альдер-ена (рис. 5), представляет собой внутримолекулярную перегруппировку 1,n-енинов с образованием соответствующего циклического изомера.
Хотя перегруппировка может происходить в термических условиях, объем термической перегруппировки ограничен из-за необходимости высоких температур, поэтому в качестве катализаторов часто используются переходные металлы, такие как Au, Pd, Pt, Rh и Ir. [ 2 ] Поскольку синтез требует создания сложных структурных мотивов в присутствии индуктивных, стереоэлектронных и стерических требований, эта перегруппировка недавно была разработана как надежный метод построения карбо- и гетероциклических каркасов с превосходными хемо-, регио- и диастереоселективными результатами. [ 2 ]
Не существует единого механизма, который можно было бы использовать для описания циклоизомеризации енинов, поскольку он зависит от условий реакции и выбора катализатора. [ 2 ] [ 12 ] Возможны промежуточные соединения циклоизомеризации, катализируемой металлом, в которой металл координирует алкин или алкен, активируя один или оба, и показаны на рисунке 6.
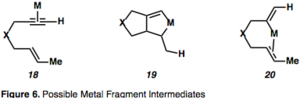
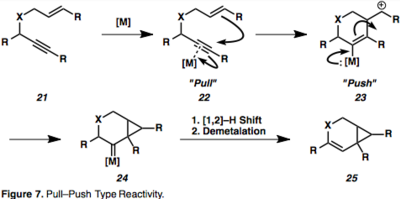
Активация алкина путем комплексообразования с металлом, приводящая к η 2 – металлическое промежуточное соединение, такое как 18, открывает алкин для нуклеофильной атаки и приводит к образованию промежуточных карбокатионов . Эта реактивность притяжения-толкания важна для понимания реакций, опосредованных π-кислотами. Комплексообразование алкина с металлическим фрагментом снижает электронную плотность в связи («притяжение»), а способность металла обратно отдавать («толкать») вызывает наблюдаемый последовательный электрофильный и нуклеофильный характер по отношению к вицинальным атомам углерода алкин ( рисунок 7).
Металлациклические интермедиаты ( 19 ) являются результатом одновременного комплексообразования и активации обоих партнеров. Также возможно гидрометаллирование алкина с образованием винилового металла, который, в свою очередь, может карбометаллировать олефин ( 20 ). Пример циклоизомеризации 1,6-енина, протекающей через η 2 – активированный интермедиат металла представлен на рисунке 8, [ 13 ] что характерно для циклоизомеризации енинов, опосредованной Pt или Au, из-за их π-кислотной природы. Примечательно, что в этом примере имеет место перенос хиральности, при котором абсолютная стереохимия енина ( 26 ) контролирует стереохимию продукта ( 27 ). [ 13 ]
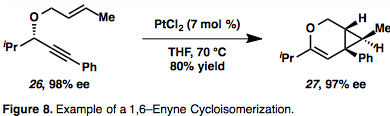
Au и Pt опосредованная циклоизомеризация енинов
[ редактировать ]Активация алкинов π-кислотными металлами, такими как Au или Pt, является традиционным методом синтеза сложных органических соединений, однако то, как эта активация обеспечивает реакционную способность, не до конца понятно, и поэтому механизм в основном предлагается на основе результатов реакции и теоретических расчетов. [ 14 ] [ 15 ] Катионные катализаторы Au(I) и Pt(II) являются привлекательным выбором, поскольку они обладают сильным кислотным характером Льюиса и способностью стабилизировать катионные промежуточные продукты, сохраняя при этом стабильность на стенде. [ 16 ]
Универсальной функцией циклоизомеризации енинов, катализируемой Au (I), является построение асимметричных колец среднего размера, что представляет собой проблему при синтезе орнаментированной молекулярной конструкции. Удобный доступ к асимметричным 7- и 8-членным карбоциклам возможен с использованием хирального золотого катализатора BINAP Au(I), что дает большое разнообразие продуктов. [ 17 ]
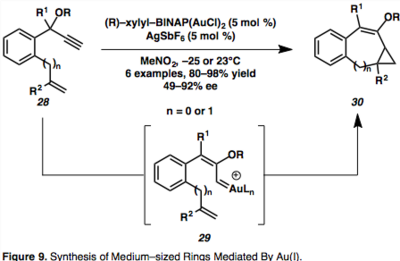
Предполагается, что внутримолекулярное циклопропанирование происходит посредством 1,2-сдвига пропаргилового эфира, опосредованного Au, с образованием син -Au винилкарбеноидных разновидностей ( 29 ). [ 17 ] Компьютерные исследования показывают, что син -интермедиат 29 образуется под кинетическим контролем, и предполагается, что он находится в равновесии с термодинамически выгодным цис -интермедиатом, который может быть перехвачен нуклеофилом с образованием винилциклопропандиеновых продуктов, однако это выходит за рамки рамки этой статьи. [ 17 ]
Винилциклоалкены — еще один функциональный класс продуктов, доступных путем алкиновой активации енинов π-кислотными металлами. Было показано, что PtCl 2 катализирует образование множества экзотических винилциклоалкенов из легкодоступных исходных материалов (рис. 10). [ 18 ]

Примечательно, что расширение кольца наблюдается для енинов с циклическими алкеновыми мотивами. Это объясняется формальной вставкой метиленовой группы олефина между двумя атомами углерода алкина; также было предложено механистическое объяснение этого расширения кольца. [ 19 ] Образование этих винилоалкенов в сочетании с их способностью к расширению кольца было использовано для создания промежуточного соединения 36 на пути к стрепторубину B. [ 18 ] Аналогичное превращение возможно с использованием катионных комплексов Au(I), однако здесь можно отбирать винилциклоалкеновые продукты по механизму, протекающему через начальный 5-экзо-диг , или бициклопропаны можно получать через исходный 6-эндо-диг . [ 20 ] С помощью расчетов DFT предполагается, что циклизация 5-exo-dig предпочтительна для комплексов Au(I), поскольку она имеет более низкий активационный барьер по сравнению с 6-endo-dig и действительно многочисленные примеры продуктов винилциклоалкенов, полученных с помощью исходного 5- exo–dig (рисунок 11).

Реакционную активность можно обратить вспять путем тщательного выбора условий реакции, выбора катализатора и субстрата. [ 20 ] Различная реакционная способность этих циклоизомеризаций, катализируемых переходными металлами, еще раз демонстрирует их синтетическую полезность для создания уникальных молекулярных скелетов.
Ссылки
[ редактировать ]- ^ Обзор реакций циклоизомеризации см.: Энантиоселективная циклоизомеризация, катализируемая переходными металлами , Анжела Маринетти, Элен Жюльен и Арно Вуатурье Chem. Соц. Ред., 2012, 41, 4884-4908. doi : 10.1039/C2CS35020C , Критический обзор.
- ^ Jump up to: а б с д и Watson, I. D. G.; Toste, F. D. Chem. Sci. 2012, 3, 2899–2919.
- ^ Jump up to: а б с д Узлы, WJ; Натт, ДР; Чиппиндейл, AM; Кобб, AJAJ Am. хим. Соц. 2009, 131, 16016–16017.
- ^ Обзор катализа тиомочевины см.: Zhang, Z.; Шрайнер, PR Chem. Соц. Ред. 2009, 38, 1187–1198.
- ^ Jump up to: а б Бельмесьери, Д.; Уплиер, А.; Колдер, EDD; Тейлор, Дж. Э.; Смит, AD Chem. Время. Дж. 2014, 20, 9762–9769.
- ^ Такао, К; Мунаката, Р.; Тадано, К. Chem. Преподобный. 2005, 105, 4779–4807.
- ^ Jump up to: а б Джонсон, Дж. С.; Эван, DAJ Org. хим. 1997, 62, 786–787.
- ^ Сайзмор, Н.; Рыхновский, СД орг. Летт. 2014, 16, 688–691.
- ^ Искьердо, Дж. Хатсон, GE; Коэн, Д.Т.; Шайдт, К. Ангью. хим. Междунар. ред., 2012, 51, 11686–11698.
- ^ Обзор каскадных реакций органокатализа N-гетероциклических карбенов см.: Grossman, A.; Эндерс, Д. Энджью. хим. Межд. Эд. 2012, 51, 314–325.
- ^ Jump up to: а б с Ковальчик, М.; Луптон, Д.В. Энджью. Ткань. Межд. Эд. 2014, 53, 5314–5317.
- ^ Жене, Ж. –П.; Туллек, ПЮ; Мишле, В. Анжю. хим. Они. Пшеница. 2008, 47, 4268–4315.
- ^ Jump up to: а б Ньюкомб, ET; Феррейра, EM Org. Летт. 2013, 15, 1772–1775.
- ^ Фюрстнер, А.; Дэвис, П.В. Энджью. хим. Межд. Эд. 2007, 46, 3410–3449.
- ^ Обзор реакций циклоизомеризации енинов, катализируемых золотом, см.: Хименес-Нуньес, Э.; Эчаваррен, AM Chem. Замри. 2008, 108, 3326–3350.
- ^ Горин, диджей; Тосте, FD Nature 2007, 446, 395–403.
- ^ Jump up to: а б с Уотсон, IDG; Риттер, С; Тосте, FDJ Am. хим. Соц. 2009, 131, 2056–2057.
- ^ Jump up to: а б Фюрстнер, А.; Стельцер, Ф.; Силлат, HJ Am. хим. 2001, 123, 11863-11869.
- ^ Чжан, Л.; Сан, Дж.; Козьмин С.А. Адв. Синтез. Катал. 2006, 348, 2271–2296.
- ^ Jump up to: а б Ньето-Оберхубер, Дж.; Муньос, член парламента; Бюнель, Э.; Невадо, К.; Чёрденас, диджей; Эчаваррен, А. М. Анжью. хим. Они. Пшеница. 2004, 43, 2402–2406.