Нанооболочка
| Часть серии статей о |
| Наномедицина |
|---|
| См. также |
Нанооболочка , представляет собой тип сферической наночастицы , , или, скорее, нанооболочка плазмона состоящей из диэлектрического ядра, покрытого тонкой металлической оболочкой (обычно золотой ). [ 1 ] Эти нанооболочки включают в себя квазичастицу , называемую плазмоном , которая представляет собой коллективное возбуждение или квантовое плазменное колебание, при котором электроны одновременно колеблются относительно всех ионов.
Одновременные колебания можно назвать гибридизацией плазмонов, где возможность настройки колебаний связана со смешением внутренней и внешней оболочек, где они гибридизуются, давая более низкую или более высокую энергию. Эта более низкая энергия сильно взаимодействует с падающим светом, тогда как более высокая энергия является разрыхляющим фактором и слабо соединяется с падающим светом. Гибридизационное взаимодействие сильнее для более тонких слоев оболочки, следовательно, толщина оболочки и общий радиус частицы определяют, с какой длиной волны света она взаимодействует. [ 2 ] Нанооболочки можно варьировать в широком диапазоне светового спектра , охватывающем видимую и ближнюю инфракрасную области. Взаимодействие света и наночастиц влияет на размещение зарядов, что влияет на силу связи. Падающий свет, поляризованный параллельно подложке, дает s-поляризацию (рис. 1б), следовательно, заряды находятся дальше от поверхности подложки, что обеспечивает более сильное взаимодействие между оболочкой и ядром. В противном случае образуется p-поляризация, которая дает более сильно сдвинутую энергию плазмона, вызывающую более слабое взаимодействие и связь.
Открытие
[ редактировать ]Открытие нанооболочек было сделано профессором Наоми Дж. Халас и ее командой в Университете Райса в 2003 году. Когда она и ее команда открыли нанооболочки, они изначально не были уверены, какой потенциал таят в себе такие нанооболочки. «Мы сказали: «Ну и дела, для чего это может быть полезно?» — рассказал Халас CNN. После многих предложений терапия рака стала результатом постоянного сотрудничества с биоинженерами, ищущими различные виды биомедицинских применений. [ 3 ] «Одно из наших видений, - заявил Халас, - не что иное, как диагностика и лечение рака за одно посещение». [ 4 ] В 2003 году Халас был удостоен награды «Лучшее открытие 2003 года» по версии журнала Nanotechnology Now . [ 4 ]
Производство
[ редактировать ]Современный метод синтеза золотых нанооболочек — использование микрофлюидных композитных пен. Этот метод потенциально может заменить стандартный литографический метод синтеза плазмонных нанооболочек. Описанный ниже производственный процесс был экспериментом, проведенным Суханьей Дурайсвами и Саифом А. Ханом из Департамента химической и биомолекулярной инженерии Сингапура. Хотя этот метод был экспериментом, он представляет будущее синтеза нанооболочек.
Для производства нанооболочек необходимы следующие материалы: Тетраэтилортосиликат, гидроксид аммония, гидрохлорид гидроксиламина, 3-аминопропилтрис, тригидрат водородтетрахлораурата(III), хлорид тетракис(гидроксиметил)фосфония, гидроксид натрия, карбонат калия, этанол, сверхчистая вода и стеклянная посуда, вымытая в царской водке и тщательно промытая в воде. [ 5 ] )
Первым шагом в синтезе нанооболочек в этом методе является создание устройства, внутри которого будет происходить реакция. Схемы микрофлюидных устройств были изготовлены на кремниевых пластинах с помощью стандартной фотолитографии с использованием негативного фоторезиста SU-8 2050. Устройства впоследствии были отлиты в поли(диметилсилоксан) (ПДМС) с использованием техники мягкой литографии. (40) Кратко, ПДМС был отлит на SU-8-2050. 8 мастеров при 70 °C в течение 4 часов, очищенные, нарезанные и очищенные. В устройстве были пробиты входные и выходные отверстия (наружный диаметр 1/16 дюйма). Микроканалы были необратимо прикреплены к предметному стеклу, предварительно покрытому тонким слоем ПДМС, после короткой 35-секундной обработки воздушной плазмой. Микроканалы имеют прямоугольное поперечное сечение, ширину 300 мкм, глубину 155 мкм и длину 0,45 м. [ 5 ]
Фактическое производство наночастиц включает в себя закачку «силиконового масла, смеси частиц кремнезема с золотыми затравками, раствора для золочения и раствора восстановителя в микрофлюидное устройство, в то время как газообразный азот подается из баллона». [ 5 ] Затем раствор для покрытия оставляли созревать в контролируемой среде более чем на 24 часа. После процесса старения жидкость собирается из микрофлюидного устройства и помещается в центрифугу. Полученная жидкость имеет слой масла на поверхности и раствор под ним, содержащий нанооболочки.
Причина, по которой этот метод является революционным, заключается в том, что размер и относительную толщину золотой нанооболочки можно контролировать, изменяя продолжительность реакции, а также концентрацию раствора покрытия. Тем самым позволяя исследователям адаптировать частицы в соответствии с их потребностями. Пусть даже для оптики или лечения рака.
Лечение рака
[ редактировать ]Наночастицы с золотой оболочкой, представляющие собой сферические наночастицы с кремнеземным и/или липосомальным ядром. [ 6 ] и золотые ракушки используются в терапии рака и улучшении биоизображений. Тераностические зонды , способные обнаруживать и лечить рак за одну процедуру, представляют собой наночастицы , имеющие на своей оболочке места связывания, которые позволяют им прикрепляться к желаемому месту (обычно раковым клеткам), а затем их можно визуализировать с помощью двухмодальных изображений (стратегия визуализации). который использует рентгеновские лучи и радионуклидную визуализацию ) и флуоресценцию в ближнем инфракрасном диапазоне. [ 7 ] Причина использования наночастиц золота заключается в их ярких оптических свойствах, которые контролируются их размером, геометрией и поверхностными плазмонами. Преимущество наночастиц золота (таких как AuNP) состоит в том, что они биосовместимы и обладают гибкостью, позволяющей иметь множество различных молекул и фундаментальных материалов, прикрепленных к их оболочке (почти все, что обычно может быть прикреплено к золоту, может быть прикреплено к золотой нанооболочке). которые можно использовать для выявления и лечения рака). Лечение рака возможно только благодаря рассеянию и поглощению, которое происходит у плазмоников . При рассеянии позолоченные наночастицы становятся видимыми для процессов визуализации, настроенных на правильную длину волны, которая зависит от размера и геометрии частиц. При поглощении происходит фототермическая абляция , которая нагревает наночастицы и их непосредственное окружение до температур, способных убить раковые клетки. Это достигается с минимальным повреждением клеток организма за счет использования «водного окна» (спектральный диапазон от 800 до 1300 нм). [ 1 ] Поскольку человеческое тело состоит в основном из воды, это оптимизирует используемый свет по сравнению с оказываемыми эффектами.
Эти золотые нанооболочки переносятся в опухоли с помощью фагоцитоза , при котором фагоциты поглощают нанооболочки через клеточную мембрану, образуя внутреннюю фагосому или макрофаг . После этого он переносится в клетку, и ферменты для его метаболизма и вывода обратно из клетки обычно используются . Эти нанооболочки не метаболизируются, поэтому для того, чтобы они были эффективными, им просто необходимо находиться внутри опухолевых клеток , а фотоиндуцированная гибель клеток (как описано выше) используется для уничтожения опухолевых клеток. Эта схема представлена на рисунке 2.
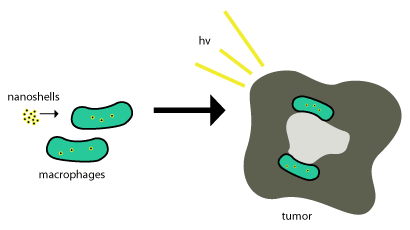
Терапия на основе наночастиц была успешно доставлена в опухоли за счет повышения проницаемости и эффекта удержания, свойства, которое позволяет наноразмерным структурам пассивно проникать в опухоли без помощи антител.[4] Доставка нанооболочек в важные участки опухоли может быть очень сложной. опухолью Именно здесь большинство нанооболочек пытаются использовать естественный набор моноцитов для доставки, как показано на рисунке выше. Эту систему доставки называют «Троянский конь». [ 8 ]
Этот процесс работает так хорошо, поскольку опухоли примерно на ¾ состоят из макрофагов, и как только моноциты попадают в опухоль, они дифференцируются в макрофаги, которые также будут необходимы для поддержания наночастиц груза . Как только нанооболочки оказываются в некротическом центре, используется ближнее инфракрасное освещение для разрушения макрофагов, связанных с опухолью.
Кроме того, эти наночастицы можно заставить высвобождать антисмысловые ДНК-олигонуклеотиды при фотоактивации. Эти олигонуклеотиды используются в сочетании с фототермической абляцией для проведения генной терапии. Это достигается за счет того, что комплексы наночастиц доставляются внутрь клеток, а затем подвергаются индуцированному светом высвобождению ДНК с их поверхности. Это позволит осуществлять внутренние манипуляции с клеткой и предоставит средства для мониторинга возвращения групповых клеток в равновесие. [ 9 ]
Другой пример плазмоники нанооболочек в лечении рака включает размещение лекарств внутри наночастиц и использование их в качестве средства доставки токсичных лекарств только к местам рака. [ 10 ] Это достигается путем покрытия внешней части наночастицы оксидом железа (что позволяет легко отслеживать ее с помощью аппарата МРТ ), а затем, как только область опухоли покрывается наночастицами, наполненными лекарством, наночастицы можно активировать с помощью резонансных световых волн, чтобы выпустить препарат.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Лоо, С; Лин, А; Хирш, Л; Ли, Мда; Бартон, Дж; Халас, Н; Уэст, Дж; Дрезек, Р. (февраль 2004 г.). «Визуализация и терапия рака на основе фотоники с использованием нанооболочек» . Технологии в исследовании и лечении рака . 3 (1): 33–40. дои : 10.1177/153303460400300104 . ПМИД 14750891 . S2CID 17523671 . Архивировано из оригинала (Полный текст) 23 октября 2007 года . Проверено 6 августа 2009 г.
- ^ Бринсон, Би; Ласситер, Дж.Б.; Левин, Кс; Бардхан, Р; Мирин, Н; Халас, Нью-Джерси (ноябрь 2008 г.). «Нанооболочки — это просто: улучшение роста слоев золота на поверхности наночастиц» . Ленгмюр . 24 (24): 14166–14171. дои : 10.1021/la802049p . ПМЦ 5922771 . ПМИД 19360963 .
- ^ Си-Эн-Эн. «Биография: Наоми Халас». Си-Эн-Эн. Cable News Network, 11 марта 2008 г. Интернет. 7 мая 2012 г. < http://edition.cnn.com/2007/TECH/science/06/11/halas.biog/ >.
- ^ Jump up to: а б «Лучшие открытия». – Лучшее из нанотехнологий. «Нанотехнологии сегодня», 29 марта 2008 г. Интернет. 7 мая 2012 г. < http://www.nanotech-now.com/2003-Awards/Best-Discoveries-2003.htm >.
- ^ Jump up to: а б с Дурайсвами, Суханья; Хан, Саиф (23 августа 2010 г.). «Синтез плазмонных нанооболочек в микрофлюидных композитных пенах». Нано-буквы . 9. 10 (9): 3757–3763. Бибкод : 2010NanoL..10.3757D . дои : 10.1021/nl102478q . ПМИД 20731386 .
- ^ Аббаси, Акрам; Пак, Кеунхан; Бозе, Ариджит; Ботун, Джеффри Д. (30 мая 2017 г.). «Золото-слоистые нанооболочки, чувствительные к ближнему инфракрасному диапазону». Ленгмюр . 33 (21): 5321–5327. doi : 10.1021/acs.langmuir.7b01273 . ISSN 0743-7463 . ПМИД 28486807 .
- ^ Бардхан, Р ; Грейди, Северная Каролина; Халас, Нью-Джерси (сентябрь 2008 г.). «Наномасштабный контроль усиления флуоресценции в ближнем инфракрасном диапазоне с использованием нанооболочек золота» . Нано Микро Маленький . 4 (10): 1716–1722. дои : 10.1002/smll.200800405 . ПМИД 18819167 .
- ^ Цой, г-н; Стэнтон-Мэкси, Кей Джей; Стэнли, Дж. К.; Левин, Кс; Бардхан, Р; Акин, Д; Бадве, С; Стерджис, Дж; Робинсон, Япония; Башир Р.; Халас, Нью-Джерси; Клэр, Се (декабрь 2007 г.). «Клеточный троянский конь для доставки терапевтических наночастиц в опухоли». Нано-буквы . 7 (12): 3759–65. Бибкод : 2007NanoL...7.3759C . дои : 10.1021/nl072209h . ПМИД 17979310 .
- ^ Бардан, Р; Лал, С; Джоши, А; Халас, Нью-Джерси (май 2011 г.). «Тераностические нанооболочки: от конструкции зонда до визуализации и лечения рака» . Отчеты о химических исследованиях . 44 (10): 936–946. дои : 10.1021/ar200023x . ПМЦ 3888233 . ПМИД 21612199 .
- ^ «Наночастицы, используемые для борьбы с раком мозга — ScienceDaily» .