Асимметричный гидролиз эфиров эстеразой свиной печени
Асимметричный гидролиз эфира эстеразой печени свиньи представляет собой энантиоселективное превращение сложного эфира в карбоновую кислоту под действием фермента эстеразы свиньи печени (EC 3.1.1.1). Асимметричный гидролиз сложного эфира включает селективную реакцию одной из пары либо энантиотопных (внутри одной и той же молекулы и связанных плоскостью симметрии молекулы), либо энантиоморфных (в энантиомерных молекулах и связанных как зеркальные отображения) сложноэфирных групп. [1]
Введение
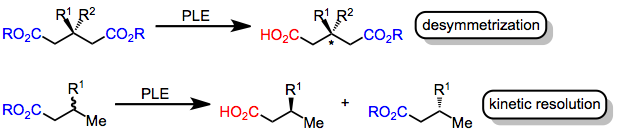
[ редактировать ]Ферменты, состоящие из хиральных аминокислот , катализируют химические реакции с высокой стереоселективностью . В частности, ферменты эстеразы катализируют гидролиз сложных эфиров до карбоновых кислот . Это превращение может быть асимметричным , если в субстрате существуют две энантиотопные сложноэфирные группы или если рацемическая смесь используется хиральных сложных эфиров. В первом случае ( десимметризация ) хиральное окружение активного центра фермента приводит к селективному гидролизу сложного эфира, находящегося ближе к каталитически активному остатку серина , когда субстрат связан с ферментом. В последнем случае ( кинетическое разрешение ) один из энантиомеров гидролизуется быстрее другого, что приводит к избытку гидролизуемого продукта одного энантиомера. Обе стратегии основаны на том факте, что переходные состояния гидролиза энантиотопных или энантиоморфных сложноэфирных групп хиральным ферментом являются диастереомерными . [2]
Эстераза печени свиньи (PLE) является широко используемым ферментом для асимметричного гидролиза сложных эфиров. Хотя первоначально он использовался для десимметризирующего гидролиза сложных эфиров глутарата, [3] PLE также гидролизует малонаты , циклические диэфиры, моноэфиры и другие субстраты. Модели активных сайтов были усовершенствованы, чтобы объяснить избирательность PLE. [4]
(1)
Механизм и стереохимия
[ редактировать ]Преобладающий механизм
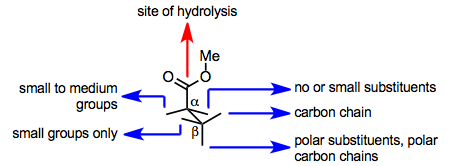
[ редактировать ]Активный центр PLE облегчает как связывание субстрата, так и гидролиз. Ключевой остаток серина в активном центре способствует гидролизу, но для того, чтобы гидролиз состоялся, субстрат должен представить сложноэфирную группу этому остатку после связывания с активным центром фермента. Способен ли субстрат представить сложноэфирную группу каталитическому остатку серина, зависит от его связанной конформации в активном центре, которая определяется боковыми цепями аминокислот в активном центре. Таким образом, модели активных центров PLE были разработаны с целью предсказать на основе структуры субстрата, какая из двух энантиотопных сложноэфирных групп будет гидролизована (или возможен ли гидролиз вообще).
Простая модель конформации связывания сложного эфира в активном центре PLE показана ниже. Эта модель точно предсказывает конфигурацию гидролизованных глутаратов и подобных субстратов.
(2)
Область применения и ограничения
[ редактировать ]Хотя область применения PLE в отношении субстратов широка, энантиоселективность варьируется в зависимости от структуры субстрата. В этом разделе описаны субстраты, которые гидролизуются PLE с наивысшей энантиоселективностью, а также чувствительные субстраты, которые могут быть гидролизованы до ахиральных карбоновых кислот с высоким выходом без побочных реакций.
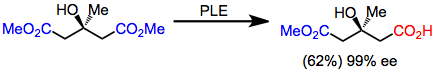
Глутараты были первыми субстратами, которые гидролизовались PLE с высокой энантиоселективностью. Хотя выходы умеренные, энантиоселективность чрезвычайно высока. [5]
(3)
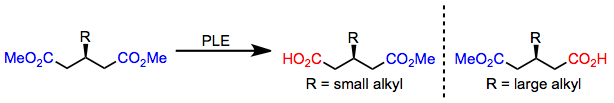
3-Алкилглутараты с небольшими алкильными заместителями гидролизуются до ( R )-моноэфира; однако, когда присутствует большой алкильный заместитель, образуется ( S )-моноэфир. [6] Это переключение энантиоселективности точно предсказывается моделью активного центра, приведенной выше.
(4)
Противоположная тенденция наблюдается при десимметризирующем гидролизе 2-метилмалонатов , в результате которого образуется ( S ) энантиомер, когда другой заместитель у C-2 мал, и ( R ) энантиомер, когда другой заместитель C-2 велик. [7]
(5)
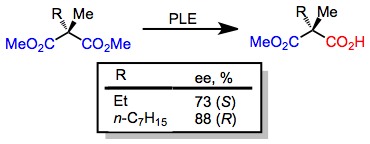
Ряд мезодиэфиров , отличных от описанных выше субстратов, можно гидролизовать с помощью PLE с высокой энантиоселективностью. Циклические мезодиэфиры имеют тенденцию гидролизоваться более избирательно, чем ациклические диэфиры. [8] Преобладающий энантиомер продукта зависит от размера кольца. [9] [10]
(6)

7-Оксабицикло[2.2.1]гептан-2,3-дикарбоксилаты представляют собой интересный класс диэфиров, которые гидролизуются PLE с высокой энантиоселективностью. [11] Эти субстраты использовались для энантиоселективного создания биологически значимых сахаров (см. «Применение в синтезе» ниже).
(7)
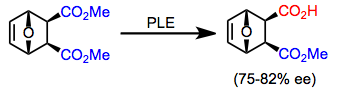
Рацемические смеси всех описанных выше субстратов, а также дополнительных хиральных диэфиров (таких как сложный эпоксидный эфир в уравнении (8)), можно разделить с использованием PLE для кинетического разделения. [12] Существенным недостатком кинетического разрешения является максимальный выход гидролизованного продукта 50%. Однако если наряду с гидролизом происходит быстрая рацемизация (пример динамического кинетического разрешения ), возможен максимальный выход 100%. [13]
(8)
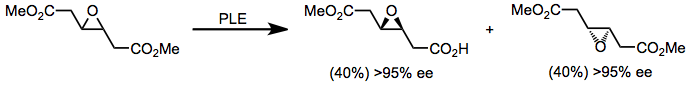
Ферменты эстеразы также можно использовать для гидролиза чувствительных к основаниям моноэфиров. PLE применялся для синтеза простагландинов для селективного гидролиза сложного эфира без разрушения β-гидроксикетонового фрагмента. [14]
(9)

Синтетические приложения
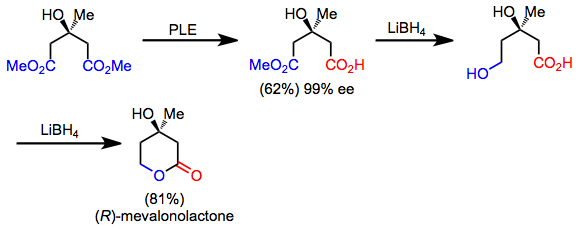
[ редактировать ]Ряд синтетических мишеней обладают скрытой симметрией, которую можно обнаружить, применив ретросинтетическое «симметризирующее» преобразование. В прямом направлении эта операция соответствует реакции десимметризации. Например, мевалонолактон можно быстро синтезировать из симметричного диэфира посредством десимметризирующего гидролиза, хемоселективного восстановления и лактонизации. [5] Хотя сам продукт асимметричен, десимметризация и манипуляции с функциональными группами позволяют его синтезировать из ахирального исходного материала.
(10)
Энантиоселективный гидролиз сопряженного диэфира с последующим озонолизом дает скелет рибозы. Полученные сахара затем используются для синтеза нуклеозидов. [15]
(11)

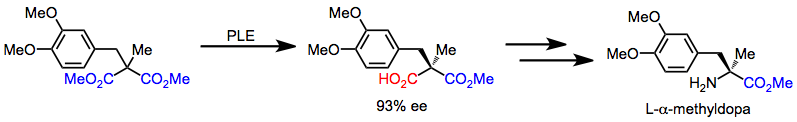
L-α-Метилдопа может быть быстро синтезирована из ахирального малоната посредством последовательности, начинающейся с десимметризации. Последующие хемоселективные превращения превращают карбоновую кислоту в амин. [16]
(12)
Сравнение с другими методами
[ редактировать ]Другие ферменты, которые можно использовать для асимметричного гидролиза сложных эфиров, включают ацетилхолинэстеразу электрического угря, [17] химотрипсин, [3] и пекарские дрожжи . [18] Субстратный состав этих ферментов отличается от PLE, и в некоторых случаях они могут обеспечивать гидролизованные продукты с более высоким выходом или энантиоселективностью, чем PLE. Микроорганизмы также можно использовать для энантиоселективного гидролиза; [19] однако трудности, связанные с обращением с микроорганизмами, сделали эти методы непопулярными для органического синтеза.
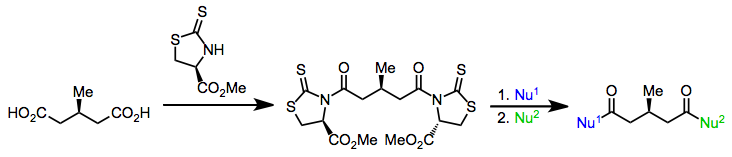
Неферментативные методы дифференциации энантиотопных групп используют хиральные катализаторы или вспомогательные вещества. Например, введение хиральной уходящей группы в обе группы карбоновой кислоты мезодикислоты приводит к избирательной атаке ахиральным нуклеофилом одной из (теперь) диастереотопных карбонильных групп. [20]
(13)
Условия и процедура эксперимента
[ редактировать ]Типичные условия
[ редактировать ]Ферментативные реакции ограничены необходимостью использования водного растворителя и условий, близких к нейтральным. Гидролиз PLE обычно проводят с использованием фосфатного буфера для поддержания pH между 7 и 8. Поскольку растворимость субстрата в водной среде имеет решающее значение, к водному раствору иногда добавляют небольшое количество полярного органического сорастворителя. фермент. Коммерчески доступный PLE имеет достаточную чистоту для большинства применений.
Ссылки
[ редактировать ]- ^ Оно, М.; Оцука, М. Орг. Реагировать. 1989 , 37 , 1. два : 10.1002/0471264180.or037.01
- ^ Рети, Дж.; Робинсон, Дж. Стереоспецифичность в органической химии и энзимологии , Verlag Chemie, Вайнхайм, 1982.
- ^ Перейти обратно: а б Коэн, С.; Хедури, EJ Am. хим. Соц. 1961 , 83 , 1093.
- ^ Землячка, Дж.; Крейн, Л.; Хейг, М.-Дж.; Оливер, JJ Org. хим. 1988 , 53 , 937.
- ^ Перейти обратно: а б Хуанг, футбольный клуб; Ли, ЛФХ; Миттал, ОСБ; Равикумар, PR; Чан, Дж.А.; Да, СиДжей; Кэпси, Э.; Эк, CR J. Am. хим. Соц. 1975 , 97 , 4144.
- ^ Дорога, ЛКП; Кость, RAHF; Джонс, JB J. Org. Ткань. 1986 , 51 , 2047.
- ^ Бьёрклинг, Ф.; Бутылка, Дж.; Гатенбек, С.; Хульт, К.; Норин, Т.; Шмулик, П. Тетраэдр 1985 , 41 , 1347.
- ^ Мор, П.; Ваэспе-Сареви, Н.; Тамм, К.; Гавронска, К.; Гавронски, Дж. Хелв. Хим. Акта 1983 , 66 , 2501.
- ^ Саббиони, Г.; Ши, ML; Джонс, JB J. Chem. Соц., хим. Общий. 1984 , 236.
- ^ Шнайдер, М.; Энгель, Н.; Хёнике, П.; Хайнеманн, Г.; Гёриш, Х. Ангью. хим. Эд. англ. 1984 , 23 , 67.
- ^ Перчатки, Г.; Банфи, Л.; Нарисано, Э.; Рива, Р.; Тея, С. Тетраэдр Летт, 1986 , 27 , 4639.
- ^ Мор, П.; Россляйн, Л.; Тамм, К. Хелв. Акта 1987 , 70 , 142.
- ^ Аллен, Дж.; Уильямс, Дж. Тетраэдр Летт. 1996 , 37 , 1859.
- ^ Хазато, Т.; Окамура, Н.; Сугиура, С.; Курозуми, С. Ниппон Кагаку Кайши, 1983 , 9 , 1390 [CA] , 100, 120720q (1984)].
- ^ Оно, М.; Кобаяши, С.; Адачи, К., «Ферменты как катализаторы в органическом синтезе» , Шнайдер, член парламента, издательство D. Reidel Publishing, Дордрехт, 1986, стр. 123–142.
- ^ Бьёрклинг, Ф.; Бутылка, Дж.; Гатенбек, С.; Хульт, К.; Норин, Т. Tetrahedron Lett. 1985 , 26 , 4957.
- ^ Дирдорф, доктор медицинских наук; Мэтьюз, Эй Джей; МакМикин, Д.С.; Крэйни, CL Tetrahedron Lett. 1986 , 27 , 1255.
- ^ Кершер, В.; Крейзер, В. Тетраэдр Летт. 1987 , 28 , 531.
- ^ Котани, Х.; Кузе, Ю.; Учида, С.; Миябе, Т.; Иимори, Т.; Окано, К.; Кобаяши, С.; Оно, М.; Сельское хозяйство. Биол. хим. 1983 , 47 , 1363.
- ^ Нагао, Ю.; Икеда, Т.; Яги, М.; Фудзита, Э.; Широ, M.J.Am. хим. Соц. 1982 , 104 , 2079.