Mad1
| Mad1 | |||
|---|---|---|---|
 Кристаллическая структура, тетрамер комплекса MAD1-MAD2, желтый и красный = MAD1 Мономеры, PALEGREEN = MAD2 MONOMERS | |||
| Идентификаторы | |||
| Организм | |||
| Символ | Mad1 | ||
| Входить | 852794 | ||
| PDB | 1go4 | ||
| Refseq (мРНК) | NM_001180951.3 | ||
| Refseq (prot) | NP_011429.3 | ||
| Uniprot | P40957 | ||
| Другие данные | |||
| Хромосома | VII: 0,35 - 0,35 МБ | ||
| |||
MAD1 -это несущественный белок , который в дрожжах имеет функцию в контрольно-пропускной пункте веретке (SAC). [ 1 ] Эта контрольная точка контролирует прикрепление хромосомы к микротрубочкам веретена и предотвращает запуск анафазы клеток до тех пор, пока веретк не будет построен. Название сумасшедшего относится к наблюдению, что мутантные клетки имеют дефицит остановки митотических средств (MAD) во время деполимеризации микротрубочек. MAD1 рекрутирует ингибитор анафазы MAD2 в непривязанные кинетохоры и имеет важное значение для MAD2- CDC20 формирования комплекса in vivo , но не in vitro . In vivo , MAD1 действует как конкурентный ингибитор из комплекса MAD2-CDC20. [ 2 ] MAD1 фосфорилируется с помощью MPS1, который затем приводит вместе с другими действиями к образованию митотического комплекса контрольной точки (MCC). Таким образом, он ингибирует активность комплекса, способствующего анафазу/циклосом (APC/C). Гомологи MAD1 сохраняются у эукариот от дрожжей до млекопитающих.
Введение
[ редактировать ]В начале 90 -х годов были идентифицированы гены дрожжей, которые привели к дефекту остановки митоза в ответ на разборку микротрубочек (гены дефицита митотической остановки - сумасшедшие гены). Эти клетки не показали митотической остановки в присутствии ингибиторов полимеризации микротрубочек и, следовательно, не были способны задержать деление клеток. [ 1 ] Идентифицированные гены включали гены MAD1 , MAD2 и MAD3 . Они сохраняются во всех эукариотах и участвуют в пути, который активно участвует в прометафазе, чтобы предотвратить преждевременное разделение сестринских хроматид и составляют так называемую контрольную точку сбора веретена (SAC). Эта контрольная точка отслеживает состояние прикрепления хромосомы к митотическому веретке и ингибирует метафазу к переходу анафазы , предотвращая активацию комплекса /циклосомы, способствующего анафазу (APC /C), и, таким образом, деградацию регулирующих органов клеточного цикла . [ 3 ] MAD1 в этом пути накапливается в непривязанных кинетохорах и выступает в качестве датчика для непривязанных кинетохоров в этом механизме.
Функция
[ редактировать ]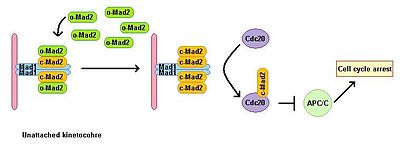
Эукариотические клетки демонстрируют митотическую остановку в присутствии ингибиторов полимеризации микротрубочек. Контрольная точка веретена веретке контролирует состояние веретена и связывает переход метафазы-анафазы с правильным биполярным прикреплением всех кинетохоров с митотическим веретеном. Контрольная точка сборки шпинделя ингибирует активность комплекса, способствующего анафазу, предотвращая деградацию нижестоящих эффекторов, что в противном случае приводит к началу анафазы и выходу из митоза. Истощение MAD1 приводит к потере функции SAC . MAD1 локализует преимущественно в непривязанных кинетохорах и запускает митотическую остановку в случае одного непривязанного кинетохора. MAD1 набирает важный компонент SAC MAD2 в непривязанные кинетохоры и вызывает усиление сигнала остановки митотического. Существует пул свободного цитоплазматического MAD2 в его неактивной открытой конформации под названием O-MAD2. Когда он связан с MAD1, MAD2 принимает активную конформацию, называемую закрытой (C-MAD2), и образует гетеротетрамер двух единиц MAD1 и двух единиц C-MAD2. Гетеротетрамер MAD1-C-MAD2 очень стабилен и работает как Каталитический рецептор для свободного цитоплазматического O-MAD2. Свободный O-MAD2 связывается с этим рецептором и изменяет его конформацию с активной закрытой формой. Этот второй C-MAD2 переносится в CDC20 с еще неизвестным механизмом и образует комплекс CDC20-C-MAD2. Этот комплекс является важным компонентом митотического комплекса контрольных точек (MCC). MCC связывает и ингибирует APC /C и, следовательно, арест прогрессирует за счет митоза. [ 3 ] [ 4 ]
Регулирование
[ редактировать ]Существуют две верхние контрольно -пропускные киназы , участвующие в регуляции функции MAD1 посредством фосфорилирования . [ 5 ] MPS1 фосфорилирует MAD1 как in vitro , так и in vivo и, как считается, регулирует локализацию MAD1 и MAD2 для кинетохоров и динамики их взаимодействия. Bub1 - это другая киназа, которая набирает Mad1 в кинетохоры и активирует ее, если кинетохор не привязан. [ 3 ] Если кинетохор прикреплен к шпинделю, ингибитор SAC P31 комета Ингибирует MAD1 -опосредованную конформационную перестройку MAD2 и предотвращает связывание MAD2 с CDC20. [ 3 ]
Структурные особенности и механизм
[ редактировать ]
Биохимическими методами MAD1 было предсказано, что кодирует 90 кД, 718-республика [ 6 ] с катушкой белок с характерной формой стержня [ 1 ] в 1995 году. Кристаллические структуры последовали в ближайшее время. Затем в 2002 году была опубликована кристаллическая структура человека MAD1 в комплексе с образованием MAD2 человека. Из-за экспериментальных ограничений структура показывает только остатки MAD1 484-584. Удлиненные мономеры MAD1 плотно скреплены параллельной катушкой с участием N-концевых альфа-спиралей. Цепи MAD1 указывают вдали от спиральной катушки к их лигандам MAD2, образующими два субкомплекса с MAD2. Сегмент между альфа -спиралями 1 и 2 содержит связующий домен MAD2. Первая часть этого связующего домена гибкая и принимает различные конформации, приводящие к асимметричному комплексу. В своей работе, используя термодинамические исследования, Sironi et al. [ 2 ] Покажите, что MAD1 функционирует, например, для замедления скорости формирования комплекса MAD2 -CDC20 и, следовательно, действует как конкурентный ингибитор in vivo . Кроме того, авторы предполагают, что сайты связывания MAD1-MAD2 похоронены внутри структуры, возможно, делают сайты связывания недоступными для связывания CDC20. Связывание MAD1-MAD2 необычна в том смысле, что C-концевые складки MAD2 над MAD1. Поэтому авторы приходят к выводу, что невозмутимый комплекс MAD1-MAD2 не выпустит MAD2, требующий нового, до сих пор плохо изученный механизм конформационных изменений. [ 2 ]
Рак
[ редактировать ]Несоответствия в количестве хромосомы (анеуплоидных) во время мейоза ответственны за заболевания человека, такие как синдром Дауна, а также часто появляются в раковых клетках. Основная функция SAC приводит к гипотезе о том, что мутации мешка и особенно инактивация мешка могут быть причиной онкогенеза или, по крайней мере, облегчать онкогенез. [ 3 ] Против этой идеи было показано, что раковые клетки подвергаются апоптозу, когда компоненты мешка не присутствуют. [ 7 ] В этой модели, в отличие от другой модели, инактивация мешка становится потенциальным способом убить быстро делящихся раковых клеток. Молекулярные связи между MAD1P, мешочком, апоптозом и раком до сих пор не до конца понятны. [ 3 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а беременный в Хардвик К.Г., Мюррей А.В. (1995). «MAD1P, фосфопротеиновый компонент контрольной точки веретенового сборки в почкующихся дрожжах» . Журнал клеточной биологии . 131 (3): 709–720. doi : 10.1083/jcb.131.3.709 . PMC 2120625 . PMID 7593191 .
- ^ Jump up to: а беременный в Сирони Л., Мапелли М., Кнапп С., Де Антони А., Жанг К.Т., Мусаккио А (2002). «Кристаллическая структура тетрамерного ядра MAD1 -MAD2: последствия механизма связывания« ремня безопасности »для контрольной точки веретена» . Embo Journal . 21 (10): 2496–2506. doi : 10.1093/emboj/21.10.2496 . PMC 126000 . PMID 12006501 .
- ^ Jump up to: а беременный в дюймовый и фон Musacchio A, Salmon Ed (май 2007 г.). «Контрольная точка с вереткой в пространстве и времени». НАТ Преподобный Мол. Клеточная биол . 8 (5): 379–93. doi : 10.1038/nrm2163 . PMID 17426725 . S2CID 205494124 .
- ^ Ю Х (апрель 2006 г.). «Структурная активация MAD2 в контрольной точке митотического шпинделя: модель MAD2 с двумя состояниями по сравнению с моделью шаблона MAD2» . J. Cell Biol . 173 (2): 153–157. doi : 10.1083/jcb.200601172 . PMC 2063805 . PMID 16636141 .
- ^ Bharadwaj R, Yu H (2000). «Контрольная точка шпинделя, анеуплоидия и рак». Онкоген . 23 (11): 2016–27. doi : 10.1038/sj.onc.1207374 . PMID 15021889 .
- ^ Чен Р.Х., Шевченко А., Манн М., Мюррей А.В. (1998). «Белок контрольно -пропускной пункты Spindle XMAD1 рекрутирует XMAD2 в непривязанные кинетохоры» . Журнал клеточной биологии . 143 (2): 283–295. doi : 10.1083/jcb.143.2.283 . PMC 2132829 . PMID 9786942 .
- ^ Kops GJ, Foltz DR, Cleveland DW (июнь 2004 г.). «Летальность к клеткам рака человека посредством массивной потери хромосомы путем ингибирования митотической контрольной точки» . Прокурор Нат. Академический Наука США . 101 (23): 8699–704. Bibcode : 2004pnas..101.8699K . doi : 10.1073/pnas.0401142101 . PMC 423258 . PMID 15159543 .