Физисорбция
Физисорбция , также называемая физической адсорбцией , представляет собой процесс, при котором электронная структура атома или молекулы практически не нарушается при адсорбции . [ 1 ] [ 2 ] [ 3 ]
Обзор
[ редактировать ]Фундаментальной взаимодействующей силой физисорбции является сила Ван-дер-Ваальса . Несмотря на то, что энергия взаимодействия очень мала (~10–100 мэВ), физисорбция играет важную роль в природе. Например, ван-дер-ваальсово притяжение между поверхностями и волосками на ногах гекконов (см. Синтетические щетинки ) обеспечивает замечательную способность взбираться вверх по вертикальным стенам. [ 4 ] Силы Ван-дер-Ваальса возникают в результате взаимодействия между индуцированными, постоянными или переходными электрическими диполями.
По сравнению с хемосорбцией , при которой изменяется электронная структура связывающих атомов или молекул и образуются ковалентные или ионные связи, физисорбция не приводит к изменению структуры химической связи. На практике отнесение конкретной адсорбции к физической или хемосорбции зависит главным образом от энергии связи адсорбата с подложкой, при этом физическая адсорбция намного слабее в пересчете на атом, чем любой тип соединения, включающий химическую связь.
Моделирование по заряду изображения
[ редактировать ]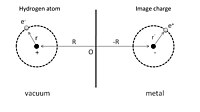
Чтобы дать простую иллюстрацию физисорбции, мы можем сначала рассмотреть адсорбированный атом водорода перед идеальным проводником, как показано на рис. 1. Ядро с положительным зарядом расположено в точке R = (0, 0, Z ), а Координата положения его электрона r = ( x , y , z ) задана относительно ядра. Процесс адсорбции можно рассматривать как взаимодействие между этим атомом водорода и его образными зарядами как ядра, так и электрона в проводнике. В результате полная электростатическая энергия представляет собой сумму членов притяжения и отталкивания:
Первый член представляет собой притягивающее взаимодействие ядра и его заряда-образа, а второй член обусловлен взаимодействием электрона и его заряда-образа. Отталкивающее взаимодействие показано в третьем и четвертом членах, возникающих в результате взаимодействия ядра и электрона изображения, и взаимодействия электрона и ядра изображения соответственно.
Разложением Тейлора по степеням | р | / | R |, эта энергия взаимодействия может быть дополнительно выражена как:
По первому неисчезающему члену можно найти, что потенциал физикосорбции зависит от расстояния Z между адсорбированным атомом и поверхностью как Z −3 , в отличие от р −6 зависимость молекулярного потенциала Ван-дер-Ваальса , где r — расстояние между двумя диполями .
Моделирование квантово-механическим осциллятором
[ редактировать ]Энергию связи Ван-дер-Ваальса проанализировать с помощью другой простой физической картины: моделирования движения электрона вокруг своего ядра с помощью трехмерного простого гармонического осциллятора с потенциальной энергией Va можно : [ нужны разъяснения ]
где m e и ω — масса и частота колебаний электрона соответственно.
Когда этот атом приближается к поверхности металла и образует адсорбцию, эта потенциальная энергия V a будет модифицироваться за счет зарядов изображения дополнительными потенциальными членами, квадратичными по смещениям:
- (из расширения Тейлора выше.)
Предполагая
потенциал хорошо аппроксимируется как
- ,
где
Если предположить, что электрон находится в основном состоянии, то энергия связи Ван-дер-Ваальса по существу представляет собой изменение нулевой энергии:
Это выражение также показывает природу Z −3 зависимость ван-дер-ваальсова взаимодействия.
Кроме того, вводя атомную поляризуемость ,
потенциал Ван-дер-Ваальса можно еще упростить:
где
— постоянная Ван-дер-Ваальса, связанная с поляризуемостью атома.
Кроме того, выразив поправку четвертого порядка в приведенном выше разложении Тейлора как ( aC v Z 0 ) / (Z 4 ), где a — некоторая константа, мы можем определить Z 0 как положение плоскости динамического изображения и получить
| Он | Ne | С | НОК | Машина | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Резюме | Я 0 | Резюме | Я 0 | Резюме | Я 0 | Резюме | Я 0 | Резюме | Я 0 | |
| С | 0.225 | 0.22 | 0.452 | 0.21 | 1.501 | 0.26 | 2.11 | 0.27 | 3.085 | 0.29 |
| В | 0.249 | 0.2 | 0.502 | 0.19 | 1.623 | 0.24 | 2.263 | 0.25 | 3.277 | 0.27 |
| В | 0.274 | 0.16 | 0.554 | 0.15 | 1.768 | 0.19 | 2.455 | 0.2 | 3.533 | 0.22 |
Происхождение Z 0 происходит из-за выплескивания волновой функции электрона за пределы поверхности. В результате положение плоскости изображения, представляющей опорную координату пространства, отличается от самой поверхности подложки и изменяется на Z 0 .
В табл. 1 представлен расчет модели желе для постоянной Ван-дер-Ваальса C v и плоскости динамического изображения Z 0 атомов инертного газа на различных металлических поверхностях. Увеличение C v от He до Xe для всех металлических подложек вызвано большей атомной поляризуемостью более тяжелых атомов инертного газа. Что касается положения плоскости динамического изображения, то оно уменьшается с увеличением диэлектрической функции и обычно составляет порядка 0,2 Å.
Физисорбционный потенциал
[ редактировать ]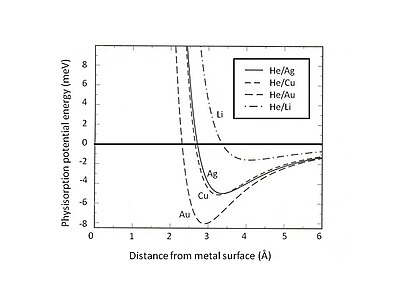
Несмотря на то, что взаимодействие Ван-дер-Ваальса является притягивающим, по мере приближения адсорбированного атома к поверхности волновая функция электрона начинает перекрываться с волновой функцией поверхностных атомов. В дальнейшем энергия системы будет возрастать из-за ортогональности волновых функций приближающегося атома и атомов поверхности.
Это Паулиевское исключение и отталкивание особенно сильны для атомов с закрытыми валентными оболочками, которые доминируют в поверхностном взаимодействии. В результате минимальная энергия физисорбции должна быть найдена путем баланса между дальнодействующим притяжением Ван-дер-Ваальса и короткодействующим отталкиванием Паули . Например, разделив общее взаимодействие физисорбции на два вклада - короткодействующий член, описанный теорией Хартри-Фока , и дальнодействующий притяжение Ван-дер-Ваальса - равновесное положение физической адсорбции для редких газов, адсорбированных на желеобразной можно определить подложке. . [ 5 ] На рис. 2 представлена потенциальная энергия физисорбции гелия, адсорбированного на подложках Ag, Cu и Au, описываемых моделью желе с различной плотностью размытых фоновых положительных зарядов. Можно обнаружить, что слабое взаимодействие Ван-дер-Ваальса приводит к неглубоким притягивающим энергетическим ямам (<10 мэВ). Одним из экспериментальных методов исследования потенциальной энергии физисорбции является процесс рассеяния, например, атомов инертного газа на металлических поверхностях. Некоторые особенности потенциала взаимодействия рассеянных атомов с поверхностью можно выявить, анализируя экспериментально определенные угловое распределение и сечения рассеянных частиц.
Квантово-механическое – термодинамическое моделирование площади поверхности и пористости
[ редактировать ]С 1980 года разрабатывались две теории, объясняющие адсорбцию и получающие работающие уравнения. Эти две гипотезы называются гипотезой хи, квантовомеханическим выводом и избыточной работой поверхности, ESW. [ 6 ] Обе эти теории приводят к одному и тому же уравнению для плоских поверхностей:
Где U — единичная ступенчатая функция. Определения остальных символов следующие:

где «ads» означает «адсорбированный», «m» означает «эквивалентность монослоя», а «vap» относится к давлению пара («ads» и «vap» — это последняя конвенция IUPAC, но «m» не имеет эквивалента IUAPC). обозначения) жидкого адсорбтива при той же температуре, что и твердый образец. Единичная функция определяет молярную энергию адсорбции первой адсорбированной молекулы следующим образом:
Сюжет адсорбированный по сравнению с называется сюжетом ци. Для плоских поверхностей наклон графика хи дает площадь поверхности. Эмпирически было отмечено, что этот график очень хорошо соответствует изотерме Поланьи. [ 7 ] [ 8 ] [ 9 ] а также деБоер и Цвиккер [ 10 ] но не преследуется. Это произошло из-за критики в первом случае со стороны Эйнштейна, а во втором - со стороны Брунауэра. Это уравнение плоской поверхности можно использовать в качестве «стандартной кривой» в обычной традиции кривых сравнения, за исключением того, что ранняя часть графика пористого образца против выступает в качестве эталона. С помощью этого метода можно анализировать ультрамикропористые, микропористые и мезопористые состояния. Типичные стандартные отклонения для подгонки полной изотермы, включая пористые образцы, обычно составляют менее 2%.
Типичное соответствие хорошим данным на однородной непористой поверхности показано на рисунке 3. Данные предоставлены Пейном, Сингом и Терком. [ 11 ] и был использован для создания -s стандартная кривая. В отличие от BET, который в лучшем случае может соответствовать только диапазону от 0,05 до 0,35 P / P vap , диапазон соответствия представляет собой полную изотерму.
Сравнение с хемосорбцией
[ редактировать ]- Физисорбция является общим явлением и происходит в любой системе твердое тело/жидкость или твердое тело/газ. Хемосорбция характеризуется химической специфичностью.
- При физисорбции возмущение электронных состояний адсорбента и адсорбата минимально. Силы адсорбции включают лондонские силы, диполь-дипольное притяжение, диполь-индуцированное притяжение и «водородную связь». При хемосорбции изменения электронных состояний можно обнаружить с помощью подходящих физических средств, другими словами, химической связи.
- Типичная энергия связи при физической сорбции составляет около 10–300 мэВ и нелокализована. Хемосорбция обычно образует связи с энергией 1–10 эВ и носит локализованный характер.
- Элементарный этап физисорбции из газовой фазы не требует энергии активации . Хемосорбция часто включает в себя энергию активации.
- Для физисорбционных молекул газовой фазы, адсорбатов, образуется многослойная адсорбция, если только физические барьеры, такие как пористость, не мешают. При хемосорбции молекулы адсорбируются на поверхности валентными связями и образуют только монослойную адсорбцию.
- Прямой переход от физисорбции к хемосорбции наблюдался путем прикрепления молекулы CO к кончику атомно-силового микроскопа и измерения ее взаимодействия с одним атомом железа. [ 12 ] Этот эффект наблюдался в конце 1960-х годов для бензола в результате автоэлектронной эмиссии, как сообщил Кондон. [ 13 ] и измерения СОЭ, как сообщили Мойес и Уэллс. [ 14 ]
- Другой взгляд на это заключается в том, что хемосорбция изменяет топологию электронов в молекуле адсорбата (в процессе химической реакции), а физическая адсорбция - нет.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ К. Оура; и др. (2003), Наука о поверхности, Введение , Берлин: Springer, ISBN 978-3-540-00545-2
- ^ MC Desjonqueres; и др. (1996), Концепции физики поверхности (2-е изд.), Нью-Йорк: Springer-Verlag, ISBN 978-3-540-58622-7 , получено 29 августа 2012 г.
- ^ Ганс Лют; и др. (1993), Поверхности и границы раздела твердых тел , Springer-Verlag, ISBN 978-3-540-56840-7
- ^ К. Осень; и др. (2000), «Сила адгезии одного волоска на ноге геккона», Nature , 405 (6787): 681–5, Bibcode : 2000Natur.405..681A , doi : 10.1038/35015073 , PMID 10864324 , S2CID 4430651
- ^ Перейти обратно: а б Э. Заремба и В. Кон (1977), «Теория адсорбции гелия на поверхностях простых и благородных металлов», Phys. Rev. B , 15 (4): 1769–1781, Bibcode : 1977PhRvB..15.1769Z , doi : 10.1103/PhysRevB.15.1769.
- ^ Кондон, Джеймс (2020). Определение площади поверхности и пористости методом физисорбции, 2-е издание. Измерение, классическая теория и квантовая теория . Амстердам, Нидерланды: Elsevier. стр. Главы 3, 4 и 5. ISBN. 978-0-12-818785-2 .
- ^ Поланьи, М. (1914). Продажи на немецком языке. Физика, газ . 16 :1012.
{{cite journal}}: Отсутствует или пусто|title=( помощь ) - ^ Поланьи, М. (1920). «Новости об адсорбции и причине адсорбционных сил». З. Электрохим . 26 :370-374.
- ^ Поланьи, М. (1929). «Основы потенциальной теории адсорбции». З Электрогем . 35 : 431-432.
- ^ деБоер, Дж. Х.; Цвиккер, К. (1929). «Адсорбция как следствие поляризации». З. Физ. Хим . Б3 : 407–420.
- ^ Пейн, округ Колумбия; Синг, KSW; Д. Х. Турк (1973). «Сравнение изотерм адсорбции аргона и азота на пористом и непористом гидроксилированном кремнеземе». J. Наука о коллоидном интерфейсе . 43 (2): 287–293. дои : 10.1016/0021-9797(73)90376-7 .
- ^ Хубер, Ф.; и др. (12 сентября 2019 г.). «Образование химической связи, показывающее переход от физисорбции к хемосорбции» . Наука . 365 (6462): 235–238. Бибкод : 2019Sci...365..235H . дои : 10.1126/science.aay3444 . ПМИД 25791086 . S2CID 202569091 .
- ^ Кондон, Дж. Б. (1968). Автоэмиссионные и фламентные исследования процессов гидрирования и дегидрирования циклогексана и бензола на поверхности вольфрама (Диссертация).
- ^ Мойес, МЛ; Уэллс, П.Б. (1973). «Адсорбция бензола на металлах». Адв. Катал . 20 : 591–622.

















