Перисинаптические шванновские клетки
Перисинаптические шванновские клетки (также известные как терминальные шванновские клетки или телоглия ) представляют собой нейроглию , обнаруженную в нервно-мышечном соединении (НМС) с известными функциями в синаптической передаче, синаптогенезе и регенерации нервов. [1] Эти клетки имеют общего предка как с миелинизирующими, так и с немиелинизирующими шванновскими клетками, называемыми клетками нервного гребня . Перисинаптические шванновские клетки (ПСК) способствуют организации трехчастного синапса в сочетании с пресинаптическим нервом и постсинаптическим мышечным волокном. [1] PSC считаются глиальным компонентом нервно-мышечного соединения (NMJ) и имеют функциональность, аналогичную функции астроцитов в центральной нервной системе . [2] Характеристики ПСК основаны как на внешних синаптических свойствах, так и на внутренних глиальных свойствах, при этом внутренние характеристики ПСК развиваются на основе ассоциированного синапса, например: ПСК быстросокращающегося мышечного волокна отличаются от ПСК медленносокращающегося мышечного волокна. мышечные волокна, даже если они удалены из их естественной синаптической среды. [3] PSC быстросокращающихся мышечных волокон имеют более высокие уровни кальция в ответ на иннервацию синапсов по сравнению с медленно сокращающимися PSC. Этот баланс между внешними и внутренними влияниями создает ряд ПСК, которые присутствуют во многих нервно-мышечных соединениях периферической нервной системы .
Открытие
[ редактировать ]
Перисинаптические (терминальные) шванновские клетки были впервые обнаружены Луи-Антуаном Ранвье в 1878 году, когда он наблюдал ветвящиеся сети, окружающие двигательную концевую пластинку (нервную часть НМС). [1] Он описал PSC как «ядра разветвления» из-за их многочисленных выступов в синапс, видимых под микроскопом. Эти клетки отличались от ядер мышечных волокон и моторной концевой пластинки, что составляло третий компонент трехсторонней синаптической модели. [1] Было обнаружено, что эти недавно обнаруженные клетки присутствовали в моделях дегенерации нервов, что свидетельствует об их неневральной природе. Близость PSC к концевой пластине двигателя вызвала вопросы об их функциональности, но мало что было известно до тех пор, пока не были проведены обширные исследования, проведенные за последние два десятилетия.
Разработка
[ редактировать ]Происхождение перисинаптических (терминальных) шванновских клеток в значительной степени подвергалось сомнению в 1960-х годах, поскольку существовали споры о том, имеют ли эти клетки эпителиальное или глиальное происхождение, но развитие PSCs было связано с происхождением нервного гребня. [1] Как описано выше, ПСК представляют собой тип немиелинирующих шванновских клеток, которые развиваются из клеток нервного гребня. Общую серию событий развития можно резюмировать следующим образом: клетки нервного гребня развиваются в предшественников шванновских клеток, которые в дальнейшем развиваются в незрелые шванновские клетки, которые затем дифференцируются в миелинизирующие шванновские клетки и немиелинизирующие шванновские клетки, подмножеством которых являются перисинаптические шванновские клетки.
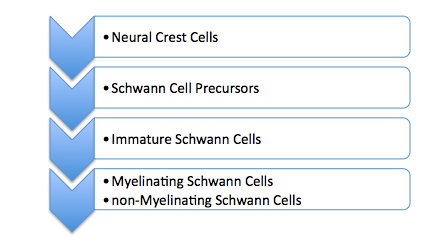
Клетки нервного гребня находятся в дорсальной части нервной трубки, из которой растут как нервы, так и глия. [1] Клетки нервного гребня являются предшественниками многих различных типов тканей, включая кишечные нейроны и глию. Предшественники шванновских клеток (первые производные клеток нервного гребня) присутствуют по мере роста нервного аксона из дорсальной части нервной трубки, но было показано, что эти глиальные предшественники не являются существенными для роста аксонов. [2] Переход от клеток нервного гребня к предшественникам шванновских клеток характеризуется Sox10. [1] и обычно происходит примерно на 12-13-й день эмбрионального развития у крыс. [2] Предшественники шванновских клеток затем дифференцируются в незрелые шванновские клетки, от которых непосредственно происходят миелинизирующие и немиелинирующие шванновские клетки. Эти клетки обычно появляются у крыс примерно на 13-15 день эмбрионального развития. [2] Дифференцировка незрелых шванновских клеток происходит после рождения и зависит от аксонов, с которыми связана глия. Известно, что эта дифференциация обратима, как видно из моделей регенерации. [2] Перисинаптические шванновские клетки развиваются как немиелинирующие шванновские клетки и инкапсулируют НМС. ПСХ можно отнести к глиальной линии по наличию кальцийсвязывающих белков S100, глиального фибриллярного кислого белка (GFAP) и белка 0. [1] Эти белки наблюдаются в других глиальных клетках, таких как миелинизирующие шванновские клетки и клетки нервного гребня. Хотя происхождение немиелинизирующих шванновских клеток известно из клеток нервного гребня, точное развитие ПСК из немиелинизирующих шванновских клеток до конца не изучено. [1]
Роли в нервно-мышечном соединении (НМС)
[ редактировать ]Синаптогенез
[ редактировать ]Синаптогенез — это образование синапса, и в этом случае интерес представляет нервно-мышечный переход. В этом разделе основное внимание уделяется развитию НМС в результате роста аксонов во время развития. [1] Как упоминалось в разделе о разработке, предшественники шванновских клеток сопровождают растущие аксоны, когда они достигают связанных с ними мышц. Сейчас известно, что эти предшественники PSC не являются существенными для роста аксонов, но когда они присутствуют, они направляют конусы роста и помогают поддерживать NMJs после их формирования. [1] [2] [4] После формирования первичного нервно-мышечного интерфейса наблюдается поразительный рост числа ПСК в каждом вновь развившемся НМС. Однако если после формирования НМС наблюдается недостаток PSC (например, в аблированной модели), то может наблюдаться отсутствие дальнейшего роста аксонов или даже ретракция аксонов. Это видно в исследовании НМС лягушек через 8 и 12 дней после абляции, где к 12-му дню наблюдалась степень ретракции 44% без PSC. [2] Это сокращение показывает, что PSCs не важны для роста аксонов, но необходимы для долгосрочного поддержания NMJs.
Были разработаны культуры, моделирующие функции ПСК с использованием различных факторов клеточного происхождения in vitro. Эти культуры используются для понимания молекулярной основы, благодаря которой PSC способствуют синаптогенезу. Из этих культур было обнаружено, что TGF-β1 (трансформирующий фактор роста-β1) необходим для развития синапсов in vitro. [5] Этот TGF-β1, по-видимому, останавливает рост нервов, способствуя образованию нервно-мышечных синапсов, однако его роль in vivo неизвестна. [5]
Техническое обслуживание НМД
[ редактировать ]Известно, что PSC необходимы для обслуживания НМС во время разработки. [2] но PSC необходимы и для зрелого НМС. В моделях абляции лягушек наблюдается наблюдаемая разница в свойствах НМС, которая возникает примерно через семь дней после выборочного удаления ПСК. Эти изменения включают как структурные, так и функциональные нарушения. В моделях абляции образцы отбирались через регулярные промежутки времени после удаления ПСК. Сразу после абляции (через 5 часов) не было заметных различий в синаптической структуре или функциональности. Потенциалы концевых пластинок мотора не изменились в моделях с предварительной аблацией и 5-часовой аблацией, что показывает, что PSC не являются необходимыми для кратковременного поддержания НМС. [1] Примерно 13% удаленных НМС были частично или полностью втянуты через неделю после абляции, а частота потенциалов концевой пластинки снизилась на 50%, что означает, что НМС стреляли примерно вдвое реже! [1] Эту же модель абляции нельзя реализовать на млекопитающих, поскольку антитело mAB sA12, используемое в модели лягушки, не удаляет PSC млекопитающих. ПСХ млекопитающих при лечении антителами против ганглиозидов при синдроме Миллера-Фишера не показывают изменений свойств НМС в краткосрочной перспективе, но долгосрочные данные не собраны. Можно предположить, что PSCs играют важную роль в долгосрочном поддержании NMJ лягушек, но неизвестно, справедливы ли те же эффекты для NMJ млекопитающих. [1]
передача НМД
[ редактировать ]Есть два предлагаемых способа, с помощью которых PSC могут взаимодействовать с передачей в NMJ. Одним из способов, с помощью которого это может произойти, является обнаружение и дифференциация синаптических передач или, в некотором смысле, «слышание» передачи НМС. Другой — это изменение и участие в передаче в NMJ или «разговор» с уже существующим сообщением.
Прослушивание синаптических передач
[ редактировать ]Первым доказательством того, что PSC могут выполнять не только вспомогательную роль, стало открытие повышенного уровня кальция в PSC во время передачи NMJ. [1] Это увеличение внутриклеточных уровней кальция не наблюдается в миелинизирующих шванновских клетках, выстилающих аксон, а только в ПСК, присутствующих в НМС. Это увеличение внутриклеточного кальция с тех пор было связано с синаптическим высвобождением нейротрансмиттеров в синапсе, но взаимосвязь между высвобождением кальция и наличием нейротрансмиттеров не является совершенно линейной, а более сложной из-за множества внешних и внутренних факторов. [6] Эту способность реагировать на активность НМС можно дополнительно изучить, наблюдая за распознаванием амплитуд пресинаптической симуляции и распознаванием образов в PSC.
Также известно, что при НМС с множественной иннервацией ПСК способны обнаруживать передачи от «конкурирующих источников». Эта дифференциация наблюдается по различным уровням кальция, пропорциональным амплитуде моделирования. [7] Эти изменения кальция были разными для двух конкурирующих источников. «Более сильный» импульс, воспринимаемый PSC, вызывает более высокий уровень внутриклеточного кальция, а это означает, что PSC способны различать более сильный из двух входных сигналов в NMJ. [7]
Уровни кальция также варьируются в зависимости от способа проведения стимуляции. [8] Было проведено исследование для наблюдения за реакцией глии как на «всплеск», так и на «непрерывный» импульс, и реакции не оказались одинаковыми. Эти два шаблона состояли из: 1800 импульсов частотой 20 Гц с временем восстановления и 1800 импульсов частотой 20 Гц непрерывно. [8] Уровни кальция в ответ на «всплеск» колебались, а уровни кальция в ответ на «непрерывный» режим были постоянными.
Эти результаты показывают, что PSC фактически способны «распознавать» уникальные передачи через NMJ. Эти «узнавания» характеризуются амплитудой и продолжительностью повышения внутриклеточного кальция.
Участие в синаптической передаче
[ редактировать ]Также видно, что в результате реакции на передачу NMJ PSC могут также изменять синаптические передачи. Наблюдаемое выше увеличение кальция возможно за счет белковых рецепторов ПСК: рецепторов АХ, АТФ-рецепторов, G-связанных рецепторов и других рецепторов. [1] Манипуляции с G-сопряженными белковыми рецепторами PSC приводят к изменению синаптической передачи. Если G-сопряженные рецепторы стимулировались GTP-подобным лигандом, результат проявляется в уменьшении высвобождения нейромедиатора. Если GDP-подобный лиганд используется для стимуляции тех же G-связанных рецепторов, видно, что наблюдается уменьшение депрессии синапсов. [2] Эти изменения показывают, что PSC играют активную роль в синаптической передаче. Хотя эти взаимодействия поддаются измерению, влияние активности PSC в NMJ незначительно по отношению к импульсу пресинаптических двигательных нейронов, а это означает, что изменения, которые PSC вносят в активность NMJ, не являются значительными. [2]
Регенерация НМС
[ редактировать ]PSC играют важную роль в синаптогенезе во время развития, а также в регенерации нервных аксонов после повреждения нерва. Если происходит повреждение нерва, PSC образуют мостики PSC, которые соединяют соседние участки НМС. Восстанавливающийся аксон растет вдоль каркаса базальной пластинки, оставшейся от поврежденных шванновских клеток, и достигает проксимального участка ПСХ (ближайшего НМС). Мосты PSC соединяют соседние сайты NMJ и обеспечивают рост аксонов от одного NMJ к другому. Этот мост представляет собой более короткое расстояние для роста аксонов, чем первоначальный маршрут. После того как аксон иннервировал оба участка, он продолжает расти в ретроградном направлении (к месту повреждения), иннервируя другие пораженные НМС. PSC играют большую роль в создании каркасов роста от одного поврежденного НМС к другому. Эти мосты PSC наблюдаются in vivo после опосредованного комплементом повреждения на мышиной модели, показывая, что эта роль PSCs присутствует в NMJ млекопитающих. [9] Также было замечено, что окончания моторной концевой пластинки нестабильны без рецепторов M 2 ACh, а рост мышечных волокон не контролируется в отсутствие рецепторов M 5 ACh. [10] Это показывает, что при регенерации НМС рецепторы АХ, присутствующие на ПСК, модулируют и контролируют рост.
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п Армати, Патрисия Дж. (2007). Биология шванновских клеток . Издательство Кембриджского университета.
- ^ Перейти обратно: а б с д и ж г час я дж Сугира, Йоши; Вэйчунь Линь (2011). «Взаимодействия нейрон-глия: роль шванновских клеток в формировании и функционировании синапсов» . Отчеты по биологическим наукам . 31 (5): 295–302. дои : 10.1042/bsr20100107 . ПМЦ 4573580 . ПМИД 21517783 .
- ^ Русе, И.; А. Сен-Амур; Х. Дарабид; Р. Робитай (2010). «Взаимодействия синапса и глии регулируются синаптическими и внутренними свойствами глии». Нейронаука . 167 (3): 621–632. doi : 10.1016/j.neuroscience.2010.02.036 . ПМИД 20188148 . S2CID 9669117 .
- ^ Армати, Патрисия Дж.; Эмили К. Мэти (15 октября 2013 г.). «Обновленная информация о биологии шванновских клеток: иммуномодуляция, нервная регуляция и другие сюрпризы» . Журнал неврологических наук . 333 (1–2): 68–72. дои : 10.1016/j.jns.2013.01.018 . ПМИД 23422027 .
- ^ Перейти обратно: а б Фэн, Чжихуа; Чейн-Пин (24 сентября 2008 г.). «Ко» . Журнал неврологии . 28 (39): 9599–9609. doi : 10.1523/jneurosci.2589-08.2008 . ПМЦ 3844879 . ПМИД 18815246 .
- ^ Белэр, Ева-Лайн; Джоан Валле; Ричард Робитайл (2010). «Долгосрочная синаптическая пластичность глиальных клеток in vivo» . Журнал физиологии . 588 (7): 1039–1056. дои : 10.1113/jphysicalol.2009.178988 . ПМЦ 2852994 . ПМИД 20142269 .
- ^ Перейти обратно: а б Дарабид, Хусам; Даниэль Арбур; Ричард Робитайл (2013). «Гиальные клетки расшифровывают синаптическую конкуренцию в нервно-мышечном соединении млекопитающих» . Журнал неврологии . 33 (4): 1297–1313. doi : 10.1523/jneurosci.2935-12.2013 . ПМК 6618718 . ПМИД 23345206 .
- ^ Перейти обратно: а б Тодд, Кейт Дж.; Хусам Дарабид; Ричард Робитайл (2010). «Перисинаптическая глия различает паттерны двигательной нервной активности и влияет на пластичность нервно-мышечного соединения» . Журнал неврологии . 30 (35): 11870–11882. doi : 10.1523/jneurosci.3165-10.2010 . ПМК 6633406 . ПМИД 20810906 .
- ^ Рупп, Энджи; Ян Моррисон; Дженнифер А. Барри; Сьюзен К. Холстед; Кейт Х. Таунсон; Кей Н. Гриншилдс; Хью Дж. Уиллисон (2011). «Разрушение и регенерация концов двигательного нерва после антиганглиозидных антител и повреждения, опосредованного комплементом: исследование изображений in и ex vivo на мышах». Экспериментальная неврология . 233 (2): 836–848. дои : 10.1016/j.expneurol.2011.12.010 . ПМИД 22197826 . S2CID 26859542 .
- ^ Райт, Меган С.; Шрилатха Потлури; Сюэён Ван; Ева Денчева; Динеш Гаутам; Алан Тесслер; Юрген Весс; Марк М. Рич; Ён-Джин Сон (25 ноября 2009 г.). «Различные подтипы мускариновых ацетилхолиновых рецепторов способствуют стабильности и росту, но не компенсаторной пластичности нервно-мышечных синапсов» . Журнал неврологии . 29 (47): 14942–14955. doi : 10.1523/jneurosci.2276-09.2009 . ПМК 2822401 . ПМИД 19940190 .