Тройная резонансная спектроскопия ядерного магнитного резонанса
Эксперименты с тройным резонансом — это набор многомерных экспериментов по спектроскопии ядерного магнитного резонанса (ЯМР), которые связывают три типа атомных ядер , чаще всего состоящих из 1 ЧАС, 15 Н и 13 C. Эти эксперименты часто используются для присвоения определенных резонансных сигналов конкретным атомам в изотопно-обогащенном белке. Впервые техника была описана в статьях Ад Бакса , Мицухико Икуры и Льюиса Кея в 1990 году. [1] [2] и затем к набору экспериментов были добавлены дальнейшие эксперименты. Многие из этих экспериментов с тех пор стали стандартным набором экспериментов, используемых для последовательного определения резонансов ЯМР при определении структуры белка с помощью ЯМР . Теперь они являются неотъемлемой частью ЯМР-исследования белков в растворе, а также могут использоваться в твердотельном ЯМР . [3] [4]
Фон
[ редактировать ]Существует два основных метода определения структуры белка на атомном уровне. Первый из них — рентгеновская кристаллография кристаллическая структура миоглобина , начиная с 1958 года, когда была определена . Второй метод - ЯМР, который начался в 1980-х годах, когда Курт Вютрих изложил основы ЯМР-определения структуры белков и решил структуру небольших глобулярных белков. [5] Ранний метод определения структуры белка с помощью ЯМР основывался на гомоядерной ЯМР-спектроскопии на основе протонов, в которой размер белка, который можно определить, ограничен ~ 10 кДа. Это ограничение связано с необходимостью относить сигналы ЯМР от большого количества ядер в белке – в более крупном белке большее количество ядер приводит к переполнению резонансов, а увеличение размера белка также расширяет сигналы, делая резонанс задание сложное. Эти проблемы можно облегчить, используя гетероядерную ЯМР-спектроскопию, которая позволяет редактировать спектр протонов по отношению к 15 Н и 13 C химические сдвиги , а также уменьшает перекрытие резонансов за счет увеличения числа измерений спектра. В 1990 году Ад Бакс и его коллеги разработали технологию тройного резонанса и провели эксперименты с белками, изотопно меченными изотопами. 15 Н и 13 С, [1] в результате чего спектры значительно упрощаются, что значительно облегчает процесс резонансного отнесения и увеличивает размер белка, который можно определить с помощью ЯМР.
В этих экспериментах с тройным резонансом используются относительно большие магнитные связи между определенными парами ядер для установления их связи. В частности, 1 Дж НХ , 1 Джей Ч. , 1 J CC и 1 Соединения J CN используются для установления скалярного пути связи между ядрами. Процесс переноса намагниченности происходит через несколько эффективных этапов переноса намагничивания с одной связью, а не за один этап через меньшие и переменные этапы. 3 J HH Муфты . Относительно большой размер и хорошая однородность связей с одной связью позволили разработать эффективные схемы переноса намагниченности, которые эффективно однородны по всему белку, почти независимо от конформации. [3] Эксперименты по тройному резонансу с участием 31 P также может быть использован для исследований нуклеиновых кислот. [6]
Набор экспериментов
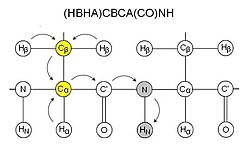
[ редактировать ]Эти эксперименты обычно называются по ядрам (H, N и C), участвующим в эксперименте. CO относится к карбонильному углероду , тогда как CA и CB относятся к Cα и Cβ соответственно, аналогично HA и HB для Hα и Hβ (примеры экспериментов см. на диаграмме). Ядра в названии расположены в той же последовательности, что и в пути переноса намагниченности, ядра, указанные в скобках, участвуют в пути переноса намагниченности, но не регистрируются. Из соображений чувствительности эти эксперименты обычно начинаются с протона и заканчиваются на протоне, обычно с помощью INEPT и обратных этапов INEPT. Таким образом, многие из этих экспериментов можно назвать экспериментами «туда-обратно», в которых, хотя это и не указано в названии, намагниченность передается обратно исходному протону для получения сигнала.
Некоторые эксперименты используются совместно для резонансного определения белка, например, HNCACB может использоваться вместе с CBCA(CO)NH в качестве пары экспериментов. Не все эти эксперименты необходимо записывать для последовательного задания (это можно сделать всего с двумя экспериментами), однако дополнительные пары экспериментов полезны для независимой оценки правильности задания, а избыточность информации может быть необходима, когда есть неясность в заданиях. Для полного определения резонансов боковой цепи необходимы и другие эксперименты.
Версии многих из этих экспериментов TROSY существуют для повышения чувствительности. [7] Эксперименты с тройным резонансом также могут быть использованы для определения резонанса основной цепи для конкретных последовательностей с вращением под магическим углом спектров ЯМР в твердотельном ЯМР . [4] [8]
Было проведено большое количество экспериментов ЯМР с тройным резонансом, и перечисленные ниже эксперименты не претендуют на исчерпывающий характер.
ГНКО
[ редактировать ]В эксперименте установлены связи амида остатка с карбонильным углеродом предшествующих остатков. [2] Это наиболее чувствительный из экспериментов с тройным резонансом. боковые цепи карбоксамидов аспарагина глутамина и В этом эксперименте также видны . Кроме того, в этом спектре также может появиться гуанидиногруппа аргинина , константа связи которой аналогична карбоксамидной группе. Этот эксперимент иногда используется вместе с HN(CA)CO.
HN(CA)CO
[ редактировать ]Здесь амидный резонанс остатка коррелирует с карбонильным углеродом того же остатка, а также с карбонильным углеродом предыдущего остатка. Внутриостаточные резонансы обычно сильнее, чем межостаточные. [9]
HN(CO)CA
[ редактировать ]Этот эксперимент коррелирует резонансы амида остатка с Cα предыдущего остатка. Этот эксперимент часто используется вместе с HNCA. [10]
HNC
[ редактировать ]Этот эксперимент коррелирует химический сдвиг амида остатка Cα того же остатка, а также сдвигов предыдущего остатка. [2] Каждая полоска дает два пика: межостаточный и внутриостаточный Cα-пики. Пик предыдущего Cα можно идентифицировать из эксперимента HN(CO)CA, который дает только межостаточный Cα.
CBCA(CO)NH
[ редактировать ]CBCA(CO)NH или, альтернативно, HN(CO)CACB коррелирует резонансы амида остатка с Cα и Cβ предыдущего остатка. [11] Таким образом, для каждого остатка видны два пика, соответствующие Cα и Cβ. Этот эксперимент обычно используется вместе с HNCACB. Карбоксамид боковой цепи глутаминов и аспарагинов также появляется в спектрах этого эксперимента. CBCA(CO)NH иногда точнее называют (HBHA)CBCA(CO)NH, поскольку он начинается с алифатических протонов и заканчивается амидным протоном, и поэтому не является обратным экспериментом, таким как HN(CO)CACB.
HNCACB
[ редактировать ]HNCACB или, альтернативно, CBCANH, коррелирует химический сдвиг амида остатка с Cα и Cβ того же остатка, а также со сдвигами предыдущего остатка. [12] В каждой полоске могут быть видны четыре пика – 2 от того же остатка и 2 от предыдущего остатка. Пики предыдущего остатка обычно слабее и могут быть идентифицированы с помощью CBCA(CO)NH. В этом эксперименте пики Cα и Cβ находятся в противоположной фазе, т.е. если Cα выглядит как положительный пик, то Cβ будет отрицательным, что упрощает идентификацию Cα и Cβ. Дополнительная информация о Cβ из серии экспериментов CBCA(CO)NH/HNCACB облегчает идентификацию типа остатка, чем HN(CO)CA/HNCA, однако HNCACB является менее чувствительным экспериментом и может быть непригодным для некоторых белков.
Эксперимент CBCANH менее подходит для более крупных белков, поскольку он более подвержен проблеме ширины линии, чем HNCACB.
CBCACO(CA)HA
[ редактировать ]Этот эксперимент обеспечивает связь между Cα и Cβ с карбонильным углеродом и атомами Hα в пределах одного и того же остатка. [13] группа боковой цепи Карбоксильная аспартата и глутамата может проявляться в этом спектре слабо.
CC(CO)NH
[ редактировать ]Этот эксперимент обеспечивает связь между амидом остатка и алифатическими атомами углерода предыдущего остатка. [14]
H(CCO)NH
[ редактировать ]Этот эксперимент обеспечивает связь между амидом остатка и атомами водорода, присоединенными к алифатическому углероду предыдущего остатка.
HBHA(CO)NH
[ редактировать ]Этот эксперимент коррелирует амидный резонанс с Hα и Hβ предыдущего остатка. [15]
Последовательное присвоение
[ редактировать ]Для последовательного назначения обычно используются пары экспериментов, например, пара HNCACB и CBCA(CO)NH или HNCA и HNC(CO)CA. Спектры обычно анализируются как полосы пиков, а полосы из пары экспериментов могут быть представлены вместе рядом или как наложение двух спектров. В спектрах HNCACB в каждой полоске обычно присутствуют 4 пика: Cα и Cβ одного остатка, а также пики предшествующего ему остатка. Пики предыдущего остатка можно идентифицировать в эксперименте CBCA(CO)NH. Таким образом, каждая полоска пиков может быть связана со следующей полоской пиков соседнего остатка, что позволяет соединять полоски последовательно. Тип остатка можно определить по химическим сдвигам пиков; некоторые из них, например серин, треонин, глицин и аланин, идентифицировать гораздо легче, чем другие. Затем резонансы можно определить путем сравнения последовательности пиков с аминокислотной последовательностью белка.
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Икура М; Кей Л.Е.; Бакс А (1990). «Новый подход к последовательному назначению 1 ЧАС, 13 С и 15 N-спектры белков: гетероядерная трехрезонансная трехмерная ЯМР-спектроскопия. Применение к кальмодулину». Биохимия . 29 (19): 4659–67. doi : 10.1021/bi00471a022 . PMID 2372549 .
- ^ Перейти обратно: а б с Льюис Э. Кей; Мицухико Икура; Рольф Чудин, Ad Bax (1990). «Трехмерная тройная резонансная ЯМР-спектроскопия изотопно-обогащенных белков». Журнал магнитного резонанса . 89 (3): 496–514. Бибкод : 1990JMagR..89..496K . дои : 10.1016/0022-2364(90)90333-5 .
- ^ Перейти обратно: а б Ад Бакс (2011). «Тройной резонанс трехмерного ЯМР белков: до того, как он стал черным ящиком» . Журнал магнитного резонанса . 213 (2): 442–5. Бибкод : 2011JMagR.213..442B . дои : 10.1016/j.jmr.2011.08.003 . ПМЦ 3235243 . ПМИД 21885307 .
- ^ Перейти обратно: а б Юнчао Су; Лорен Андреас и Роберт Г. Гриффин (2015). «ЯМР белков с вращением под магическим углом: высокочастотная динамическая ядерная поляризация и обнаружение 1H». Ежегодный обзор биохимии . 84 : 485–497. doi : 10.1146/annurev-biochem-060614-034206 . ПМИД 25839340 . – через Ежегодные обзоры (требуется подписка)
- ^ Курт Вютрих (2001). «Путь к ЯМР-структурам белков». Структурная биология природы . 8 (11): 923–925. дои : 10.1038/nsb1101-923 . ПМИД 11685234 . S2CID 26153265 .
- ^ Габриэле Варани; Фарид Абул-Эла; Фредерик Аллен и Чарльз К. Габсер (1995). «Роман трехмерный 1 час − 13 С- 31 Эксперименты с тройным P-резонансом для последовательных корреляций основной цепи нуклеиновых кислот». Journal of Biomolecular NMR . 5 (3): 315–320. : 10.1007 /BF00211759 . PMID 7540446. . S2CID 31239207 doi
- ^ Майкл Зальцманн; Герхард Видер; Константин Первушин; Ханс Сенн и Курт Вутрих (1999). «Эксперименты с тройным резонансом типа TROSY для последовательного определения больших белков ЯМР» (PDF) . Журнал Американского химического общества . 121 (4): 844–848. дои : 10.1021/ja9834226 .
{{cite journal}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Барбе-Массин; и др. (2014). «Быстрое определение протонами ЯМР для белков с вращением под быстрым магическим углом» . Журнал Американского химического общества . 136 (35): 12489–12497. дои : 10.1021/ja507382j . ПМК 4156866 . ПМИД 25102442 .
- ^ Роберт Т. Клубб; V Танабал; Герхард Вагнер (1992). «Схема трехмерного тройного резонансного импульса с постоянным временем для корреляции внутриостаточных 1 ЧАС Н , 15 Н и 13 Химические сдвиги C' в 15 Н/ 13 Белки, меченные C». Journal of Magnetic Resonance . 97 (1): 213–217. Bibcode : 1992JMagR..97..213C . doi : 10.1016/0022-2364(92)90252-3 . hdl : 2027.42/30326 .
- ^ Ад Бакс и Мицухико Икура (1991). «Эффективный метод 3D ЯМР для корреляции протона и 15 Амид N-остова резонансирует с α-углеродом предыдущего остатка в однородном 15 Н/ 13 Белки, обогащенные C». Журнал биомолекулярного ЯМР . 1 (1): 99–104. : 10.1007 /BF01874573 . PMID 1668719. . S2CID 20037190 doi
- ^ Стефан Гжесик, Ad Bax (1992). «Корреляция резонансов основной цепи амида и боковой цепи в более крупных белках с помощью множественного ретранслируемого тройного резонанса ЯМР». Журнал Американского химического общества . 114 (16): 6291–6293. дои : 10.1021/ja00042a003 .
- ^ Стефан Гжесик, Ad Bax (1992). «Эффективный эксперимент по последовательному распределению основной цепи изотопно-обогащенных белков среднего размера» . Журнал магнитного резонанса . 99 (1): 201–207. Бибкод : 1992JMagR..99..201G . дои : 10.1016/0022-2364(92)90169-8 .
- ^ Кей, Льюис Э. (1993). «Трёхмерный ЯМР-эксперимент с усилением градиента импульсного поля для корреляции 13 ч/б, 13 С', и 1 Химические сдвиги Hα в белках, равномерно меченных углеродом-13, растворенных в воде». Журнал Американского химического общества . 115 (5): 2055–2058. doi : 10.1021/ja00058a072 .
- ^ С. Гжешек; Дж. Англистер; А. Бакс (1993). «Корреляция резонансов основной цепи амида и алифатических боковых цепей в 13 С/ 15 N-обогащенные белки путем изотропного смешивания 13 Намагничивание C» . Журнал Магнитного Резонанса, Серия B. 101 ( 1): 114–119. Bibcode : 1993JMRB..101..114G . doi : 10.1006/jmrb.1993.1019 .
- ^ Стефан Гжесик и Ад Бакс (1993). «Определение типа аминокислот в процедуре последовательного отнесения равномерно 13 С/ 15 N-обогащенные белки». Journal of Biomolecular NMR . 3 (2): 185–204. : 10.1007 /BF00178261 . PMID 8477186. . S2CID 1324255 doi