Эми Розенцвейг
Профессор Эми С. Розенцвейг | |
|---|---|
| Рожденный | 6 января [1] 1967 (56–57 лет) Питтсбург, Пенсильвания |
| Национальность | Американский |
| Альма-матер | Амхерстский колледж (бакалавр) (1988) Массачусетский технологический институт (доктор философии) (1994 г.) |
| Награды | Стипендия Макартура |
| Научная карьера | |
| Поля | Биохимия и химия |
| Диссертация | Структурные исследования гидроксилазного компонента метанмонооксигеназы methyloccus capsulatus (1994). |
| Докторантура | Стивен Дж. Липпард |
| Веб-сайт | группы |
Эми Розенцвейг — профессор химии и молекулярной биологии в Северо-Западном университете . [2] Она родилась в 1967 году в Питтсбурге, штат Пенсильвания. В настоящее время ее научные интересы включают структурную биологию и бионеорганическую химию , поглощение и транспорт металлов, активацию кислорода металлоферментами и характеристику мембранных белков . За свою работу она была отмечена рядом национальных и международных наград, в том числе Премией Макартура «Гений» в 2003 году.
Образование и обучение [ править ]
Она получила степень бакалавра химии в Амхерстском колледже в 1988 году и докторскую степень. из Массачусетского технологического института в 1994 году. В Массачусетском технологическом институте Розенцвейг работала под руководством Стивена Дж. Липпарда , где она стала пионером структурных исследований гидроксилазного компонента метанмонооксигеназы из methyloccous capsulatus .
метана Биологическое окисление
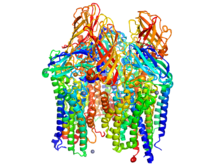
Розенцвейг определил молекулярную структуру основных природных катализаторов окисления метана . Метанмонооксигеназы ( ММО ) — металлоферменты, обнаруженные в семействе метанотрофных бактерий . Эти ферменты относятся к классу оксидоредуктаз . Они активируют связи углерод-водород, чтобы избирательно прикрепить кислород к своему субстрату. Существуют два основных вида ММО: растворимые ММО (sMMO) и дисперсные MMO (pMMO). Несмотря на то, что они осуществляют одну и ту же химическую реакцию, структура и механизм этих двух ферментов существенно различаются.
С начала 1990-х годов Розенцвейг изучал ферменты ММО в различных биологических системах. Ее команда первой расшифровала кристаллическую структуру и химического состава фермента частиц ММО в 1993 году. В последующие годы она добилась значительных успехов в определении биологической активности , включая огромный вклад в исследования металл-координированного активного центра . [3] [4]
Предлагаемый в настоящее время механизм sMMO включает в себя железа (II) координационный комплекс , который дважды окисляется с образованием металлопероксидов . Затем этот вид подвергается восстановлению в присутствии метана- субстрата с образованием окисленного алкилметанола . Определена кристаллическая структура белково-белкового комплекса sMMO. [4] [5]

В настоящее время остается загадкой прямое понимание взаимодействия пММО-субстрат, особенно в диагностике сложного механизма. По мнению Розенцвейга, эта неуловимая проблема остается «одной из главных нерешенных проблем бионеорганической химии». [2]
Металлический транспорт [ править ]
В своей работе с pMMO Розенцвейг выяснила молекулярную основу безопасного обращения с потенциально токсичными ионами металлов посредством прямой передачи данных между белками-партнерами. Метанотрофы секретируют метанобактин . Метанобактин хелатируется с высоким сродством к меди и образует комплекс (CuMbn), который может реинтернализоваться клеткой посредством активного транспорта. Между CuMbn и белками MbnT и MbnE существуют специфические взаимодействия. Эти данные раскрывают механизмы распознавания и транспорта CuMbn. [3]
функция Металлопротеиновая
Розенцвейг определил структуры важных металлопротеинов, оказавших устойчивое влияние на область бионеорганической химии. Конкретными белками, структуру которых она определила, являются E. coli Mn (II) 2-NrdF и Fe (II) 2-NrdF, которые имеют разные координационные сайты. Это предполагает наличие различных начальных сайтов связывания оксидантов во время активации кофактора с помощью E. coli и нуклеотидов. [6]
Награды [ править ]
- Лауреат премии Альфреда Бадера в области биоинорганической или биоорганической химии Американского химического общества , 2021 г. [7]
- Избранный член Национальной академии наук , 2017 г. [8]
- Избранный член Американской академии искусств и наук , 2014 г. [9]
- Королевского химического общества Джозефа Чатта, 2014 г. Премия [10]
- Премия Ивано Бертини, 2014 г. [11]
- Американского химического общества за высшее образование, 2006 г. Подпись лауреата Нобелевской премии [12]
- Почетная степень, доктор наук, Амхерстский колледж , 2005 г. [13]
- Товарищ Макартура, 2003 г. [2]
Работает [ править ]
- Либерман Р.Л. и Розенцвейг А.К. «Кристаллическая структура мембраносвязанного металлофермента, который катализирует биологическое окисление метана», Nature 2005, 434, 177-182.
- Либерман, Р.Л., Кондапалли, К.К., Шреста, Д.Б., Хакемиан, А.С., Смит, С.М., Тельсер, Дж., Кузелка, Дж., Гупта, Р., Боровик, А.С., Липпард, С.Дж., Хоффман, Б.М., Розенцвейг, А.С. и Стеммлер, Т.Л. «Характеристика металлоцентров метанмонооксигеназы в виде частиц в множественных окислительно-восстановительных состояниях с помощью рентгеновской абсорбционной спектроскопии». Неорг. хим. 2006, 45, 8372-8381.
- Сазинский М.Х., Мандал А.Л., Аргуэлло Дж.М. и Розенцвейг А.К. «Структура АТФ-связывающего домена Cu1+-АТФазы Archaeglobus fulgidus». Ж. Биол. хим. . 2006, 281, 11161-11166.
- Яцуник, Л.А. и Розенцвейг, AC «Связывание и перенос меди с помощью N-конца белка болезни Вильсона», J. Biol. хим. . 2007, 282, 8622-8631.
- Розенцвейг, Липпард, «Структура и биохимия ферментных систем метанмонооксигеназы» , Переходные металлы в микробном метаболизме , редакторы Гюнтер Винкельманн, Карл Дж. Каррано, CRC Press, 1997, ISBN 978-90-5702-220-3
- Розенцвейг, Фенг, Липпард, «Исследование модельных комплексов метамонооксигеназы и окисления алканов» , Применение ферментной биотехнологии , редакторы Джеффри В. Келли, Томас О. Болдуин, Springer, 1991, ISBN 978-0-306-44095-3
Ссылки [ править ]
- ^ «Добро пожаловать в группу Розенцвейг!» .
- ^ Jump up to: Перейти обратно: а б с «Добро пожаловать в группу Розенцвейг!» . groups.molbiosci.northwestern.edu . Проверено 8 июня 2017 г.
- ^ Jump up to: Перейти обратно: а б Сираджуддин, Сара; Розенцвейг, Эми К. (14 апреля 2015 г.). «Ферментативное окисление метана» . Биохимия . 54 (14): 2283–2294. doi : 10.1021/acs.biochem.5b00198 . ISSN 0006-2960 . ПМЦ 5257249 . ПМИД 25806595 .
- ^ Jump up to: Перейти обратно: а б Розенцвейг, Эми К.; Фредерик, Кристин А.; Липпард, Стивен Дж.; П& Аумл; Нордлунд, Р. (9 декабря 1993 г.). «Кристаллическая структура бактериальной негемовой гидроксилазы железа, которая катализирует биологическое окисление метана». Природа . 366 (6455): 537–543. Бибкод : 1993Natur.366..537R . дои : 10.1038/366537a0 . ПМИД 8255292 . S2CID 4237249 .
- ^ Лоутон, Томас Дж; Розенцвейг, Эми С. (01 декабря 2016 г.). «Биокатализаторы для конверсии метана: большой прогресс в разрушении небольшого субстрата» . Современное мнение в области химической биологии . Энергетическая механистическая биология. 35 : 142–149. дои : 10.1016/j.cbpa.2016.10.001 . ПМК 5161620 . ПМИД 27768948 .
- ^ Боал, Эми К.; Котруво, Джозеф А.; Стуббе, Джоанн; Розенцвейг, Эми К. (17 сентября 2010 г.). «Структурная основа активации рибонуклеотидредуктазы класса Ib» . Наука . 329 (5998): 1526–1530. Бибкод : 2010Sci...329.1526B . дои : 10.1126/science.1190187 . ISSN 0036-8075 . ПМК 3020666 . ПМИД 20688982 .
- ^ «Премия Альфреда Бадера в области биоинорганической или биоорганической химии» .
- ^ «Эми Розенцвейг» . Национальная академия наук . Проверено 22 марта 2018 г.
- ^ «Индекс активных участников» (PDF) .
- ^ «Победитель премии Джозефа Чатта 2014» . www.rsc.org . Проверено 5 апреля 2018 г.
- ^ «Резюме Эми К. Розенцвейг» (PDF) . Октябрь 2017.
- ^ «Подпись Нобелевского лауреата за высшее образование в области химии — Американское химическое общество» . Американское химическое общество . Проверено 22 марта 2018 г.
- ^ «Почетные степени и награды | Получатели по именам | Амхерстский колледж» . www.amherst.edu . Архивировано из оригинала 10 сентября 2017 г. Проверено 23 марта 2018 г.
Внешние ссылки [ править ]
- «Эми Розенцвейг». Архивировано 17 марта 2009 г. в Wayback Machine , факультет 1000.
- Американские женщины-биохимики
- Факультет Северо-Западного университета
- Выпускники Амхерстского колледжа
- Выпускники Школы наук Массачусетского технологического института
- Живые люди
- 1967 года рождения
- Макартур Феллоуз
- Выпускники школы Эллиса
- Американские женщины-ученые
- Американские женщины 21 века
- Химики из Пенсильвании
- Ученые из Питтсбурга