Гистоноподобный белок, структурирующий нуклеоид
| Х-НС | |||
|---|---|---|---|
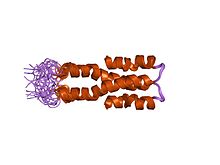 Структура раствора N-концевого домена (домена олигомеризации) бактериального нуклеоидного структурирующего белка H-NS. | |||
| Идентификаторы | |||
| Символ | Х-НС | ||
| Пфам | PF00816 | ||
| ИнтерПро | ИПР001801 | ||
| КАТ | [ P0ACF8] | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1час / СКОПе / СУПФАМ | ||
| |||
Гистоноподобный белок, структурирующий нуклеоид (H-NS), является одним из двенадцати нуклеоид-ассоциированных белков (NAP). [ 1 ] основная функция которого — организация генетического материала , включая регуляцию экспрессии генов посредством ксеногенного молчания. [ 2 ] H-NS характеризуется N-концевым доменом (NTD), состоящим из двух сайтов димеризации , неструктурированной линкерной области и C-концевого домена (CTD), отвечающего за связывание ДНК. [ 2 ] Хотя это небольшой белок (15 кДа), [ 3 ] он обеспечивает существенное уплотнение нуклеоидов и регуляцию генов (в основном замалчивание) [ 2 ] и высоко выражен, функционируя как димер или мультимер . [ 3 ] Изменение температуры приводит к диссоциации H-NS от дуплекса ДНК , обеспечивая транскрипцию с помощью РНК-полимеразы, и в определенных областях приводит к патогенным каскадам в энтеробактериях, таких как Escherichia coli и четыре вида Shigella . [ 3 ]

Структура
[ редактировать ]H-NS имеет специфическую топологию, которая позволяет ему конденсировать бактериальную ДНК в суперспиральную структуру, о чем свидетельствуют данные рентгеновской кристаллографии . [ 2 ] Конденсированная суперспиральная структура участвует H-NS в репрессии генов, вызванной образованием олигомеров. Эти олигомеры образуются за счет димеризации двух сайтов в N-концевом домене H-NS. [ 2 ] Например, у таких видов бактерий, как Salmonella typhimurium , NTD H-NS содержит сайты димеризации в спиралях альфа 1, альфа 2 и альфа 3. Альфа-спирали 3 и 4 затем отвечают за создание суперспиральной структуры взаимодействий H-NS-ДНК. по ассоциации между головами ( рис. 2 ). [ 2 ] [ 5 ] H-NS также содержит неструктурированную линкерную область, также известную как Q-линкер. [ 2 ] С-концевой домен, также известный как ДНК-связывающий домен (DBD), демонстрирует высокое сродство к областям ДНК, которые богаты аденином и тимином и присутствуют в виде крючкообразного мотива в малой бороздке. [ 2 ] Укладка оснований, присутствующая в этой богатой АТ области ДНК, позволяет незначительно расширить малую бороздку, которая является предпочтительной для связывания. [ 2 ] Обычные DBD включают области AACTA и TACTA, которые могут встречаться сотни раз по всему геному. [ 2 ] В этих богатых АТ регионах малая бороздка имеет ширину 3,5 Å. [ 3 ] что является предпочтительным для связывания H-NS. У E. coli было обнаружено, что H-NS реструктурирует геном на микродомены in vivo . [ 2 ] Хотя бактериальный геном разделен на четыре различных макродомена, включая Ori и Ter (макродомен E. coli и видов Shigella , в которых кодируется H-NS), [ 3 ] считается, что H-NS играет роль в формировании этих небольших микродоменов размером 10 т.п.н. по всему геному. [ 2 ]

Функция
[ редактировать ]Основная функция H-NS — влияние на топологию ДНК ( рис. 2 ). H-NS отвечает за образование нуклеофиламентов вдоль ДНК и мостиков ДНК-ДНК. H-NS известен как пассивный мостик ДНК, что означает, что он связывает два удаленных сегмента ДНК и остается неподвижным, образуя петлю. Образование петли ДНК позволяет H-NS контролировать экспрессию генов. [ 2 ] Ослабление подавления H-NS может быть достигнуто за счет связывания другого белка или за счет изменений топологии ДНК, которые могут произойти из-за изменений температуры и осмолярности . , например, [ 6 ] CTD связывается с бактериальной ДНК таким образом, что ингибирует функцию РНК-полимеразы. Это общая особенность, наблюдаемая в генах, приобретенных горизонтально. [ 7 ] В структурных исследованиях H-NS используются такие виды бактерий, как E. coli и Shigella spp. потому что C-концевой домен полностью консервативен. [ 3 ]
Процесс образования комплексов H-NS-ДНК начинается со связывания CTD с предпочтительным участком генома. Это может быть результатом большого количества положительно заряженных аминокислотных остатков, расположенных внутри линкерной области, что заставляет CTD искать сайт связывания с высоким сродством. [ 2 ] Как только CTD связывается со своей предпочтительной областью, стадией TpA, NTD могут олигомеризоваться и образовывать жесткие нуклеофиламенты, которые при наличии благоприятных условий будут более свободно связываться друг с другом с образованием ДНК-мостиков. Эта форма мостика известна как «пассивный мостик» и может не позволить RNAP продолжить транскрипцию. [ 2 ] Эксперименты, используемые для подтверждения этого метода связывания ДНК и подавления генов, основаны на атомно-силовой микроскопии и исследованиях одиночных молекул in vitro . [ 2 ]
Чтобы выжить, все бактерии должны быть чувствительны к изменениям в их физической среде. Эти механизмы позволяют включать или выключать гены в зависимости от их внеклеточной среды. [ 3 ] Многие исследователи полагают, что H-NS способствует этим сенсорным функциям. Было замечено, что H-NS контролирует около 60% генов, регулируемых температурой, и может диссоциировать от дуплекса ДНК при 37 ° C. [ 2 ] Эта особая чувствительность, наблюдаемая при H-NS, позволяет выявить патогенез и является основным направлением исследований. Вне хозяина температура 32 °C предотвращает диссоциацию H-NS от плазмиды вирулентности у Shigella spp. с целью сохранения энергии для энергетически затратного производства белков, участвующих в патогенезе. [ 8 ] Наличие ионов магния (Mg 2+ ), как было показано, позволяет H-NS формировать конформационные изменения в структуре от слегка открытой до полностью открытой, которые в конечном итоге изменят взаимодействие между отрицательно заряженным NTD и положительно заряженным CTD. [ 2 ] Концентрации магния ниже 2 мМ способствуют образованию жестких нуклеопротеиновых нитей, а высокие концентрации способствуют образованию мостиков ДНК H-NS. [ 9 ] Заряды, наблюдаемые в NTD и CTD, могут объяснить, почему H-NS остается чувствительным к изменениям температуры и осмолярности (pH ниже 7,4). [ 3 ] H-NS также может взаимодействовать с другими белками и влиять на их функцию, например, он может взаимодействовать с моторным белком жгутика FliG, повышая его активность. [ 6 ]
Клиническое значение
[ редактировать ]
H-NS играет консервативную роль в патогенности грамотрицательных бактерий, включая виды Shigella , Escherichia coli , Salmonella spp. и многие другие. Он участвует в транскрипции гена virF , вызывающего так называемую virF, приводящую к бактериальной дизентерии — заболеванию, поражающему детей, которое в основном наблюдается в развивающихся странах. Эти два вида бактерий содержат плазмиду вирулентности , которая отвечает за инвазию в клетки-хозяева и регулируется H-NS. [ 10 ] Интересно, что почти 70% открытых рамок считывания (ОРС) специализированной плазмиды вирулентности у Shigella spp. богат АТ, что позволяет осуществлять долгосрочную регуляцию этой плазмиды с помощью H-NS. [ 3 ]
Вышеупомянутые исследования показывают, что чувствительный к температуре H-NS будет диссоциировать от бактериальной ДНК при 37 ° C, запуская РНК-полимеразу для транскрипции virF , гена, ответственного за экспрессию VirF. VirF является основным регулятором каскада вирулентности и экспрессируется благодаря термочувствительной «шарнирной» области промотора virF, меняющей конформацию так, что она больше не является благоприятной для образования мостиков ДНК с помощью H-NS ( рис. 3 ). [ 3 ] Как только VirF экспрессируется, он регулирует выработку icsA , способствующего подвижности, а virB кодирует следующий регуляторный белок в каскаде шигелл . Как только VirB экспрессируется, он разрушает H-NS для остальной части плазмиды вирулентности. [ 3 ]
Шигеллы виды. содержат «молекулярные резервные копии» или паралоги H-NS, которые были подробно изучены из-за их очевидной помощи в организации плазмиды вирулентности. [ 3 ] StpA является паралогом H-NS, который консервативен у всех видов, но другой, Sfh, экспрессируется исключительно в мутантном штамме S. flexneri 2457T. [ 3 ] Этот мутантный штамм представляет большой интерес для исследователей, поскольку он действует как замена H-NS, поскольку 2457T не содержит гена hns . Корреляция между H-NS и его паралогами в настоящее время плохо изучена. [ 3 ] Из-за важности этих паралогов в отсутствие H-NS у мутанта дальнейшие исследования и сосредоточение внимания на этих паралогах могут привести к многообещающим антибактериальным методам лечения. [ 3 ]
Ссылки
[ редактировать ]- ^ Винарди Р.С., Ян Дж., Кенни Л.Дж. (октябрь 2015 г.). «H-NS регулирует экспрессию генов и уплотняет нуклеоид: результаты экспериментов с одиночными молекулами» . Биофизический журнал . 109 (7): 1321–1329. Бибкод : 2015BpJ...109.1321W . дои : 10.1016/j.bpj.2015.08.016 . ПМК 4601063 . ПМИД 26445432 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т Цинь Л., Эркеленс А.М., Бен Бдира Ф., Даме RT (декабрь 2019 г.). «Архитекторы бактериальных ДНК-мостов: структурно и функционально консервативное семейство белков» . Открытая биология . 9 (12): 190223. doi : 10.1098/rsob.190223 . ПМК 6936261 . ПМИД 31795918 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п Пикер М.А., Wing HJ (декабрь 2016 г.). «H-NS, члены его семейства и их регуляция генов вирулентности у видов шигелл» . Гены . 7 (12): 112. doi : 10.3390/genes7120112 . ПМК 5192488 . ПМИД 27916940 .
- ^ Шиндо Х., Иваки Т., Иеда Р., Курумизака Х., Уэгучи С., Мизуно Т. и др. (февраль 1995 г.). «Структура раствора ДНК-связывающего домена нуклеоид-ассоциированного белка H-NS из Escherichia coli» . Письма ФЭБС . 360 (2): 125–131. дои : 10.1016/0014-5793(95)00079-о . ПМИД 7875316 . S2CID 44479751 .
- ^ Блох В., Ян Й., Марж Э., Шаванье А., Оже М.Т., Роберт Б. и др. (март 2003 г.). «Домен димеризации H-NS определяет новую складку, способствующую распознаванию ДНК». Структурная биология природы . 10 (3): 212–218. дои : 10.1038/nsb904 . ПМИД 12592399 . S2CID 25761309 .
- ^ Jump up to: а б Донато GM, Кавула TH (сентябрь 1998 г.). «Усиленное связывание измененного белка H-NS с белком жгутикового ротора FliG вызывает увеличение скорости вращения жгутика и гиперподвижность у Escherichia coli» . Журнал биологической химии . 273 (37): 24030–24036. дои : 10.1074/jbc.273.37.24030 . ПМИД 9727020 .
- ^ Луккини С., Роули Дж., Голдберг, доктор медицинских наук, Херд Д., Харрисон М., Хинтон Дж.С. (август 2006 г.). «H-NS опосредует подавление латерально приобретенных генов у бактерий» . ПЛОС Патогены . 2 (8): е81. дои : 10.1371/journal.ppat.0020081 . ПМК 1550270 . ПМИД 16933988 .
- ^ Дорман CJ (сентябрь 2014 г.). «H-NS-подобные нуклеоид-ассоциированные белки, мобильные генетические элементы и горизонтальный перенос генов у бактерий» . Плазмида . 75 : 1–11. doi : 10.1016/j.plasmid.2014.06.004 . ПМИД 24998344 .
- ^ Верма С.К., Цянь З., Адхья С.Л. (декабрь 2019 г.). «Архитектура нуклеоида Escherichia coli» . ПЛОС Генетика . 15 (12): e1008456. дои : 10.1371/journal.pgen.1008456 . ПМК 6907758 . ПМИД 31830036 .
- ^ Пикер М.А., Wing HJ (декабрь 2016 г.). «H-NS, члены его семейства и их регуляция генов вирулентности у видов шигелл» . Гены . 7 (12): Е112. дои : 10.3390/genes7120112 . ПМК 5192488 . ПМИД 27916940 .