Управление по защите человеческих исследований
| Обзор агентства | |
|---|---|
| Сформированный | Июнь 2000 г. [1] |
| Предыдущий |
|
| Штаб-квартира | 1101 Wootton Parkway, Suite 200 Rockville, MD 20852 [1] |
| Головной отдел | Министерство здравоохранения и социальных служб США [1] |
| Веб-сайт | https://www.hhs.gov/ohrp/ |
Управление по защите исследований человека (OHRP) — это небольшой офис Министерства здравоохранения и социальных служб США (DHHS), в частности Офис помощника министра здравоохранения в Канцелярии секретаря DHHS, который занимается вопросами этического надзора. в клинических исследованиях, проводимых кафедрой, в основном через Национальные институты здравоохранения (NIH). [2]
Основной обязанностью офиса является внедрение 45 CFR 46 , набора правил для институциональных наблюдательных советов (IRB), который отражает постановление Управления по контролю за продуктами и лекарствами США (FDA), которое охватывает клинические исследования, проводимые фармацевтическими компаниями , а также другие правила в соответствии с руководство Федеральной политикой защиты людей, которая также известна как « Общее правило ». [3]
Учреждения, которые проводят исследования, спонсируемые DHHS, должны иметь «Федеральную гарантию» (FWA), соглашение с OHRP относительно этического надзора. OHRP также обеспечивает обучение IRB, дает рекомендации по исследовательской этике и консультирует секретаря HHS по вопросам медицинской этики . [2]
История
[ редактировать ]Эксперименты на людях до OHRP
[ редактировать ]Неэтичные эксперименты над людьми в Соединенных Штатах практиковались в Соединенных Штатах задолго до создания OHRP. [ нужна ссылка ] Основной характеристикой экспериментов, проводившихся в то время, было игнорирование страданий, причиняемых пациентам. В 1840-х годах Дж. Мэрион Симс провела сотни хирургических операций на порабощенных африканских женщинах без использования анестезии. [4] Роберт Бартолоу применял электрический ток к обнаженному мозговому веществу пациентов. Один вопиющий пример произошел в 1874 году, когда женщина пришла на лечение от раковой язвы на черепе, образовавшей 2-дюймовое отверстие. Бартолоу вставил ей в мозг электроды, чем причинил ей сильное беспокойство. Женщина впала в кому и умерла через 4 дня. [5] Еще одной темой экспериментов на людях в 19 и начале 20 века было несправедливое обращение с пациентами из числа этнических меньшинств. На рубеже 20-го века врачи армии США заразили 34 филиппинских заключенных бубонной чумой и бери-бери. [6] Между 1932 и 1972 годами в ходе эксперимента по сифилису Таскиги наблюдалось естественное прогрессирование сифилиса у 600 афроамериканских мужчин (399 из которых были больны сифилисом, а 201 человек из контрольной группы не болел сифилисом). В обмен на участие мужчинам обещали бесплатные медицинские осмотры, горячее питание и фонд для захоронения. Мужчинам никогда не говорили, что у них сифилис, и им не оказывали лечения, когда пенициллин стал доступен в качестве эффективного лекарства в 1947 году. К концу исследования в 1972 году только 74 испытуемых были живы. Из первоначальных 399 мужчин, больных сифилисом, 28 умерли от этой болезни, 100 умерли от осложнений, связанных с сифилисом. Кроме того, 40 жен были инфицированы и 19 детей родились с врожденным сифилисом. Распространенное заблуждение об эксперименте с сифилисом Таскиги заключается в том, что испытуемым вводили сифилис. [7]

Известные организации по этике предварительных исследований
[ редактировать ]До основания OHRP в Соединенных Штатах было несколько предшественников, целью которых было обеспечение этики экспериментов на людях. Многие из них представляли собой временные комитеты, просуществовавшие не более года или двух, например Консультативный комитет по экспериментам с облучением человека и Консультативный совет по этике. [8] Одной из первых и давних групп, занимающихся безопасностью экспериментальных субъектов, была Американская психологическая ассоциация (АПА), которая впервые опубликовала свои «Этические стандарты психологов» в 1953 году. [9] С тех пор APA опубликовала множество версий своего Кодекса этики и в настоящее время действует в соответствии с кодексом, принятым в 2002 году. [9] Затем Закон о национальных исследованиях учредил Национальную комиссию по защите людей, участвовавших в биомедицинских и поведенческих исследованиях , которая стала первой национальной комиссией, все внимание которой было сосредоточено на защите экспериментальных объектов. [10] [11] В 1978 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов добавило свои первые правила, защищающие участников исследований на людях, которые были пересмотрены в 1981 году. [12] Национальная консультативная комиссия по биоэтике была создана президентом Биллом Клинтоном в октябре 1995 года и прекратила свое существование в октябре 2001 года. [10]

Основание
[ редактировать ]13 июня 2000 года министр здравоохранения и социальных служб США Донна Шалала создала OHRP как компонент Управления общественного здравоохранения и науки , основной функцией которого является надзор за исследованиями, проводимыми на людях, и обеспечение их соответствия требованиям. в соответствии с правилами, установленными Министерством здравоохранения и социальных служб США . [13] OHRP заменил Управление по защите от исследовательских рисков, а Грег Коски был назначен первым директором. [14] Директор OHRP должен был подчиняться помощнику министра здравоохранения США при Министерстве здравоохранения и социальных служб (тогда Дэвиду Сэтчеру ).
Участие в деле
[ редактировать ]С момента своего основания OHRP вмешивался в несколько дел, связанных с исследовательскими экспериментами на людях, в которых были допущены нарушения здоровья и прав участников, а также правила, установленные для исследований на людях. В 2001 году OHRP временно приостановил действие исследовательской лицензии Университета Джонса Хопкинса и связанных с ним исследовательских центров после смерти участника эксперимента по вдыханию гексаметония. [15] Было обнаружено, что эксперимент нарушает правила, поскольку исследователи не смогли проинформировать участников о возможных опасностях гексаметония , а также получить необходимую информацию о влиянии гексаметония до эксперимента. [15] В другом случае, произошедшем в 2013 году, OHRP оспорил практику рандомизированного исследования поверхностно-активных веществ, положительного давления и оксигенации (SUPPORT), исследовательского проекта, в котором 1300 недоношенных детей использовались в качестве испытуемых для проверки оптимальных уровней оксигенации, которые будут использоваться. для надлежащего ухода за недоношенными детьми в больницах. [16] Было установлено, что этот эксперимент нарушает федеральные правила, поскольку родители этих младенцев не были проинформированы о возможных последствиях эксперимента для их ребенка, включая слепоту или смерть, и поэтому не смогли дать информированное согласие . [16]
Организационная структура
[ редактировать ]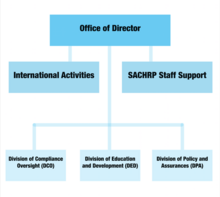
Офис директора
[ редактировать ]Являясь лидером DHHS, канцелярия директора курирует все функции OHRP и тесно сотрудничает с должностными лицами DHHS, включая министра здравоохранения и социальных служб и помощника министра здравоохранения, чтобы обеспечить соответствие политики, планов и процедур исследований на людях. этические нормы. В состав комитетов, входящих в состав канцелярии директора, входят комитеты по международной деятельности и Консультативный комитет секретаря по защите исследований человека (SACHRP).
Консультативный комитет секретаря по защите исследований человека (SACHRP)
[ редактировать ]Комитет в составе аппарата директора, SACHRP, состоит в основном из исследователей и юристов, которые помогают министру здравоохранения и социальных служб своими экспертными советами. Помощник министра здравоохранения выступает в качестве посредника, представляя рекомендации комитета секретарю на рассмотрение. Кроме того, SACHRP также проводит три ежегодных собрания, которые открыты для общественности и вопросов.
Международная деятельность
[ редактировать ]Этот комитет работает над совершенствованием этической политики и процедур, защищающих субъектов исследований на людях по всему миру. Эти глобальные усилия гарантируют, что людям, которые участвуют в любых исследованиях, финансируемых и/или проводимых DHHS, предоставляется защита, равная тем, кто участвует в Соединенных Штатах.
Отдел комплаенс-надзора
[ редактировать ]Отдел надзора за соблюдением требований отвечает за оценку отчетов о существенных несоответствиях на основании здравоохранения и социального обеспечения (HHS) правил . На основании письменных отчетов о расследованиях офис определяет, потребуются ли регулирующие меры для защиты людей, участвовавших в исследованиях. Оценки надзора проводятся как по причине соблюдения, так и по не причине.
Отдел образования и развития (DED)
[ редактировать ]DED отвечает за большую часть рекламы OHRP. В его задачи входит проведение мероприятий, консультирование исследователей, участвующих в связанных экспериментах, и распространение образовательных материалов о защите объектов исследований на людях. Образовательные материалы также представлены онлайн на официальном сайте OHRP.
Отдел политики и гарантий
[ редактировать ]Отдел политики и гарантий готовит политику, руководящие принципы и требования по защите людей и предоставляет информацию исследовательскому сообществу. Он также отвечает за управление общефедеральными гарантиями соответствия и регистрацию институциональных наблюдательных советов.
Обязанности
[ редактировать ]Отчет Бельмонта
[ редактировать ]Управление по защите исследований человека придерживается принципов Бельмонтского отчета при выполнении своих обязанностей. Отчет Бельмонта представляет собой набор руководящих принципов, созданных Национальной комиссией по защите людей, являющихся объектами биомедицинских и поведенческих исследований . [17] Отчет Бельмонта, призванный служить этическими параметрами для тех, кто проводит исследования с участием людей, имеет три основных аспекта: границы между практикой и исследованием, основные этические принципы и применение этих принципов. [17]
Существует большая разница между правилами применения утвержденных процедур и исследованиями. Таким образом, в отчете Бельмонта дается определение каждого термина, чтобы помочь определить, что что представляет собой. Практика определяется как установленная методология, предназначенная для улучшения состояния человека с уверенностью в успехе. [17] Исследование определяется как процедура, предназначенная для проверки гипотезы и получения выводов в экспериментальном стиле. [17] OHRP рассматривает только деятельность, отнесенную к категории исследований.
Три основных этических принципа, изложенных в Докладе Бельмонта, — это уважение к личности, благотворительность и справедливость. [17] Уважение к личности предполагает акцент на испытуемых и их автономии, то есть на их способности принимать решения в ходе исследования. Чтобы иметь автономию, субъекты должны дать информированное согласие. Это означает, что они должны быть достаточно зрелыми и психически способными к самоопределению, должны полностью понимать свою роль в процедурах и быть полностью добровольными для участия. [17] Благотворность требует, чтобы исследование имело намерение принести пользу или потенциальную пользу для человека или других людей с аналогичными заболеваниями, которые перевешивают любой риск, который может быть связан с этим. Справедливость определяет необходимость справедливого распределения при выборе предметов, что означает, что предвзятость участников сведена к минимуму. Все участники не могут быть представителями уязвимой или легкодоступной группы населения, не нарушая при этом принцип справедливости. [18]
45 С.Ф.Н. 46
[ редактировать ]Основная политика HHS по защите субъектов исследований на людях
[ редактировать ]Подчасть А, более известная как « Общее правило », 45 CFR 46, представляет собой фундаментальные руководящие принципы этики всех исследований на людях. Любое учреждение, желающее проводить исследования с участием людей, должно предоставить документ, подтверждающий, что оно будет соблюдать эту политику и все соответствующие политики, в федеральный департамент или агентство, имеющее полномочия. Институциональный наблюдательный совет (IRB) должен первоначально рассмотреть и одобрить исследование, а в случае одобрения исследования IRB продолжит его мониторинг. Если на каком-либо этапе исследование не соответствует рекомендациям, одобренным IRB, IRB имеет право приостановить или прекратить исследование. Ответственный департамент или агентство также имеет право приостановить исследование. В ходе исследования IRB должен документировать все встречи и мероприятия.
Руководящие принципы, которым должно следовать научное исследование, прежде чем оно будет одобрено, включают информированное согласие субъектов, минимальный риск для субъектов и отсутствие злоупотреблений в отношении «уязвимых субъектов». [19] Информированное согласие должно включать все аспекты исследования, включая общую предпосылку, риски, преимущества, альтернативные процедуры, конфиденциальность и любые возможные компенсации. Субъект должен официально заявить, что он добровольно решил участвовать в эксперименте при всех обстоятельствах, предусмотренных учреждением. Это информированное согласие документируется IRB и подписывается испытуемым.
Дополнительная защита беременных женщин, человеческих плодов и новорожденных.
[ редактировать ]Министерство здравоохранения и социальных служб США устанавливает необходимые условия для проведения любых исследований на беременных женщинах или плодах. [20]
Для исследований на беременных женщинах и плодах темы состояний включают доклинические исследования риска, минимизацию риска, отсутствие денежных средств (или других льгот) для прерывания беременности, прямую потенциальную пользу для беременных женщин и плода (в противном случае требуются специальные положения о согласии), беременных детей ( требуются специальные положения о согласии), а участники исследования не могут выбирать ни способ прерывания беременности, ни жизнеспособность новорожденного (младенца в возрасте до 4 недель).
Для исследований, посвященных новорожденным, правила различаются в зависимости от того, имеет ли ребенок определенную жизнеспособность, определенную нежизнеспособность или неопределенную жизнеспособность. В случае неопределенной жизнеспособности исследование должно максимизировать вероятность жизнеспособности и соблюдать положения о согласии родителей. У нежизнеспособных новорожденных исследование не может остановить сердцебиение или дыхание, а также искусственно поддержать жизненно важные функции; новорожденному не может быть никакого риска, и требуется согласие родителей. Жизнеспособные новорожденные имеют процедуру согласия.
Существуют также особые условия для исследований послеродовой плаценты, мертвого плода или эмбрионального материала. Для этого необходимы исследования на предмет соответствия федеральным законам, законам штата и местным законам. Кроме того, если лица, участвующие в исследовании, могут быть каким-либо образом идентифицированы, эти лица являются объектами исследования и к ним должны применяться все необходимые юридические требования.
Если исследование не может быть одобрено этими условиями, но имеет большой потенциал для здоровья беременных женщин, плодов или новорожденных, существует специальная процедура, посредством которой Секретарь может одобрить или не одобрить исследование; этот процесс включает консультации с группой экспертов, а также этические кодексы и кодексы согласия.
Дополнительная защита заключенных
[ редактировать ]Руководство по участию заключенных в научных исследованиях обеспечивает защиту заключенных. Важно отметить, что заключенные могут участвовать в биомедицинских или поведенческих исследованиях тогда и только в том случае, если такие исследования специально разрешены. «Заключенный» определяется в правилах HHS в 45 CFR, часть 46.303(c) как «любое лицо, принудительно заключенное или содержащееся под стражей в исправительном учреждении. Этот термин предназначен для обозначения лиц, приговоренных к такому учреждению в соответствии с уголовным или гражданским законодательством, лиц, задержанных в других учреждениях на основании законов или процедур принятия обязательств, которые обеспечивают альтернативу уголовному преследованию или заключению в исправительном учреждении, а также лиц, содержащихся под стражей до предъявления обвинения, суда или вынесения приговора». Это касается и ситуации, когда человек становится заключенным после начала исследования.
В подразделе B указывается, что если это влияет на способность заключенного давать согласие, т.е. решение этого заключенного не является действительно добровольным и непринужденным, то в целях безопасности должны быть предусмотрены дополнительные гарантии. Кроме того, члены IRB должны (1) вообще не иметь никакого отношения к соответствующей тюрьме(ям) и (2) иметь хотя бы одного из них в качестве заключенного. В целом защита заключенных аналогична защите других групп меньшинств, а само исследование должно получить разрешение OHRP. [21]
Дополнительная защита для детей
[ редактировать ]В случае исследований на людях «Дети» — это лица, не достигшие установленного законом возраста для согласия на лечение или процедуры, связанные с исследованием, в соответствии с применимым законодательством юрисдикции, в которой будет проводиться исследование». По большей части меры защиты несовершеннолетних такие же, как и для любого другого человека. Однако подраздел D 45 CFR 46 отмечает несколько различий в отношении получения согласия/согласия и характера исследований с участием детей. Согласно действующим правилам информированного согласия, данного IRB для рассматриваемого исследования, для проведения исследования на несовершеннолетних могут потребоваться как согласие ребенка, так и согласие родителей. В зависимости от правил IRB, если какая-либо из сторон не даст своего согласия, исследование на ребенке не может проводиться.
Как правило, исследования могут проводиться на детях только в том случае, если они не представляют значительного риска для ребенка. Это правило можно обойти, если ребенок хочет получить прямую пользу для своего здоровья, даже если процедура может иметь больший, чем минимальный риск. Даже если прямой пользы для несовершеннолетнего нет, а риск может превышать минимальный, IRB может одобрить исследование, если в результате исследования ребенка могут быть получены обобщенные знания о состоянии субъекта или если знания, касающиеся здоровья детей, могут быть получены. [22]
Регистрация ИРБ
[ редактировать ]Институциональный наблюдательный совет (IRB) — это тип комитета, который рассматривает биоисследования на людях. В соответствии со статьей 45 CFR 46 каждый IRB, назначенный учреждением, должен быть зарегистрирован в Управлении по защите исследований человека (OHRP) Министерства здравоохранения и социальных служб (HHS). При регистрации IRB в OHRP должна быть предоставлена следующая информация: информация об учреждении, включая его название и почтовый адрес, личная информация лица, ответственного за IRB, предполагаемое количество активных протоколов, проведенных IRB. первоначальную проверку или собирается провести проверку, а также количество штатных должностей IRB. Весь процесс регистрации должен осуществляться в электронном виде через официальный сайт OHRP. После регистрации вся предоставленная информация будет проверена OHRP. IRB будет действовать в течение трех лет после официального одобрения и принятия. Информация должна обновляться каждые три года. Кроме того, в случае изменения информации о председателе обновленная информация должна быть представлена в OHRP в течение 90 дней. Если учреждение или организация решит расформировать действующий и функционирующий IRB, отчет должен быть отправлен в OHRP в течение 30 дней. [23]
См. также
[ редактировать ]- Эксперименты на людях в США
- Институциональный наблюдательный совет
- Медицинская этика
- Хельсинкская декларация
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д «История» . Министерство здравоохранения и социальных служб США . Проверено 13 ноября 2016 г. .
- ^ Перейти обратно: а б «Управление по защите человеческих исследований» . Министерство здравоохранения и социальных служб США . Проверено 13 ноября 2016 г. .
- ^ «Организация» . Министерство здравоохранения и социальных служб США . Проверено 13 ноября 2016 г. .
- ^ «Дж. Мэрион Симс, отец гинекологии: герой или злодей?» . Медскейп . Проверено 16 октября 2019 г.
- ^ Эндрю Кинкейд (10 мая 2014 г.). «Роберт Бартолоу и эксперимент Рафферти» . Странно исторический . Проверено 10 ноября 2016 г.
- ^ Перпер, Джошуа А.; Сина, Стивен Дж. (12 августа 2010 г.). Когда убивают врачи: кого, почему и как . Springer Science & Business Media. ISBN 9781441913715 .
- ^ «Исследование сифилиса Таскиги» . www.history.ucsb.edu . Проверено 10 ноября 2016 г.
- ^ «Президентский совет по биоэтике: бывшие комиссии по биоэтике» . bioethicsarchive.georgetown.edu . Проверено 10 ноября 2016 г.
- ^ Перейти обратно: а б «Бюро по этике» . www.apa.org . Проверено 10 ноября 2016 г.
- ^ Перейти обратно: а б «Национальная консультативная комиссия по биоэтике» . bioethicsarchive.georgetown.edu . Проверено 10 ноября 2016 г.
- ^ «Исследование Таскиги – Последствия исследования – CDC – NCHHSTP» . www.cdc.gov . Проверено 10 ноября 2016 г.
- ^ «Клинические испытания и защита человека – Правила» . www.fda.gov . Проверено 10 ноября 2016 г.
- ^ «Федеральный реестр, том 65, выпуск 114 (вторник, 13 июня 2000 г.)» . www.gpo.gov . Проверено 10 ноября 2016 г.
- ^ «06.06.2000: Создано новое Управление по защите исследований человека, директором назначен доктор Грег Коски» . archive.hhs.gov . Проверено 10 ноября 2016 г.
- ^ Перейти обратно: а б «OHRP приостанавливает действие лицензии Johns Hopkins Research на исследования, финансируемые ФРС» . АХРП . 19 июля 2001 г. Проверено 13 ноября 2016 г.
- ^ Перейти обратно: а б Лантос, Джон Д. (13 ноября 2016 г.). «Поддержка недоношенных детей» . Педиатрия . 132 (6): е1661–е1663. дои : 10.1542/пед.2013-1292 . ISSN 0031-4005 . ПМЦ 3838531 . ПМИД 24218459 .
- ^ Перейти обратно: а б с д и ж «Отчет Бельмонта» . HHS.gov . 28 января 2010 г. Проверено 10 ноября 2016 г.
- ^ «Репортаж Бельмонта» . kb.wisc.edu . Проверено 10 ноября 2016 г.
- ^ «45 CFR 46» . HHS.gov . 16 февраля 2016 г. Проверено 10 ноября 2016 г.
- ^ «45 CFR 46» . HHS.gov . 16 февраля 2016 г. Проверено 16 октября 2019 г.
- ^ hhs.gov (25 февраля 2016 г.). «Руководство по участию заключенных в научных исследованиях (2003 г.)» . HHS.gov . Проверено 10 ноября 2016 г.
- ^ «45 CFR 46» . HHS.gov . 16 февраля 2016 г. Проверено 16 октября 2019 г.
- ^ «45 CFR 46.505 — Когда необходимо обновлять или обновлять регистрационную информацию IRB?» . ЛИИ/Институт правовой информации . Проверено 10 ноября 2016 г.
