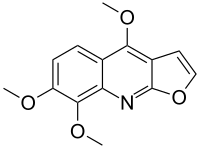
Скиммианин
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
4,7,8-Триметоксифуро[2,3- b ]хинолин | |
| Другие имена
Скиммианин; β-Фагарин; хлороксилонин
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 14 Н 13 Н О 4 | |
| Молярная масса | 259.261 g·mol −1 |
| Температура плавления | 177 ° С (351 ° F; 450 К) [ 1 ] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Скиммианин — это алкалоид фурохинолина, обнаруженный в Skimmia japonica , цветковом растении семейства Rutaceae , произрастающем в Японии и Китае. Это также сильный ингибитор ацетилхолинэстеразы (АХЭ). [ 2 ]
Биосинтез
[ редактировать ]Биосинтез скиммианина начинается с антраниловой кислоты . [ 3 ] который очень распространен в семействе Рутовые. При объединении ацетата антраниловой кислоты антранилоил-КоА образуется в качестве исходной единицы и способен удлинять боковую цепь за счет добавления малонил-КоА путем конденсации Кляйзена . Затем лактам образуется в результате циклизации и образования гетероциклической системы, в результате чего таутомер диенола принимает таутомер 4-гидроксихинолона, который представляет собой 4-гидрокси-2-хинолон.
При образовании хинолона алкилирование происходит по положению С-3 введением диметилаллилдифосфата. Еще одним ключевым этапом является циклизация диметилаллильной боковой цепи с образованием нового гетероциклического пятичленного кольца. [ 4 ] Платидесмин затем образует промежуточный продукт в результате реакции окислительного расщепления. [ 5 ] потеряв изопропильную группу с образованием диктамина. Наконец, скиммианин образуется в результате гидроксилирования диктамина.

Ссылки
[ редактировать ]- ^ «Химический кабинет» . comptox.epa.gov . Проверено 10 июня 2019 г.
- ^ Ян, Чжун-дуо; Чжан, Донг-бо; Рен, Джин; Ян, Мин-джун (2012). «Скиммианин, алкалоид фурохинолина из Zanthoxylum nitidum как потенциальный ингибитор ацетилхолинэстеразы». Медицинские химические исследования . 21 (6): 722–725. дои : 10.1007/s00044-011-9581-9 . S2CID 14113860 .
- ^ «Соединения, полученные из антраниловой кислоты». Алкалоиды . 2015. стр. 163–180. дои : 10.1016/B978-0-12-417302-6.00009-X . ISBN 9780124173026 .
- ^ Манске, Р.Х. (1960). Алкалоиды: Химия и физиология . Нью-Йорк: Академическая пресса.
- ^ Гюнгерих, Ф. Питер; Ёсимото, Фрэнсис К. (2018). «Образование и разрыв связей C–C посредством ферментативных реакций окисления–восстановления» . Химические обзоры . 118 (14): 6573–6655. doi : 10.1021/acs.chemrev.8b00031 . ПМК 6339258 . ПМИД 29932643 .