изотерма Гиббса
Изотерма адсорбции Гиббса для многокомпонентных систем — уравнение, позволяющее связать изменения концентрации компонента, контактирующего с поверхностью, с изменениями поверхностного натяжения , что приводит к соответствующему изменению поверхностной энергии . Для бинарной системы уравнение адсорбции Гиббса в терминах избытка поверхности имеет вид
где
- поверхностное натяжение ,
- — поверхностная избыточная концентрация компонента i ,
- — химический потенциал компонента i .
Адсорбция
[ редактировать ]Различные воздействия на границе раздела могут вызвать изменение состава приповерхностного слоя. [1] Вещества могут либо накапливаться вблизи поверхности, либо, наоборот, перемещаться в объем. [1] Движение молекул характеризует явления адсорбции . Адсорбция влияет на изменения поверхностного натяжения и стабильности коллоида . Адсорбционные слои на поверхности жидкой дисперсионной среды могут влиять на взаимодействие дисперсных частиц в среде и, следовательно, эти слои могут играть решающую роль в стабильности коллоида. [2] Адсорбция молекул жидкой фазы на границе раздела происходит, когда эта жидкая фаза контактирует с другими несмешивающимися фазами, которые могут быть газовыми, жидкими или твердыми. [3]
Концептуальное объяснение уравнения
[ редактировать ]Поверхностное натяжение описывает, насколько сложно увеличить площадь поверхности (путем ее растяжения или искажения). Если поверхностное натяжение велико, для увеличения площади поверхности требуется большая свободная энергия, поэтому поверхность будет иметь тенденцию сжиматься и удерживаться вместе, как резиновый лист.
На поверхностное натяжение влияют различные факторы, один из которых заключается в том, что состав поверхности может отличаться от состава массы. Например, если вода смешана с небольшим количеством поверхностно-активных веществ (например, мылом для рук ), основная часть воды может состоять на 99% из молекул воды и на 1% из молекул мыла, но самая верхняя поверхность воды может состоять на 50% из молекул воды и 50% молекул мыла. В этом случае мыло имеет большой и положительный «избыток поверхности». В других примерах поверхностный избыток может быть отрицательным: например, если вода смешана с неорганической солью, такой как хлорид натрия , поверхность воды в среднем менее соленая и более чистая, чем в среднем по объему.
Рассмотрим еще раз пример воды с небольшим количеством мыла. Поскольку на поверхности воды должна быть более высокая концентрация мыла, чем в массе, всякий раз, когда площадь поверхности воды увеличивается, необходимо удалить молекулы мыла из массы и добавить их на новую поверхность. Если концентрацию мыла немного увеличить, молекулы мыла станут более доступными (у них более высокий химический потенциал ), поэтому их будет легче вытащить из массы, чтобы создать новую поверхность. Поскольку создать новую поверхность легче, поверхностное натяжение снижается. Общий принцип таков:
- Когда поверхностный избыток компонента положителен, увеличение химического потенциала этого компонента снижает поверхностное натяжение.
Далее рассмотрим пример воды с солью. Поверхность воды менее соленая, чем основная масса, поэтому всякий раз, когда площадь поверхности воды увеличивается, необходимо удалять молекулы соли с новой поверхности и выталкивать их в объем. соли Если концентрацию соли немного увеличить (повышая химический потенциал ), оттолкнуть молекулы соли станет труднее. Поскольку теперь создать новую поверхность сложнее, поверхностное натяжение выше. Общий принцип таков:
- Когда поверхностный избыток компонента отрицательный, увеличение химического потенциала этого компонента увеличивает поверхностное натяжение.
Уравнение изотермы Гиббса дает точную количественную связь этих тенденций.
Расположение поверхности и определение избытка поверхности
[ редактировать ]
Расположение поверхности
[ редактировать ]При наличии двух фаз ( α и β ) поверхность (поверхностная фаза) располагается между фазой α и фазой β . Экспериментально трудно определить точную структуру неоднородной поверхностной фазы, контактирующей с объемной жидкой фазой, содержащей более одного растворенного вещества. [2] Неоднородность поверхностной фазы является результатом изменения мольных соотношений. [1] Модель, предложенная Джозайей Уиллардом Гиббсом, предполагала, что поверхностная фаза представляет собой идеализированную модель, имеющую нулевую толщину. В действительности, хотя объемные области α- и β- фаз постоянны, концентрации компонентов в межфазной области будут постепенно меняться от объемной концентрации α к объемной концентрации β на расстоянии x. Это контрастирует с идеализированной моделью Гиббса, где расстояние x принимает нулевое значение. Диаграмма справа иллюстрирует различия между реальной и идеализированной моделями.
Определение избытка поверхности
[ редактировать ]В идеализированной модели химические компоненты объемных α- и β -фаз остаются неизменными, за исключением момента приближения к разделительной поверхности. [3] Общее количество молей любого компонента (примеры включают: воду, этиленгликоль и т. д.) остается постоянным в объемных фазах, но варьируется в поверхностной фазе для реальной модели системы, как показано ниже.
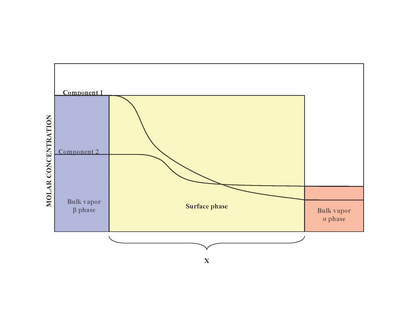
Однако в реальной системе общее количество молей компонента варьируется в зависимости от произвольного расположения разделительной поверхности. Количественной мерой адсорбции i -го компонента является количество поверхностного избытка. [1] Поверхностный избыток представляет собой разницу между общим количеством молей i -го компонента в системе и молями i -го компонента в конкретной фазе (либо α , либо β ) и выражается следующим образом:
где Γ i — поверхностный избыток i -го компонента, n — моли, α и β — фазы, A — площадь разделительной поверхности.
Γ представляет собой избыток растворенного вещества на единицу площади поверхности по сравнению с тем, который присутствовал бы, если бы объемная концентрация преобладала на всем пути к поверхности. Он может быть положительным, отрицательным или нулевым. Имеет единицы измерения моль/м. 2 .
Относительный избыток поверхности
[ редактировать ]Величины относительного избытка поверхности более полезны, чем произвольные количества избытка поверхности. [3] Относительный избыток поверхности связывает адсорбцию на границе раздела с растворителем в объемной фазе. Преимущество использования величин относительного избытка поверхности состоит в том, что они не зависят от положения разделительной поверхности. Таким образом, относительный избыток поверхности вещества i и растворителя 1 равен:
Уравнение изотермы адсорбции Гиббса
[ редактировать ]Вывод уравнения адсорбции Гиббса
[ редактировать ]Для двухфазной системы, состоящей из фаз α и β, находящихся в равновесии с поверхностью S, разделяющей фазы, полную свободную энергию Гиббса системы можно записать как:
где G — свободная энергия Гиббса.
Уравнение изотермы адсорбции Гиббса может быть получено на основе «детализации термодинамики теоремы Эйлера об однородных формах первого порядка». [4] Свободная энергия Гиббса каждой фазы α , фазы β и поверхностной фазы может быть представлена уравнением:
где U — внутренняя энергия, p — давление, V — объем, T — температура, S — энтропия, а µ i — химический потенциал i -го компонента.
Взяв полную производную формы Эйлера уравнения Гиббса для α -фазы, β -фазы и поверхностной фазы:
где A — площадь разделяющей поверхности, а γ — поверхностное натяжение .
Для обратимых процессов первый закон термодинамики требует, чтобы:
где q — тепловая энергия, а w — работа.
Подставляя приведенное выше уравнение в полную производную уравнения энергии Гиббса и используя результат, γd A приравнивается к объемной работе без давления, когда учитывается поверхностная энергия:
используя фундаментальное уравнение энергии Гиббса многокомпонентной системы:
Уравнение, связывающее α -фазу, β -фазу и поверхностную фазу, принимает вид:
При рассмотрении объемных фаз ( α- фаза, β- фаза) в состоянии равновесия при постоянной температуре и давлении уравнение Гиббса – Дюгема требует, чтобы:
Полученное уравнение представляет собой уравнение изотермы адсорбции Гиббса:
Изотерма адсорбции Гиббса — это уравнение, которое можно рассматривать как изотерму адсорбции , связывающее поверхностное натяжение раствора с концентрацией растворенного вещества.
Для бинарной системы, содержащей два компонента, уравнение адсорбции Гиббса с точки зрения избытка поверхности:
Связь между поверхностным натяжением и поверхностной избыточной концентрацией
[ редактировать ]Химический потенциал частиц i в растворе зависит от активности a по следующему уравнению: [2]
где µ i – химический потенциал -го компонента i , µ i тот — химический потенциал i -го компонента в исходном состоянии, R — газовая постоянная , T — температура, a i — активность i -го компонента.
Дифференцирование уравнения химического потенциала приводит к:
где f — коэффициент активности компонента i , а C — концентрация вида i в объемной фазе.
Если растворы в фазах α и β разбавлены (богаты одним конкретным компонентом i ), то коэффициент активности компонента i приближается к единице, и изотерма Гиббса становится:
В приведенном выше уравнении предполагается, что интерфейс является двумерным, что не всегда верно. Дальнейшие модели, такие как модель Гуггенхайма, исправляют этот недостаток.
Эффекты ионной диссоциации
[ редактировать ]Уравнение Гиббса для адсорбции электролита
[ редактировать ]Рассмотрим систему, состоящую из воды, которая содержит органический электролит RNaz и неорганический электролит NaCl, которые полностью диссоциируют так, что:
Уравнение адсорбции Гиббса, выраженное в относительном избытке поверхности, принимает вид:
Связь между поверхностным натяжением и поверхностной избыточной концентрацией выглядит следующим образом:
где m — коэффициент адсорбции Гиббса. [3] Значения m рассчитываются с использованием двухслойных (межфазных) моделей Гельмгольца , Гуи и Штерна .
Вещества могут по-разному влиять на поверхностное натяжение, как показано: 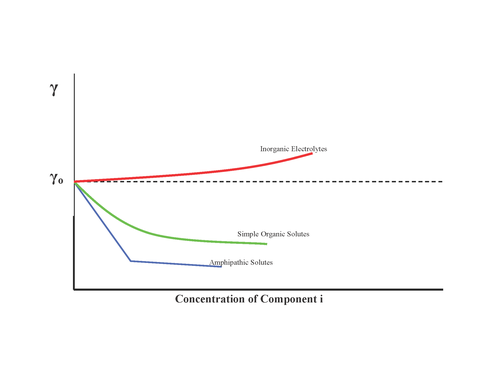
- Нет эффекта, например сахар
- Увеличение поверхностного натяжения, неорганические соли
- Постепенно уменьшайте поверхностное натяжение, спирты
- Уменьшите поверхностное натяжение и, как только будет достигнут минимум, эффекта больше не будет: поверхностно-активные вещества
Следовательно, изотерма Гиббса предсказывает, что неорганические соли имеют отрицательную поверхностную концентрацию. Однако в последние годы эта точка зрения подверглась серьезному сомнению из-за сочетания более точных экспериментов по межфазной чувствительности и теоретических моделей, обе из которых предсказывают увеличение поверхностной склонности галогенидов с увеличением размера и поляризуемости. [5] Таким образом, поверхностное натяжение не является надежным методом определения относительной склонности ионов к границе раздела воздух-вода.
Чтобы доказать достоверность модели, необходим метод определения поверхностных концентраций: обычно используются два разных метода: эллипсометрия и исследование затухания 14 C присутствует в молекулах ПАВ.
Изотерма Гиббса для ионных поверхностно-активных веществ
[ редактировать ]Ионные поверхностно-активные вещества требуют особого внимания, поскольку они являются электролитами :
- При отсутствии дополнительных электролитов
где относится к поверхностной концентрации молекул поверхностно-активного вещества без учета противоиона.
- В присутствии добавленных электролитов

Экспериментальные методы
[ редактировать ]Степень адсорбции на границе раздела жидкостей можно оценить, используя данные о концентрации поверхностного натяжения и уравнение адсорбции Гиббса. [3] Метод лезвия микротома используется для определения веса и молярной концентрации границы раздела. Способ заключается в получении участка границы раздела воздух-жидкость бинарных растворов площадью один квадратный метр с помощью лезвия микротома .
Другим методом, который используется для определения степени адсорбции на границе раздела воздух-вода, является эмульсионный метод, который можно использовать для оценки относительного поверхностного избытка по отношению к воде. [3]
можно определить избыток Гиббса поверхностно-активного компонента для водного раствора Кроме того, с помощью метода радиоактивных индикаторов . Поверхностно-активный компонент обычно маркируется углеродом-14 или серой-35. [3]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д Щукин Е.Д., Перцов А.В., Амелина Е.А., Зеленев А.С. Коллоид и химия поверхности. 1-е изд. Мобиус Д. и Миллер Р. Том. 12. Амстердам: Elsevier Science BV, 2001.
- ^ Jump up to: а б с Хименц, Пол К. и Раджагопалан, Радж. Основы коллоидной и поверхностной химии. 3-е изд. Нью-Йорк: Марсель Деккер, Inc, 1997.
- ^ Jump up to: а б с д и ж г Чатторадж Д.К. и Бирди К.С. Адсорбция и избыток поверхности Гиббса. Нью-Йорк: Издательство Пленум, 1984.
- ^ Каллен, Герберт Б. Термодинамика и введение в термостатику . 2-е изд. Канада: John Wiley & Sons, Inc, 1985.
- ^ Петерсен, Пол Б.; Сайкалли, Ричард Дж. (2006). «О природе ионов на поверхности жидкой воды». Ежегодный обзор физической химии . 57 (1): 333–364. doi : 10.1146/annurev.physchem.57.032905.104609 .

























