Поверхностный заряд
Поверхностный заряд — это электрический заряд, присутствующий на двумерной поверхности. Эти электрические заряды ограничены этой двумерной поверхностью, а плотность поверхностного заряда измеряется в кулонах на квадратный метр (Кл·м). −2 ), используется для описания распределения заряда на поверхности. Электрический потенциал непрерывен по всему поверхностному заряду, а поле прерывисто электрическое , но не бесконечно; это если только поверхностный заряд не состоит из дипольного слоя. Для сравнения: потенциал и электрическое поле расходятся при любом точечном или линейном заряде.
В физике в состоянии равновесия идеальный проводник не имеет заряда внутри; вместо этого весь заряд проводника находится на поверхности. Однако это применимо только к идеальному случаю бесконечной электропроводности ; большая часть заряда реального проводника находится на глубине скин-слоя поверхности проводника. Для диэлектрических материалов при приложении внешнего электрического поля [1] положительные и отрицательные заряды в материале будут слегка перемещаться в противоположных направлениях, что приводит к увеличению плотности поляризации в объемном теле и связанного заряда на поверхности.
В химии существует множество различных процессов, которые могут привести к заряду поверхности, включая адсорбцию ионов, протонирование или депротонирование и, как обсуждалось выше, приложение внешнего электрического поля. Поверхностный заряд создает электрическое поле, которое вызывает отталкивание и притяжение частиц, влияя на многие коллоидные свойства. [2]
Поверхностный заряд практически всегда появляется на поверхности частицы , когда она помещена в жидкость . Большинство жидкостей содержат ионы , положительные ( катионы ) и отрицательные ( анионы ). Эти ионы взаимодействуют с поверхностью объекта. Это взаимодействие может привести к адсорбции некоторых из них на поверхность. Если количество адсорбированных катионов превышает количество адсорбированных анионов, поверхность будет иметь чистый положительный электрический заряд.
Диссоциация поверхностной химической группы является еще одним возможным механизмом, приводящим к поверхностному заряду.
Плотность
[ редактировать ]Плотность поверхностного заряда определяется как количество электрического заряда q, присутствующего на поверхности заданной площади A : [3] [ нужна полная цитата ]
Дирижеры
[ редактировать ]Согласно закону Гаусса , проводник, находящийся в равновесии, по которому протекает приложенный ток, не имеет заряда внутри. Вместо этого весь заряд проводника находится на поверхности и может быть выражен уравнением: где E — электрическое поле, создаваемое зарядом на проводнике, а - диэлектрическая проницаемость свободного пространства. Это уравнение является строго точным только для проводников бесконечно большой площади, но оно обеспечивает хорошее приближение, если E измеряется на бесконечно малом евклидовом расстоянии от поверхности проводника. [4]
Коллоиды и погруженные предметы
[ редактировать ]| Сложный | Химическая формула | Точка нулевого заряда |
|---|---|---|
| оксиды вольфрама(VI) | WOWO3 | 0.2–0.5 [5] |
| карбид кремния (альфа) | Карбид кремния | 2–3.5 [6] |
| оксид марганца(IV) | МnО 2 | 4–5 [5] |
| нитрид кремния | Si3NСи3Н4 | 6–7 [7] |
| оксид таллия(I) | Тл 2 О | 8 [8] |
| оксид меди(II) | CuO | 9.5 [6] |
| оксид никеля(II) | Девять | 10–11 [6] |
Когда поверхность погружается в раствор, содержащий электролиты , на ней образуется суммарный поверхностный заряд. Часто это происходит из-за ионной адсорбции. Водные растворы обычно содержат положительные и отрицательные ионы ( катионы и анионы соответственно), которые взаимодействуют с частичными зарядами на поверхности, адсорбируясь на поверхности и, таким образом, ионизируя ее, создавая суммарный поверхностный заряд. [9] Этот суммарный заряд приводит к возникновению поверхностного потенциала [L], который приводит к тому, что поверхность окружается облаком противоионов, которое распространяется от поверхности в раствор, а также обычно приводит к отталкиванию между частицами. Чем больше парциальные заряды материала, тем больше ионов адсорбируется на поверхности и тем больше облако противоионов. Раствор с более высокой концентрацией электролитов также увеличивает размер облака противоионов. Этот слой ионов/противоионов известен как двойной электрический слой . [10]
pH раствора также может сильно влиять на поверхностный заряд, поскольку функциональные группы, присутствующие на поверхности частиц, часто могут содержать кислород или азот, два атома, которые могут быть протонированы или депротонированы, чтобы стать заряженными. Таким образом, по мере изменения концентрации ионов водорода меняется и поверхностный заряд частиц. При определенном pH средний поверхностный заряд будет равен нулю; это известно как точка нулевого заряда (PZC). [2] Список распространенных веществ и связанных с ними PZC показан справа.
Межфазный потенциал
[ редактировать ]Интерфейс определяется как общая граница, образованная между двумя разными фазами, например, между твердым телом и газом. [2] Электрический потенциал , или заряд, является результатом способности объекта перемещаться в электрическом поле. Таким образом, межфазный потенциал определяется как заряд, расположенный на общей границе между двумя фазами (например, аминокислота, такая как глутамат, на поверхности белка, может иметь карбоновую кислоту боковой цепи, депротонированную в средах с pH выше 4,1 с образованием заряженная аминокислота на поверхности, которая создаст межфазный потенциал). Межфазный потенциал отвечает за образование двойного электрического слоя, который имеет широкий спектр применения в так называемых электрокинетических явлениях . Развитие теории двойного электрического слоя описано ниже.
Гельмгольц
[ редактировать ]Модель, получившая название «двойной электрический слой», была впервые предложена Германом фон Гельмгольцем . Предполагается, что раствор состоит только из электролитов, вблизи электрода не происходит никаких реакций, которые могли бы переносить электроны, и что только ван-дер-ваальсовые взаимодействия между ионами в растворе и электродом присутствуют . Эти взаимодействия возникают только за счет связанной с электродом плотности заряда, которая возникает либо из-за избытка, либо из-за недостатка электронов на поверхности электрода. Для сохранения электронейтральности заряд электрода будет уравновешиваться перераспределением ионов вблизи его поверхности. Таким образом, притянутые ионы образуют слой, уравновешивающий заряд электрода. Ближайшее расстояние, на которое ион может подойти к электроду, будет ограничено радиусом иона плюс одной сольватной сферой вокруг отдельного иона. В целом наблюдаются два слоя заряда и падение потенциала от электрода к краю внешнего слоя (внешняя плоскость Гельмгольца).Учитывая приведенное выше описание, модель Гельмгольца по своей природе эквивалентна модели электрический конденсатор с двумя разделенными пластинами заряда, у которого наблюдается линейное падение потенциала по мере удаления от пластин.
Модель Гельмгольца, хотя и является хорошей основой для описания интерфейса, не учитывает несколько важных факторов: диффузию/смешивание в растворе, возможность адсорбции на поверхности и взаимодействие дипольных моментов растворителя и электрода. [11]
Гуи-Чепмен
[ редактировать ]
Теория Гуи-Чепмена описывает влияние статического поверхностного заряда на потенциал поверхности. [12] « Гуи предположил, что межфазный потенциал на заряженной поверхности можно объяснить наличием некоторого количества ионов данного заряда, прикрепленных к ее поверхности, и равного числа ионов противоположного заряда в растворе». [13] Положительный поверхностный заряд образует двойной слой, поскольку отрицательные ионы в растворе стремятся уравновесить положительный поверхностный заряд. Противоионы не удерживаются жестко, а имеют тенденцию диффундировать в жидкую фазу до тех пор, пока встречный потенциал, создаваемый их уходом, не ограничит эту тенденцию. Кинетическая энергия противоионов частично будет влиять на толщину образующегося диффузного двойного слоя. Связь между C, концентрацией противоионов на поверхности, и , концентрация противоиона во внешнем растворе, представляет собой фактор Больцмана: где z — заряд иона, e — заряд протона, k B — постоянная Больцмана , а ψ — потенциал заряженной поверхности.
Однако это неточно вблизи поверхности, поскольку предполагается, что молярная концентрация равна активности. Также предполагается, что ионы были смоделированы как точечные заряды и позже были модифицированы. Усовершенствование этой теории, известное как модифицированная теория Гуи-Чепмена, включало конечный размер ионов с учетом их взаимодействия с поверхностью в виде плоскости наибольшего сближения. [14]
Поверхностный потенциал
[ редактировать ]Связь между поверхностным зарядом и поверхностным потенциалом может быть выражена уравнением Грэма, полученным из теории Гуи-Чепмена путем предположения условия электронейтральности, которое гласит, что общий заряд двойного слоя должен быть равен отрицательному заряду поверхности. Используя одномерное уравнение Пуассона и предполагая, что на бесконечно большом расстоянии градиент потенциала равен 0, получаем уравнение Грэма: [2]
В случае более низких потенциалов может быть расширен до , и определяется как длина Дебая . Это приводит к простому выражению:
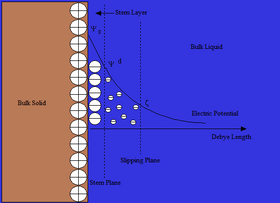
Стерн
[ редактировать ]Модель Отто Штерна двойного слоя по существу представляет собой комбинацию теорий Гельмгольца и Гуи-Чепмена. Его теория утверждает, что ионы имеют конечный размер и не могут приближаться к поверхности ближе, чем на несколько нанометров. На расстоянии, известном как слой Штерна, ионы могут адсорбироваться на поверхности до точки, называемой плоскостью скольжения, где адсорбированные ионы встречаются с объемной жидкостью. На плоскости скольжения потенциал Ψ уменьшился до так называемого дзета-потенциала . Хотя дзета-потенциал является промежуточным значением, его иногда считают более значимым, чем поверхностный потенциал, с точки зрения электростатического отталкивания. [2]
Приложения
[ редактировать ]Заряженные поверхности чрезвычайно важны и используются во многих приложениях. Например, растворы крупных коллоидных частиц почти полностью зависят от отталкивания из-за поверхностного заряда, чтобы оставаться дисперсными. [15] Если бы эти силы отталкивания были разрушены, возможно, путем добавления соли или полимера, коллоидные частицы больше не могли бы поддерживать суспензию и впоследствии флокулировали бы . [16]
Электрокинетические явления
[ редактировать ]
Электрокинетические явления относятся к множеству эффектов, возникающих в результате двойного электрического слоя . Примечательным примером является электрофорез , при котором заряженная частица, взвешенная в среде, будет двигаться под действием приложенного электрического поля. [17] Электрофорез широко используется в биохимии для различения молекул, таких как белки, по размеру и заряду. Другие примеры включают электроосмос , потенциал седиментации и потенциал потока . [2]
Белки
[ редактировать ]На поверхности белков часто присутствуют группы, которые могут быть ионизированы или деионизированы в зависимости от pH, что позволяет относительно легко изменять поверхностный заряд белка. белка Это имеет особенно важные последствия для активности белков, которые функционируют как ферменты или мембранные каналы, главным образом, то, что активный центр должен иметь правильный поверхностный заряд, чтобы иметь возможность связывать определенный субстрат. [18]
Клеи/покрытия
[ редактировать ]Заряженные поверхности часто полезны для создания поверхностей, которые не будут адсорбировать определенные молекулы (например, чтобы предотвратить адсорбцию основных белков, следует использовать положительно заряженную поверхность). Полимеры очень полезны в этом отношении, поскольку их можно функционализировать так, что они содержат ионизируемые группы, которые служат для обеспечения поверхностного заряда при погружении в водный раствор. [19]
Ссылки
[ редактировать ]- ^ «Диэлектрическая поляризация, связанные заряды и поле электрического смещения» (PDF) .
- ^ Перейти обратно: а б с д и ж г Ханс-Юрген, Батт; Граф, Карлхайнц; Каппль, Майкл (2006). Физика и химия интерфейсов . Германия: Wiley-VCH. стр. 45, 55, 56, 76–82. ISBN 978-3-527-40629-6 .
- ^ Вайсштейн,
{{citation}}: Отсутствует или пусто|title=( помощь ) - ^ Нейв, Карл Р. (2010). «Гауссовы поверхности» . Государственный университет Джорджии . Проверено 27 апреля 2011 г.
- ^ Перейти обратно: а б Космульски, Марек (2001), Химические свойства поверхностей материалов, Марсель Деккер
- ^ Перейти обратно: а б с Льюис, Дж. А. (2000). «Коллоидная обработка керамики». Журнал Американского керамического общества . 83 (10): 2341–2359. CiteSeerX 10.1.1.514.1543 . дои : 10.1111/j.1151-2916.2000.tb01560.x .
- ^ Жоливет Дж.П. (2000), Химия и синтез оксидов металлов. От решения к твердотельному телу , John Wiley & Sons Ltd., ISBN 0-471-97056-5 (Английский перевод оригинального французского текста, «От решения к оксиду» , издания InterEditions и CNRS, Париж, 1994 г.)
- ^ Космульский, М; Санелута, К. (2004). «Точка нулевого заряда/изоэлектрическая точка экзотических оксидов: Tl2O3». Журнал коллоидной и интерфейсной науки . 280 (2): 544–545. Бибкод : 2004JCIS..280..544K . дои : 10.1016/j.jcis.2004.08.079 . ПМИД 15533430 .
- ^ «Происхождение поверхностного заряда» . Коллоиды серебра. 2010 . Проверено 27 апреля 2011 г.
- ^ «Двойной электрический слой» . Коллоиды серебра. 2010 . Проверено 27 апреля 2011 г.
- ^ «Двойной электрический слой» . 2011. Архивировано из оригинала 31 мая 2011 года . Проверено 27 апреля 2011 г.
- ^ Эренштейн, Джеральд (200). «Поверхностный заряд» (PDF) . Архивировано из оригинала (PDF) 28 сентября 2011 года . Проверено 30 мая 2011 г.
- ^ Смирнов, Джеральд (2011). «Двойной бислой» . Проверено 30 мая 2011 г.
- ^ Грейтхаус, Джеффри А.; Феллер, Скотт Э.; МакКуорри, Дональд А. (1994). «Модифицированная теория Гуи-Чепмена: сравнение моделей набухания глины с двойным электрическим слоем». Ленгмюр . 10 (7): 2125. doi : 10.1021/la00019a018 .
- ^ «Измерение зета-потенциала» . Brookhaven Instruments Ltd., 2007. Архивировано из оригинала 19 июля 2003 года . Проверено 16 апреля 2011 г.
- ^ Хаббе, Мартин (2007). «Флокуляция коллоидов или суспензий волокон» . Государственный университет Северной Каролины . Проверено 16 апреля 2011 г.
- ^ «Глава 4: Электрофорез – Введение» . Доктор Уильям Х. Хайдкамп, факультет биологии, Колледж Густава Адольфа. 1995 . Проверено 30 мая 2011 г.
- ^ Эскобар, Лаура; Рут, Майкл Дж.; Маккиннон, Роберт (июль 1993 г.). «Влияние поверхностного заряда белка на бимолекулярную кинетику пептидного ингибитора калиевых каналов». Биохимия . 32 (27): 6982–6987. дои : 10.1021/bi00078a024 . ПМИД 7687466 .
- ^ Хазельберг, Роб; ван дер Снеппен, Линеке; Ариз, Фрик; Юбахс, Вим; Гуйер, Сис; де Йонг, Герхардус Дж.; Сомсен, Говерт В. (18 ноября 2009 г.). «Эффективность заряженных нековалентных полимерных покрытий против адсорбции белков на поверхности кремнезема, изученная с помощью спектроскопии затухания кольца в полости затухающих волн и капиллярного электрофореза». Аналитическая химия . 81 (24): 10172–10178. дои : 10.1021/ac902128n . ПМИД 19921852 .











