Волоконная фотометрия
В этой статье есть несколько проблем. Пожалуйста, помогите улучшить его или обсудите эти проблемы на странице обсуждения . ( Узнайте, как и когда удалять эти шаблонные сообщения )
|
Волоконная фотометрия — это метод визуализации кальция «объемного» или популяционного уровня , который улавливает кальций (Ca 2+ ) активность [1] из определенных типов клеток в области мозга или функциональной сети для изучения нейронных цепей [2] [3] [4] [5] [6] Активность кальция на популяционном уровне может быть коррелирована с поведенческими задачами, такими как пространственное обучение, воспроизведение памяти и целенаправленное поведение. [7] Методика предполагает хирургическую имплантацию оптоволокна в мозг живых животных. Преимущества для исследователей заключаются в том, что оптические волокна легче имплантировать, они менее инвазивны и менее дороги, чем другие кальциевые методы, а также меньше веса и нагрузки на животное по сравнению с минископами. Он также позволяет получать изображения нескольких взаимодействующих областей мозга и интегрировать его с другими методами нейробиологии. Ограничениями волоконной фотометрии являются низкое клеточное и пространственное разрешение, а также тот факт, что животных необходимо надежно привязывать к жесткому пучку волокон, что может повлиять на натуралистическое поведение более мелких млекопитающих, таких как мыши.
Техническое описание
[ редактировать ]Фотометрия волокон основана на экспрессии генетически кодируемых индикаторов кальция (GECI), таких как GCaMP или RCaMP, которые можно нацелить на конкретные клетки с помощью клеточно-специфичных промоторов, таких как Ca2+/кальмодулин-зависимая протеинкиназа II (CaMKII) и человеческий синапсин (hSyn). которые обеспечивают возбуждающую нейрональную и паннейрональную экспрессию соответственно. [1] Эти промоторы можно использовать для воздействия на различные подтипы нейронов, а также на ненейрональные клетки, которые демонстрируют динамику кальция, такие как астроциты , с использованием промотора глиального фибриллярного кислого белка (GFAP) . [8] [9] [10] [11] И в нейронах, и в астроцитах клеточная активность в виде потенциалов действия, экзоцитоза нейротрансмиттеров, изменений синаптической пластичности и транскрипции генов связана с притоком Са. 2+ ионы. [5]
Эти зависящие от активности изменения внутриклеточного уровня кальция можно отслеживать путем введения GECI в клетку. После этого притока ионов GECI флуоресцируют на Ca. 2+ связывание, а изменение флуоресценции пропорционально изменениям внутриклеточного кальция. [12] Наиболее часто используемым индикатором кальция для волоконной фотометрии (и других методов визуализации in vivo ) является GCaMP6, хотя продолжают разрабатываться дополнительные GECI с уникальными спектрами флуоресценции, кинетикой, соотношением сигнал/шум и чувствительностью к кальцию. [13] [14] Эти показатели могут выражаться в мозге двумя основными способами: вирусная экспрессия [15] и трансгенные мышиные линии . [16] В последнее время растет список индикаторов, которые стали доступны для измерения различных химических сигналов, например, dLight для регистрации сигналов дофамина или OxLight для регистрации орексина . [15] [17] [18] GCaMP, RCaMP, dLight и другие индикаторы возбуждаются источником света с оптимальной длиной волны и в ответ излучают собственный свет, что позволяет регистрировать динамику кальция или нейротрансмиттеров во времени. [15] [19] [13] [3] [20] [21]
Системы волоконной фотометрии предназначены для доставки точных длин волн возбуждения света, специфичных для индикатора кальция (например, GCaMP) или нейротрансмиттера (например, dLight). [3] Этот свет проходит по оптическому волокну к оптоволоконному кабелю, который имплантируется в интересующую область мозга или области мозга. Индикатор кальция заключается в том, что он выражается специфическим для каждого типа клеток образом, возбуждается этим светом и, в свою очередь, излучает собственный сигнал, который проходит обратно через то же волокно. [3] [4] [22] Эти собранные сигналы излучения спектрально разделяются дихроичным зеркалом, проходят через фильтр и фокусируются на фотодетекторе, научной камере или ФЭУ. [3] Собранный сигнал представляет собой изменение флуоресценции (ΔF) относительно исходной базовой линии (F). В свою очередь, исследователи могут наблюдать сигнал, соответствующий переходным процессам кальция (ΔF/F). Данные временных рядов можно анализировать с помощью различных конвейеров с открытым исходным кодом, таких как pMAT , [23] pyФотометрия [24] и ГуППи . [25]
Важно отметить, что изобестические сигналы представляют собой кальций-независимые сигналы (т.е. примерно 405-415 нм), которые контрастируют с кальций-зависимой длиной волны (т.е. 470 нм для GCaMP). Поскольку GCaMP имеет два состояния, Ca 2+ Связанные и несвязанные, эти две конформации белка имеют уникальные спектры возбуждения и испускания. Длина волны возбуждения, при которой GCaMP имеет одинаковую оптическую плотность с Ca и без него. 2+ является изобестическим и определяет независимую от кальция базовую линию флуоресценции. Движение животных и автофлуоресценция тканей отражаются в этом независимом от кальция сигнале, и их можно вычесть или регрессировать, чтобы выявить истинное изменение флуоресценции. [26]
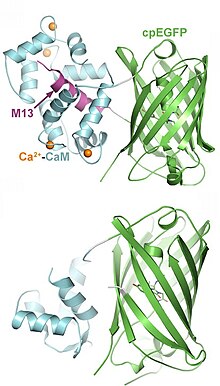
Генетически-кодированные индикаторы кальция (GECI)
[ редактировать ]Выражение
[ редактировать ]Оптимальная экспрессия генетически кодируемых индикаторов кальция (GECI) может быть достигнута двумя способами: аденоассоциированными вирусными векторами и трансгенными линиями грызунов . [15] [16] Вирусная инъекция требует введения GECI в интересующую область мозга. [15] Этот вирус можно нацелить на инфицирование уникальных типов клеток за счет использования клеточно-специфичных промоторов, таких как CaMKII и GFAP, для нацеливания на возбуждающие нейроны и астроциты соответственно. Это позволяет регистрировать нейронную активность генетически определенной субпопуляции нейронов или глиальных клеток через имплантированное оптическое волокно. [1] Экспрессия вируса требует титрования разведений для достижения оптимальной экспрессии в мозге, что может быть необходимо вместо использования трансгенных линий грызунов для определенных экспериментов. Экспрессия GECI также может быть достигнута за счет использования трансгенных линий, которые обеспечивают повсеместную экспрессию по всему мозгу. В зависимости от штамма мыши или крысы экспрессия может варьироваться в разных областях мозга, что создает потенциальные проблемы во время записи. [16]
ГКаМП
[ редактировать ]GCaMP — это генетически кодируемый индикатор кальция (GECI), который обычно используется во многих методах визуализации. [19] GCaMP излучает флуоресценцию, когда индикатор связан с ионом кальция (Ca 2+ ). Этот сигнал кальция напрямую связан с паттернами нервных реакций, высвобождением нейромедиаторов и возбудимостью мембран. [27] Длины волн возбуждения GCaMP и его изобестического сигнала составляют примерно 470 нм и 415 нм (синий) соответственно. Целью является фотовозбуждение точек максимального поглощения и изобестических точек индикатора. Изобестической точкой GCaMP является кальций-независимый сигнал, примерно 405-415 нм. Это определяется на основе того, что GCaMP имеет два функциональных состояния: связанное и несвязанное с ионами кальция. Эти два состояния имеют уникальные спектры возбуждения и испускания белков. Длина волны возбуждения, при которой эти два состояния белка имеют одинаковую оптическую плотность, является изобестической точкой и определяет базовую флуоресценцию. Движение и автофлуоресценция отражаются в этом независимом от кальция сигнале и могут быть вычтены или регрессированы, чтобы выявить истинное изменение клеточной флуоресценции во время поведенческой задачи или экспериментальных манипуляций. [26]
Длина волны излучения GCaMP составляет примерно 525 нм (зеленый), которую можно анализировать и коррелировать во времени во время поведенческих задач.
Многоцветная волоконная фотометрия
[ редактировать ]Чтобы наблюдать одновременную динамику кальция в нескольких типах клеток, исследователи объединили два или более GECI в одной области мозга. [3] [28] Например, исследовательская группа зафиксировала флуоресценцию зеленых и красных GECI, GCaMP6f и jRGECO1a, которые по-разному экспрессировались в стриарных нейронах шиповидных проекций прямого и непрямого путей у свободно ведущих себя мышей. [29] Экспрессия нескольких GECI в одной и той же области мозга может осуществляться не только в двух наборах нейронов, как было показано в предыдущем исследовании. Эти одновременные записи общего количества кальция также могут выполняться с использованием нескольких типов клеток, таких как нейроны и астроциты. Эти типы клеток экспрессируют уникальные промоторы, такие как GFAP и hSyn, и таким образом можно целенаправленно воздействовать на GECI. Другая исследовательская группа провела успешную фотометрию по двухцветному волокну с использованием промоутеров, специфичных для астроцитов и нейронов, в то время как мыши свободно выполняли задание на рабочую память (Т-лабиринт). [30]
Оборудование
[ редактировать ]Цель волоконной фотометрии — точно доставить, извлечь и записать объемный сигнал кальция от определенных популяций клеток в интересующей области мозга. Чтобы получить доступ к сигналу, оптическая канюля/волокно должна быть хирургически имплантирована в место экспрессии GECI. Это оптическое волокно может собирать только сигнал кальция на уровне популяции, но не активность отдельных клеток. [1] Кроме того, оптические волокна позволяют осуществлять запись как из глубоких, так и из поверхностных структур мозга и минимизировать повреждение тканей в отличие от линз GRIN или кортикальных окон.
GCaMP имеет специфические спектры возбуждения и эмиссии примерно при 470 и 530 нм соответственно. [27] Светодиодные источники света являются одними из наиболее часто выбираемых из-за низкой оптической мощности, необходимой для возбуждения GECI. Правильная передача сигналов возбуждения и излучения в двух направлениях от мозга к устройству визуализации координируется дихроичными зеркалами и фильтрами возбуждения/излучения. Существует три различных типа устройств формирования изображений: фотодетекторы , фотоумножители (ФЭУ) и научные камеры . При сборе сигнала из одной области мозга обычно используется фотодетектор или ФЭУ из-за их быстрого сбора и низкого отношения сигнал/шум (SNR). Альтернативно, при сборе данных из нескольких областей мозга необходимо использовать научные камеры или несколько фотодетекторов или ФЭУ.
В целом, эта система позволяет соединить оптическую канюлю, источник света и устройство визуализации. Точная доставка света к GECI обеспечивается оптической канюлей/волокном, а сигнал излучения собирается устройством визуализации во время записи.
Некоторые примеры коммерчески доступных систем волоконной фотометрии включают Neurophotometrics , Inscopix и MightexBio .
Преимущества и ограничения
[ редактировать ]Все научные методы имеют особенности, которые необходимо учитывать перед использованием. Волоконная фотометрия имеет много преимуществ по сравнению с другими методами визуализации кальция, но имеет ограничения.
Преимущества
[ редактировать ]Для сотрудников лабораторий, которые хотят интегрировать визуализацию кальция в свои эксперименты, но пока не имеют для этого финансовых или технических возможностей, волоконная фотометрия является низким входным барьером. Оптические волокна проще имплантировать, они менее инвазивны и более недороги, чем другие кальциевые методы, такие как одно- или двухфотонная визуализация. [14] Это хорошо для продольного [31] поведенческие парадигмы, поскольку животное подвергается меньшему весу и стрессу по сравнению с минископами. Он ограничивает подвижность животного значительно меньше, чем другие методы, позволяя более свободно передвигаться и натуралистично вести себя на более крупных моделях грызунов. Это универсальный метод, позволяющий получать изображения нескольких взаимодействующих областей мозга и интегрироваться с оптогенетикой. [32] электрофизиология [33] и другие методы нейробиологии системного уровня. Совсем недавно этот метод можно было сочетать с другими флуоресцентными индикаторами активности нейромедиаторов или изменений pH. [15] [21]
Ограничения
[ редактировать ]При планировании экспериментов важно учитывать основное ограничение волоконной фотометрии: низкое клеточное и пространственное разрешение. Это отсутствие оптического разрешения можно объяснить накоплением скопления активности в поле зрения, допуская только «объемные» изменения флуоресцентного сигнала. [5] Хотя размер оптической канюли намного меньше, чем у технологии, используемой в других методах визуализации кальция, таких как одно- и двухфотонная микроскопия, животных необходимо надежно привязывать к жесткому пучку волокон. [1] Это может ограничить натуралистическое поведение и более мелких млекопитающих, таких как мыши.
Интеграция с другими методами
[ редактировать ]
Оптогенетика и DREADDs
[ редактировать ]Волоконная фотометрия может быть интегрирована с клеточными манипуляциями, чтобы установить причинно-следственную связь между нейронной активностью и поведением. Целенаправленная модуляция определенных типов клеток и проекций в мозге может быть достигнута с помощью оптогенетики или дизайнерских рецепторов, исключительно активируемых дизайнерскими лекарствами (DREADD) . [14] Метод выбирается на основе временной точности, необходимой для планирования эксперимента, среди других факторов. Оптогенетика позволяет манипулировать определенным типом клеток с высокой временной точностью. DREADD имеют гораздо меньшую временную точность из-за фармакокинетики лиганда, такого как клозапин-N-оксид (CNO). [34] или десхлорклозапин (DCZ). [35] Важно отметить, что одновременное оптическое считывание и оптогенетические манипуляции сопряжены с несколькими потенциальными проблемами, которые обсуждаются ниже. [32]
in vivo Электрофизиология
[ редактировать ]Кроме того, волоконная фотометрия может сочетаться с in vivo электрофизиологией у одного и того же животного. [33] В сочетании эта комбинация электрофизиологической регистрации и визуализации кальция может использоваться для наблюдения за специфической активностью типов клеток с более высокой временной точностью считывания потенциалов действия нейронов на свободно ведущих себя моделях животных.
Возможные проблемы и решения
[ редактировать ]Доставка и экспрессия оптогенетических зондов и индикаторов кальция в одни и те же нейроны могут создавать проблемы. Индикаторы кальция и каналы манипуляции могут иметь перекрывающиеся спектры возбуждения, такие как GCaMP и каналродопсин (ChR2) , которые оба имеют пиковую длину волны возбуждения примерно 470 нм. Возбуждение индикатора кальция потенциально может активировать оптогенетический светочувствительный ионный канал. Измеренное изменение сигнала кальция нельзя легко объяснить фактическими изменениями сигнала кальция или оптогенетически-индуцированным сигналом. Решение этой проблемы включает в себя комбинацию индикаторов, имеющих неперекрывающийся спектр возбуждения, с вашим оптогенетическим зондом или кальциевым индикатором. кальциевые индикаторы (GCaMP, RCaMP) и оптогенетические зонды возбуждения (ChR2, Crimson) и торможения ( eNpHR , Arch Вариантами для этого являются , Jaws).
Другие методы визуализации кальция
[ редактировать ]Минископы и однофотонная визуализация
[ редактировать ]Минископы [36] [37] [38] [39] представляют собой устанавливаемые на голову миниатюрные микроскопы, которые позволяют визуализировать большие популяции нейронной активности у свободно ведущих себя мышей и крыс. Это возможно благодаря их небольшому размеру, поскольку они достаточно легкие, чтобы их можно было легко переносить мышью или крысой, не сильно мешая их поведению. Исследователи сочетают минископы с имплантированными линзами с градиентным показателем преломления (GRIN) или кортикальными окнами, которые позволяют осуществлять глубокую и поверхностную визуализацию мозга. [38] [5] [40] Этот метод идеально подходит для мониторинга активности сотен генетически и пространственно определенных клеток внутри одного животного. [37] По сравнению с волоконной фотометрией, минископы позволяют получать изображения с высоким клеточным разрешением, обнаруживая изменения в кальции внутри отдельных нейронов и ненейрональных клеток. [36] Кроме того, этот метод позволяет повторять визуализацию с течением времени для анализа перехода от «здорового» к патологическому состоянию или изменений в ходе поведения. [37] Однако этот метод визуализации имеет низкую чувствительность и высокий уровень шума, что приводит к получению изображений с более низким разрешением по сравнению с другими многофотонными методами, такими как двухфотонный. [7] Эти миниатюрные микроскопы ограничены в своей способности обнаруживать индикаторы с сильным красным смещением, которые были бы необходимы для сочетания оптогенетики и визуализации кальция, как обсуждалось выше.
Двухфотонная визуализация
[ редактировать ]Двухфотонная визуализация [41] [5] это еще один метод визуализации кальция, который фиксирует колебания клеточной динамики GECI. Он обеспечивает возможность проникновения в ткани головного мозга с высокой светорассеяемостью на глубину до 600-700 микрон под поверхностью мозга. [36] [42] По сравнению с другими методами двухфотонный метод обеспечивает более высокое клеточное и субклеточное пространственное разрешение, например, внутри дендритов и аксональных бутонов, в пределах четко определенной фокальной плоскости. [36] [41] Однако без помощи оптической канюли или микроэндоскопа этот метод ограничивается более поверхностными областями мозга. [36] [43] [44] Этот тип визуализации также требует, чтобы животные оставались с фиксированной головой, что ограничивает натуралистическое поведение, необходимое для некоторых сложных поведенческих задач. [41] [36]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и Цуй, Гохун; Джун, Сан Бом; Цзинь, Синь; Ло, Госян; Фам, Майкл Д.; Ловинджер, Дэвид М.; Фогель, Стивен С.; Коста, Руи М. (июнь 2014 г.). «Глубокие оптические измерения мозговой активности нейронной активности, специфичной для типа клеток, у ведущих мышей» . Протоколы природы . 9 (6): 1213–1228. дои : 10.1038/nprot.2014.080 . ISSN 1750-2799 . ПМК 4100551 . ПМИД 24784819 .
- ^ Ким, Кристина К.; Ян, Сэмюэл Дж.; Пичамурти, Нандини; Янг, Ной П.; Каувар, Исаак; Дженнингс, Джошуа Х.; Лернер, Талия Н.; Берндт, Андре; Ли, Су Юн; Рамакришнан, Чару; Дэвидсон, Томас Дж. (апрель 2016 г.). «Одновременное быстрое измерение динамики цепей в нескольких участках мозга млекопитающих» . Природные методы . 13 (4): 325–328. дои : 10.1038/nmeth.3770 . ISSN 1548-7105 . ПМЦ 5717315 . ПМИД 26878381 .
- ^ Перейти обратно: а б с д и ж Ван, Юаньмо; ДеМарко, Эмили М.; Витцель, Лиза София; Кейрон, Жаклин Д. (01 февраля 2021 г.). «Избранный обзор последних достижений в изучении нейронных цепей с помощью волоконной фотометрии» . Фармакология Биохимия и поведение . 201 : 173113. дои : 10.1016/j.pbb.2021.173113 . ISSN 0091-3057 . ПМИД 33444597 . S2CID 231579597 .
- ^ Перейти обратно: а б Гюнайдин, Лиза А.; Гросеник, Логан; Финкельштейн, Джоэл К.; Каувар, Исаак В.; Фенно, Лиф Э.; Адхикари, Авишек; Ламмель, Стефан; Мирзабеков, Джули Дж.; Айрон, Рааг Д.; Залокусски, Келли А.; Тай, Кей М. (19 июня 2014 г.). «Естественная динамика нейронных проекций, лежащая в основе социального поведения» . Клетка . 157 (7): 1535–1551. дои : 10.1016/j.cell.2014.05.017 . ISSN 1097-4172 . ПМЦ 4123133 . ПМИД 24949967 .
- ^ Перейти обратно: а б с д и Ресендес, Шанна Л; Стубер, Гаррет Д. (январь 2015 г.). «Визуализация кальция in vivo для освещения динамики активности нейроцепей, лежащей в основе натуралистического поведения» . Нейропсихофармакология . 40 (1): 238–239. дои : 10.1038/нпп.2014.206 . ISSN 0893-133X . ПМК 4262901 . ПМИД 25482169 .
- ^ Сыч, Ярослав; Чернышева Мария; Сумановски, Лазарь Т.; Хельмхен, Фритьоф (июнь 2019 г.). «Многоволоконная фотометрия высокой плотности для изучения динамики крупномасштабных цепей мозга» . Природные методы . 16 (6): 553–560. дои : 10.1038/s41592-019-0400-4 . ISSN 1548-7105 . ПМИД 31086339 . S2CID 152283372 .
- ^ Перейти обратно: а б Гирвен, Кейси С.; Спарта, Деннис Р. (15 февраля 2017 г.). «Исследование глубоких цепей мозга: новые достижения в стратегиях измерения уровня кальция in vivo». ACS Химическая нейронаука . 8 (2): 243–251. дои : 10.1021/acschemneuro.6b00307 . ПМИД 27984692 .
- ^ Ниммерьян, Аксель; Берглс, Дуайт Э (01 июня 2015 г.). «Массовая запись активности астроцитов» . Современное мнение в нейробиологии . Технология крупномасштабной записи (32). 32 : 95–106. дои : 10.1016/j.conb.2015.01.015 . ISSN 0959-4388 . ПМЦ 4447573 . ПМИД 25665733 .
- ^ Цунэмацу, Томоми; Саката, Сюдзо; Санаги, Томоми; Танака, Кенджи Ф.; Мацуи, Ко (23 июня 2021 г.). «Регионально-зависимая и зависящая от состояния динамика Ca2+ астроцитов во время цикла сон-бодрствование у мышей» . Журнал неврологии . 41 (25): 5440–5452. doi : 10.1523/JNEUROSCI.2912-20.2021 . ISSN 0270-6474 . ПМЦ 8221592 . ПМИД 34006590 .
- ^ Паукерт, Мартин; Агарвал, Амит; Ча, Чжепён; Дозе, Ван А.; Канг, Джин У.; Берглс, Дуайт Э. (18 июня 2014 г.). «Норадреналин контролирует реакцию астроглии на активность локальных цепей» . Нейрон . 82 (6): 1263–1270. дои : 10.1016/j.neuron.2014.04.038 . ISSN 1097-4199 . ПМК 4080721 . ПМИД 24945771 .
- ^ Коркрам, Мишель; Арак, Альфонсо (октябрь 2021 г.). «Передача сигналов астроцитов и нейронов в мезолимбической дофаминовой системе: скрытые звезды передачи сигналов дофамина» . Нейропсихофармакология . 46 (11): 1864–1872. дои : 10.1038/s41386-021-01090-7 . ISSN 1740-634X . ПМЦ 8429665 . ПМИД 34253855 .
- ^ Ван, Вэньцзин; Ким, Кристина К.; Тинг, Алиса Ю. (февраль 2019 г.). «Молекулярные инструменты для визуализации и регистрации активности нейронов» . Химическая биология природы . 15 (2): 101–110. дои : 10.1038/s41589-018-0207-0 . ISSN 1552-4469 . ПМИД 30659298 . S2CID 58607817 .
- ^ Перейти обратно: а б Чен, Цай-Вэнь; Уордилл, Тревор Дж.; Сунь, Йи; Пулвер, Стефан Р.; Реннингер, Сабина Л.; Баохан, Эми; Шрайтер, Эрик Р.; Керр, Рекс А.; Оргер, Майкл Б.; Джаяраман, Вивек; Лугер, Лорен Л. (июль 2013 г.). «Сверхчувствительные флуоресцентные белки для визуализации активности нейронов» . Природа . 499 (7458): 295–300. Бибкод : 2013Natur.499..295C . дои : 10.1038/nature12354 . ISSN 1476-4687 . ПМЦ 3777791 . ПМИД 23868258 .
- ^ Перейти обратно: а б с Викстром, Кейси Р.; Снарренберг, Шана Терай; Фридман, Владислав; Лю, Цин-сун (18 июня 2021 г.). «Применение оптогенетики и подходов визуализации in vivo для выяснения нейробиологии зависимости» . Молекулярная психиатрия . 27 (1): 640–651. дои : 10.1038/s41380-021-01181-3 . ISSN 1476-5578 . ПМЦ 9190069 . ПМИД 34145393 . S2CID 235466802 .
- ^ Перейти обратно: а б с д и ж Леопольд, Анна В.; Щербакова Дарья М.; Верхуша, Владислав В. (2019). «Флуоресцентные биосенсоры для нейротрансмиссии и нейромодуляции: техника и применение» . Границы клеточной нейронауки . 13 : 474. дои : 10.3389/fncel.2019.00474 . ISSN 1662-5102 . ПМК 6819510 . ПМИД 31708747 .
- ^ Перейти обратно: а б с Дана, Ход; Чен, Цай-Вэнь; Ху, Эми; Шилдс, Бренда С.; Го, Цайин; Лугер, Лорен Л.; Ким, Дуглас С.; Свобода, Карел (24 сентября 2014 г.). «Трансгенные мыши Thy1-GCaMP6 для визуализации популяции нейронов in vivo» . ПЛОС ОДИН . 9 (9): e108697. Бибкод : 2014PLoSO...9j8697D . дои : 10.1371/journal.pone.0108697 . ISSN 1932-6203 . ПМК 4177405 . ПМИД 25250714 .
- ^ Косме, Кейтлин В.; Палиссери, Гейтс К.; Лернер, Талия Н. (01 сентября 2018 г.). «Замечательный новый взгляд на нейромодуляцию» . Тенденции в нейронауках . 41 (9): 566–568. дои : 10.1016/j.tins.2018.07.004 . ISSN 0166-2236 . ПМК 6519934 . ПМИД 30055832 .
- ^ Даффет, Лоик; Косар, Сехер; Панниелло, Мариангела; Виберти, Бьянка; Брейси, Эдвард; Зыч, Анна Д.; Раду-Мерго, Артур; Чжоу, Сюэхань; Дерник, Ян; Равотто, Лука; Цай, Юань-Чен (февраль 2022 г.). «Генетически закодированный датчик для визуализации нейропептидов орексина in vivo» . Природные методы . 19 (2): 231–241. дои : 10.1038/s41592-021-01390-2 . ISSN 1548-7105 . ПМЦ 8831244 . ПМИД 35145320 .
- ^ Перейти обратно: а б Тиан, Лин; Хайрс, С. Эндрю; Мао, Тяньи; Хубер, Дэниел; Кьяппе, М. Евгения; Чаласани, Шрикант Х.; Петряну, Леопольдо; Акербум, Джаспер; МакКинни, Шон А.; Шрайтер, Эрик Р.; Баргманн, Корнелия И. (декабрь 2009 г.). «Визуализация нейронной активности червей, мух и мышей с улучшенными показателями кальция GCaMP» . Природные методы . 6 (12): 875–881. дои : 10.1038/nmeth.1398 . ISSN 1548-7105 . ПМЦ 2858873 . ПМИД 19898485 .
- ^ Иноуэ, Масатоши, Ацуя, Окура, Масамичи, Кейко; Камидзё, Сатоши, Саяка; 2015 г.). «Рациональный дизайн быстрого красного индикатора кальция R-CaMP2» . Nature Methods . 12 1): 64–70. : 10.1038 /nmeth.3185 . ( Кадзуо ( январь doi PMID 25419959 .S2CID 52798973 .
- ^ Перейти обратно: а б Патриарх Томмазо; Чо, Джунхонг Райан; Мертен, Катарина; Хоу, Марк В.; Марли, Аарон; Сюн, Вэй-Хун; Фолк, Роберт В.; Бруссард, Джерард Джоуи; Лян, Жуцян; Чан, Мин Джи; Чжун, Хайнин (29 июня 2018 г.). «Сверхбыстрая нейрональная визуализация динамики дофамина с помощью разработанных генетически закодированных датчиков» . Наука . 360 (6396): eaat4422. дои : 10.1126/science.aat4422 . ISSN 0036-8075 . ПМК 6287765 . ПМИД 29853555 .
- ^ Мартьянова Екатерина; Аронсон, Сейдж; Пру, Кристоф Д. (20 октября 2019 г.). «Многоволоконная фотометрия для регистрации нейронной активности свободно движущихся животных» . Журнал визуализированных экспериментов (152): e60278. дои : 10.3791/60278 . ISSN 1940-087X . ПМИД 31680685 . S2CID 207898488 .
- ^ Бруно, Карисса А.; О'Брайен, Крис; Брайант, Светлана; Мехаес, Дженнифер И.; Эстрин, Дэвид Дж.; Пиццано, Карина; Баркер, Дэвид Дж. (февраль 2021 г.). «pMAT: пакет программного обеспечения с открытым исходным кодом для анализа данных фотометрии волокна» . Фармакология, биохимия и поведение . 201 : 173093. doi : 10.1016/j.pbb.2020.173093 . ISSN 1873-5177 . ПМЦ 7853640 . ПМИД 33385438 .
- ^ Акам, Томас; Уолтон, Марк Э. (05 марта 2019 г.). «pyPhotometry: аппаратное и программное обеспечение на базе Python с открытым исходным кодом для сбора данных фотометрии оптоволокна» . Научные отчеты . 9 (1): 3521. Бибкод : 2019НатСР...9.3521А . дои : 10.1038/s41598-019-39724-y . ISSN 2045-2322 . ПМК 6401057 . ПМИД 30837543 .
- ^ Шератия, Венера Н.; Шайд, Майкл Д.; Сейлер, Джиллиан Л.; Лопес, Габриэла С.; Лернер, Талия Н. (16 июля 2021 г.). «GuPPy, набор инструментов Python для анализа данных фотометрии волокна» . Научные отчеты . 11 (1): 15.07.2021.452555. Бибкод : 2021НатСР..1124212С . дои : 10.1038/s41598-021-03626-9 . ПМЦ 8688475 . ПМИД 34930955 .
- ^ Перейти обратно: а б Сицилиано, Коди А.; Тай, Кей М. (01 февраля 2019 г.). «Использование изображений кальция для выявления дисфункции контуров при зависимости» . Алкоголь . Новые технологии в исследовании и лечении алкоголизма. 74 : 47–63. дои : 10.1016/j.alcohol.2018.05.013 . ISSN 0741-8329 . ПМЦ 7575247 . ПМИД 30470589 .
- ^ Перейти обратно: а б Гринбергер, Кристина; Коннерт, Артур (8 марта 2012 г.). «Визуализация кальция в нейронах» . Нейрон . 73 (5): 862–885. дои : 10.1016/j.neuron.2012.02.011 . ISSN 1097-4199 . ПМИД 22405199 . S2CID 3023809 .
- ^ Иноуэ, Масатоши (01 августа 2021 г.). «Генетически закодированные индикаторы кальция для исследования сложной динамики мозговых цепей in vivo» . Неврологические исследования . 169 : 2–8. doi : 10.1016/j.neures.2020.05.013 . ISSN 0168-0102 . ПМИД 32531233 . S2CID 219559849 .
- ^ Мэн, Чэнбо; Чжоу, Цзинхэн; Папанери, Эми; Педдада, Теха; Сюй, Карен; Цуй, Гохун (16 мая 2018 г.). «Волоконная фотометрия со спектральным разрешением для многокомпонентного анализа цепей мозга» . Нейрон . 98 (4): 707–717.е4. дои : 10.1016/j.neuron.2018.04.012 . ISSN 0896-6273 . ПМЦ 5957785 . ПМИД 29731250 .
- ^ Линь, Чжу; Ты, Фэн; Ли, Тинг; Фэн, Ицзя; Чжао, Синьюэ; Ян, Цзинцзин; Яо, Чжимо; Гао, Ин; Чен, Цзян-Фань (26 октября 2021 г.). «Увлечение динамики популяций астроцитов и нейронов Ca2+ при обработке информации рабочей памяти у мышей» . Неврологический бюллетень . 38 (5): 474–488. дои : 10.1007/s12264-021-00782-w . ISSN 1995-8218 . ПМЦ 9106780 . ПМИД 34699030 . S2CID 239888986 .
- ^ Ли, Йи; Лю, Чжисян; Го, Цинчун; Ло, Минмин (01.06.2019). «Долговременная волоконная фотометрия для нейронаучных исследований» . Неврологический бюллетень . 35 (3): 425–433. дои : 10.1007/s12264-019-00379-4 . ISSN 1995-8218 . ПМК 6527730 . ПМИД 31062336 .
- ^ Перейти обратно: а б Эмилиани, Валентина; Коэн, Адам Э.; Дейсерот, Карл; Хойссер, Михаэль (14 октября 2015 г.). «Полностью оптический опрос нейронных цепей» . Журнал неврологии . 35 (41): 13917–13926. doi : 10.1523/JNEUROSCI.2916-15.2015 . ISSN 0270-6474 . ПМК 4604230 . ПМИД 26468193 .
- ^ Перейти обратно: а б Патель, Амиша А.; Макалинден, Найл; Мэтисон, Кейт; Саката, Сюдзо (2020). «Одновременная электрофизиология и волоконная фотометрия у свободно ведущих себя мышей» . Границы в неврологии . 14 : 148. дои : 10.3389/fnins.2020.00148 . ISSN 1662-453X . ПМК 7047771 . ПМИД 32153363 .
- ^ Армбрустер, Блейн Н.; Ли, Сян; Пауш, Марк Х.; Херлице, Стефан; Рот, Брайан Л. (20 марта 2007 г.). «Развитие замка так, чтобы он соответствовал ключу, для создания семейства рецепторов, связанных с G-белком, мощно активируемых инертным лигандом» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (12): 5163–5168. дои : 10.1073/pnas.0700293104 . ISSN 0027-8424 . ПМЦ 1829280 . ПМИД 17360345 .
- ^ Нагай, Юджи; Миякава, Наохиса; Такува, Хироюки; Хори, Юкико; Ояма, Кей; Джи, Бин; Такахаси, Манами; Хуан, Си-Пин; Слокам, Сэмюэл Т.; ДиБерто, Джеффри Ф.; Сюн, Ян (сентябрь 2020 г.). «Дехлорклозапин, мощный и селективный хемогенетический активатор, обеспечивает быструю нейрональную и поведенческую модуляцию у мышей и обезьян» . Природная неврология . 23 (9): 1157–1167. дои : 10.1038/s41593-020-0661-3 . ISSN 1546-1726 . ПМИД 32632286 . S2CID 220375204 .
- ^ Перейти обратно: а б с д и ж Ресендес, Шанна Л.; Дженнингс, Джош Х.; Унг, Рэндалл Л.; Намбудири, Виджай Мохан К.; Чжоу, Чжэ Чарльз; Отис, Джеймс М.; Номура, Хироши; МакГенри, Дженна А.; Косик, Оксана; Стубер, Гаррет Д. (март 2016 г.). «Визуализация динамики кортикальных, подкорковых и глубоких нейронных цепей головного мозга во время натуралистического поведения млекопитающих с помощью наголовных микроскопов и постоянно имплантированных линз» . Протоколы природы . 11 (3): 566–597. дои : 10.1038/нпрот.2016.021 . ISSN 1750-2799 . ПМК 5239057 . ПМИД 26914316 .
- ^ Перейти обратно: а б с Зив, Янив; Бернс, Лори Д.; Кокер, Эрик Д.; Хамель, Элизабет О.; Гош, Кунал К.; Китч, Лейси Дж.; Эль Гамаль, Аббас; Шнитцер, Марк Дж. (март 2013 г.). «Долгосрочная динамика кодов мест гиппокампа CA1» . Природная неврология . 16 (3): 264–266. дои : 10.1038/nn.3329 . ISSN 1097-6256 . ПМЦ 3784308 . ПМИД 23396101 .
- ^ Перейти обратно: а б Гош, Кунал К.; Бернс, Лори Д.; Кокер, Эрик Д.; Ниммерьян, Аксель; Зив, Янив; Гамаль, Аббас Эль; Шнитцер, Марк Дж. (октябрь 2011 г.). «Миниатюрная интеграция флуоресцентного микроскопа» . Природные методы . 8 (10): 871–878. дои : 10.1038/nmeth.1694 . ISSN 1548-7105 . ПМЦ 3810311 . ПМИД 21909102 .
- ^ Юнг, Юрген К.; Мехта, Амит Д.; Аксай, Эмре; Степноски, Раймонд; Шнитцер, Марк Дж. (1 ноября 2004 г.). «Визуализация мозга млекопитающих in vivo с использованием одно- и двухфотонной флуоресцентной микроэндоскопии» . Журнал нейрофизиологии . 92 (5): 3121–3133. дои : 10.1152/jn.00234.2004 . ISSN 0022-3077 . ПМЦ 2826362 . ПМИД 15128753 .
- ^ Левен, Майкл Дж.; Домбек, Дэниел А.; Касишке, Карл А.; Моллой, Раймонд П.; Уэбб, Уотт В. (1 апреля 2004 г.). «Мультифотонная микроскопия in vivo глубоких тканей головного мозга» . Журнал нейрофизиологии . 91 (4): 1908–1912. дои : 10.1152/Jn.01007.2003 . ISSN 0022-3077 . PMID 14668300 .
- ^ Перейти обратно: а б с Свобода, Карел; Ясуда, Рёхей (15 июня 2006 г.). «Принципы микроскопии двухфотонного возбуждения и ее приложения в нейробиологии» . Нейрон . 50 (6): 823–839. дои : 10.1016/j.neuron.2006.05.019 . ISSN 0896-6273 . ПМИД 16772166 . S2CID 7278880 .
- ^ Денк, В.; Делани, КР; Гельперин А.; Кляйнфельд, Д.; Строубридж, штат Вашингтон; Танк, ДВ; Юсте, Р. (1 октября 1994 г.). «Анатомическая и функциональная визуализация нейронов с использованием 2-фотонной лазерной сканирующей микроскопии». Журнал методов нейробиологии . Методы визуализации в нейробиологии. 54 (2): 151–162. дои : 10.1016/0165-0270(94)90189-9 . ISSN 0165-0270 . ПМИД 7869748 . S2CID 3772937 .
- ^ Домбек, Дэниел; Танк, Дэвид (01 июля 2014 г.). «Двухфотонная визуализация нейронной активности у бодрствующих мобильных мышей» . Протоколы Колд-Спринг-Харбора . 2014 (7): 726–736. дои : 10.1101/pdb.top081810 . ISSN 1940-3402 . ПМИД 24987148 .
- ^ Домбек, Дэниел А.; Хаббаз, Антон Н.; Коллман, Форрест; Адельман, Томас Л.; Танк, Дэвид В. (4 октября 2007 г.). «Изображение крупномасштабной нейронной активности с клеточным разрешением у бодрствующих мобильных мышей» . Нейрон . 56 (1): 43–57. дои : 10.1016/j.neuron.2007.08.003 . ISSN 0896-6273 . ПМК 2268027 . ПМИД 17920014 .