Мясистый мясистый пептид
 | |
| Имена | |
|---|---|
| Название ИЮПАК Лизилглицил-α-аспартил-α-глутамил-α-глутамилсериллейцилаланин | |
| Систематическое название ИЮПАК (2S , 5S , 8S , 11S , 14S , 17S ) -11,14-бис(2-карбоксиэтил)-17-{2-[(2S ) -2,6-диаминогексанамидо]ацетамидо} -8-(гидроксиметил)-2-метил-5-(2-метилпропил)-4,7,10,13,16-пентаоксо-3,6,9,12,15-пентаазанонадекандиовая кислота | |
| Другие имена Вкусный пептид; БМП; BMP (пептид); L -лизилглицил- L -α-аспартил- L -α-глутамил- L -α-глутамил- L -серил - L -лейцил- L -аланин; КГДЕЕСЛА | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 34 Ч 57 Н 9 О 16 | |
| Молярная масса | 847.877 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Мясистый мясистый пептид , также известный как вкусный пептид. [1] и сокращенно БМП , [2] состоящий из 8 аминокислот представляет собой пептид, , который, как было установлено, придает мясной вкус продуктам, в которых он присутствует. Он был выделен из говяжьего супа Ямасаки и Маекавой в 1978 году. [3] Продолжающиеся исследования с момента его открытия Ямасаки и Маекавой предоставили общую поддержку наличия его свойств, придающих вкус. Однако из-за высокой стоимости производства потенциал широкого применения пептида в пищевой промышленности еще не реализован, что побуждает текущие исследовательские усилия сосредоточиться на поиске метода массового производства пептида.
Идентификация
[ редактировать ]Последовательность
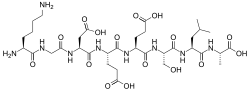
[ редактировать ]Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala [1]
Первичная структура была впервые определена Ямасаки и Маекавой, которые провели эксперимент, используя метод деградации Эдмана для N-конца секвенирования и методы карбоксипептидазы A (Cpase A) и триазинирования для секвенирования C-конца . [3] Во время эксперимента (1978 г.) оба метода использовались для определения аминокислотного состава и порядка последовательности, включая обнаружение связи Glu-Glu и обнаружение аланина на С-конце. Однако в настоящее время любого метода достаточно для секвенирования всего пептида.
Производство вкуса умами
[ редактировать ]На молекулярном уровне вкус умами регистрируется, когда такие молекулы, как глутамат и аспартат, связываются с лигандсвязывающими доменами специализированных вкусовых рецепторов. После активации эти рецепторы посылают электрические импульсы, которые поступают в мозг через сенсорные нейроны. [4] В 1989 году Тамура и др. обнаружили, что сами по себе основные остатки, такие как Lys-Gly и Lys-Lys, в их дигидрохлоридных формах вызывают кислый и соленый вкус, тогда как кислые остатки, такие как Asp-Glu-Glu и Lys-Gly, вызывают кислый и сладкий вкус. [1] Однако вкус умами обусловлен сочетанием кислотных и основных аминокислотных остатков, таких как Lys-Gly-Asp. Более конкретно, вкус умами, обнаруженный в BMP, создается комбинацией лизина на N-конце и кислых аминокислот (Asp-Glu-Glu) в средней части пептида, что позволяет предположить, что катионы и анионы играют роль в стимуляция вкусовых рецепторов для создания вкуса умами.
Однако на вкусовую реакцию пептида могут влиять и другие факторы, помимо присутствия определенных аминокислот. Интенсивность вкуса умами увеличивается, когда кислый пептид взаимодействует с катионами с образованием соли. При пороговом значении 1,25 миллимолярного (мМ) дипептид Asp-Glu создает самый сильный вкус умами при воздействии NaOH и повышении pH. Положение аминокислот также играет роль в интенсивности вкуса, поскольку дипептид Glu-Asp регистрируется при пороговом значении 3,14 мМ, а это означает, что для того, чтобы человек мог ощутить вкус умами, потребуется большее количество соединения. [2] Кроме того, в то время как аналог Lys-Gly-HCl регистрирует соленый вкус умами при 1,22 мМ, аналог Gly-Lys-HCl регистрирует кислый и сладкий вкус при 5,48 мМ. Таким образом, результаты исследования показали, что вкус и силу аромата можно изменить за счет модификации кислотных остатков в пептидах, что открывает возможности для производства BMP-подобных пептидов с большей интенсивностью вкуса. Хотя интенсивность его вкуса не меняется в зависимости от pH, [5] Было описано, что BMP дает разные вкусы в зависимости от изменений pH. Примечательно, что он считается кислым при pH 3,5, умами при pH 6,5 и сладким, кислым и умами при pH 9,5. [6]
Жизнеспособность для реального применения
[ редактировать ]Было показано, что BMP остается стабильным, не разрушаясь, в условиях высокотемпературной пастеризации и стерилизации, что делает возможным его потенциальное использование в кулинарных целях. Те, кто выступает за присутствие в BMP вкуса умами, улучшающего вкус, сообщают, что его вкус аналогичен вкусу глутамата натрия. [1] Следовательно, БМП обладает потенциалом для масштабной коммерциализации в пищевой промышленности. Однако основным препятствием является стоимость массового производства пептида. В настоящее время основными способами производства специфических вкусовых пептидов, таких как BMP, являются химический и ферментативный синтез, оба из которых связаны с высокими производственными затратами.
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д Тамура, Масахиро; Накацука, Тору; Тада, Макото; Кавасаки, Ёсихиро; Кикучи, Эйичи; Окай, Хидео (1989). «Взаимосвязь между вкусом и первичной структурой «вкусного пептида» (Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala) из говяжьего супа» . Сельскохозяйственная и биологическая химия . 53 (2): 319–325. дои : 10.1271/bbb1961.53.319 .
- ^ Перейти обратно: а б Ван, К.; Мага, ДА; Бектель, П.Дж. (1995). «Стабильность мясистого пептида к температурам пастеризации и стерилизации». Пищевая наука и технология . 28 (5): 539–542. дои : 10.1006/fstl.1995.0089 .
- ^ Перейти обратно: а б Ямасаки, Ёсио; Маэкава, Казуюки (1978). «Пептид с восхитительным вкусом» . Сельскохозяйственная и биологическая химия . 42 (9): 1761–1765. дои : 10.1271/bbb1961.42.1761 .
- ^ Берг, Джереми М.; Тимочко, Джон Л.; Страйер, Люберт (2002). Биохимия (5-е изд.). У. Х. Фриман . стр. 32-7–32-11. ISBN 0-7167-3051-0 .
- ^ Ван, К.; Мага, Дж.А.; Бектель, П.Дж. (1996). «Вкусовые свойства и синергизм мясистого пептида». Журнал пищевой науки . 61 (4): 837–839. дои : 10.1111/j.1365-2621.1996.tb12214.x .
- ^ Тарте, Родриго; Амундсон, Кертис М. (2006). «Взаимодействие белков в мышечной пище». В Гаонкаре Анилкумар Г.; Макферсон, Эндрю (ред.). Взаимодействие ингредиентов: влияние на качество продуктов питания . Пищевая наука и технология. Том. 154 (2-е изд.). ЦРК Пресс . п. 224. дои : 10.1201/9781420028133 . ISBN 978-1-4200-2813-3 .