бороксин
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 1,3,5,2,4,6-триоксатриборинан | |
| Другие имена циклотрибороксан | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
ПабХим CID | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| B3H3OB3H3O3 | |
| Молярная масса | 83.455 g mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Бороксин ( B 3 H 3 O 3 ) — 6-членное гетероциклическое соединение , состоящее из чередующихся атомов кислорода и одногидрированного бора . бороксина Производные (бороновые ангидриды ), такие как триметилбороксин и трифенилбороксин, также составляют более широкий класс соединений, называемых бороксинами. [1] Эти соединения представляют собой твердые вещества, которые обычно находятся в равновесии с соответствующими бороновыми кислотами при комнатной температуре. [1] [2] [3] Помимо использования в теоретических исследованиях, бороксин в основном используется в производстве оптики. [4]
Структура и связь
[ редактировать ]Трехкоординационные соединения бора обычно имеют тригональную плоскую геометрию, поэтому бороксиновое кольцо также имеет плоскую геометрию. [2] [5] Эти соединения изоэлектронны бензолу. Имея вакантную р-орбиталь у атомов бора, они могут иметь ароматический характер. [2] [6] Одинарные связи бора в соединениях бороксина в основном имеют s-характер. [5] Этилзамещенный бороксин имеет длину связи BO 1,384 Å и длину связи BC 1,565 Å. [6] Фенилзамещенный бороксин имеет одинаковую длину связи 1,386 Å и 1,546 Å соответственно, что показывает, что заместитель мало влияет на размер бороксинового кольца. [6]
Замещения в кольце бороксина определяют его кристаллическую структуру. Алкилзамещенные бороксины имеют простейшую кристаллическую структуру. Эти молекулы накладываются друг на друга, выравнивая атом кислорода в одной молекуле с атомом бора в другой, оставляя каждый атом бора между двумя другими атомами кислорода. Это образует трубку из отдельных колец бороксина. Межмолекулярное расстояние BO этилзамещенного бороксина составляет 3,462 Å, что намного больше, чем расстояние связи BO, равное 1,384 Å. Кристаллическая структура фенилзамещенного бороксина более сложна. Взаимодействие между вакантными p-орбиталями атомов бора и π-электронами ароматических фенильных заместителей обусловливает различную кристаллическую структуру. Бороксиновое кольцо одной молекулы расположено между двумя фенильными кольцами других молекул. Такое расположение позволяет фенильным заместителям отдавать π-электронную плотность вакантным p-орбиталям бора. [6]
Синтез
[ редактировать ]Исходный бороксин ( цикло- (HBO) 3 ) получают в небольших количествах в виде газа низкого давления путем высокотемпературной реакции воды и элементарного бора или реакции различных боранов (B 2 H 6 или B 5 H 9 ) с O 2 . Он термодинамически нестабилен по отношению к диспропорционированию диборана и оксида бора. [7] Сообщается о некоторых исследованиях реакционной способности и ИК-спектре, но в остальном он недостаточно хорошо охарактеризован. [8]
Как было обнаружено в 1930-х годах, замещенные бороксины ( цикло- (RBO) 3 , R = алкил или арил) обычно получают из соответствующих им бороновых кислот путем дегидратации. [1] [2] [3] Это обезвоживание может быть осуществлено либо с помощью сушильного агента, либо путем нагревания в высоком вакууме. [2]
Триметилбороксин можно синтезировать реакцией монооксида углерода с дибораном (B 2 H 6 ) и борогидридом лития (LiBH 4 ) в качестве катализатора (или реакцией боран-тетрагидрофуран или боран-(диметилсульфид) в присутствии борогидрида натрия ): [5] [9]
Реакции
[ редактировать ]Триметилбороксин используется при метилировании различных арилгалогенидов посредством палладием катализируемых реакций сочетания Сузуки-Мияуры : [10]
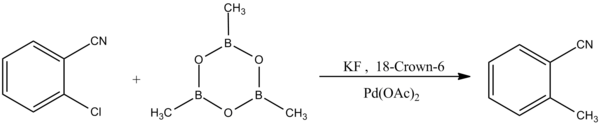
Другая форма реакции сочетания Сузуки-Мияуры проявляет селективность по отношению к арилхлоридам: [11]
Бороксины также были исследованы как предшественники мономерного оксоборана HB≡O. [3] Это соединение быстро превращается обратно в циклический бороксин даже при низких температурах. [3]
Ссылки
[ редактировать ]- ^ Jump up to: а б с Браун, Х.К. Бораны в органической химии ; Издательство Корнельского университета: Итака, 1972; стр. 346–347.
- ^ Jump up to: а б с д и Холл, Деннис Г. (2005). Бороновые кислоты – получение и применение в органическом синтезе и медицине . Джон Уайли и сыновья ISBN 3-527-30991-8 .
- ^ Jump up to: а б с д Весткотт, Ю.А. (2010). «Химия БО проходит полный круг». Angewandte Chemie, международное издание . 49 (48): 9045–9046. дои : 10.1002/anie.201003379 . ПМИД 20878818 .
- ^ Ву, QG; Г. Ву; Л. Леон Бранка; С. Ван (1999). «B3O3Ph3 (7-азаиндол): структура, люминесценция и текучесть». Металлоорганические соединения . 18 (13): 2552–2556. дои : 10.1021/om990053t .
- ^ Jump up to: а б с Онак, Т. в области органоборановой химии ; Мейтлз, П.М., Стоун, FGA, Уэст, Р., ред.; Академическая пресса: Нью-Йорк, 1975; стр. 2,4,16,44.
- ^ Jump up to: а б с д Хаберехт, MC; Болт, Майкл; Вагнер, Матиас; Лернер, Ханс-Вольфрам (2005). «Новый полиморф три( п -толил)бороксина». Журнал химической кристаллографии . 35 (9): 657–665. дои : 10.1007/s10870-005-3325-y .
- ^ Бартон, Л.; Гримм, ФА; Портер, Ричард Ф. (1966). «Бороксин: упрощенный препарат» . Неорганическая химия . 5 (11): 2076–2078. дои : 10.1021/ic50045a062 . ISSN 0020-1669 .
- ^ Ли, Джордж Х.; Портер, Ричард Ф. (1966). «Гозообразный бороксин: механизмы реакций с кислородом и окисью углерода» . Неорганическая химия . 5 (8): 1329–1333. дои : 10.1021/ic50042a007 . ISSN 0020-1669 .
- ^ Ратке, Майкл В.; Браун, Герберт К. (1966). «Новая реакция диборана с окисью углерода, катализируемая боргидридом натрия. Удобный синтез триметилбороксида» . Журнал Американского химического общества . 88 (11): 2606–2607. дои : 10.1021/ja00963a054 . ISSN 0002-7863 .
- ^ Грей, М.; Эндрюс, ИП; Хук, Д.Ф.; Киттерингем, Дж.; Войл, М. (2000). «Практическое метилирование арилгалогенидов с помощью соединения Сузуки-Мияура». Тетраэдр . 41 (32): 6237–6240. дои : 10.1016/S0040-4039(00)01038-8 .
- ^ Песня, К.; Может.; Чай, К.; Ма, К.; Джаинг, В.; Андрус, МБ (2005). «Катализируемое палладием сочетание Сузуки-Мияуры с арилхлоридами с использованием объемистого фенантрилового N-гетероциклического карбенового лиганда». Тетраэдр . 61 (31): 7438–7446. дои : 10.1016/j.tet.2005.05.071 .
![{\displaystyle 3\ {\ce {CO}}+{\frac {3}{2}}\ {\ce {B2H6}}{\ce {->[{\ce {LiBH4 (катализатор)}}] ( H3C БО)3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0d61e082719f2669e188673799d48b8693ed72a8)
![{\displaystyle {\ce {{\overset {(X = Br, I)}{C6H5X}}+ (CH3BO)3 ->[{\ce {K2CO3, Pd(PPh3)4}}][{\ce { диоксан}}] C6H5CH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e07d87468caf83dee3007f299bb75ed8928deb4b)