Завязанный белок

Узловидные белки — это белки, чьи скелеты запутываются в узел. Можно представить себе, что белковую цепь тянут за оба конца, как если бы за оба конца тянули веревку. Когда завязанный белок «вытягивают» с обоих концов, он не распутывается. Узловидные белки очень редки и составляют лишь около одного процента белков в Банке данных белков , а механизмы их сворачивания и функции недостаточно изучены. Хотя существуют экспериментальные и теоретические исследования, намекающие на некоторые ответы, систематические ответы на эти вопросы пока не найдены.
Хотя для обнаружения белковых узлов был разработан ряд вычислительных методов, до сих пор не существует полностью автоматических методов обнаружения белковых узлов без необходимости ручного вмешательства из-за отсутствия остатков или разрывов цепей в рентгеновских структурах или нестандартных форматах PDB.
Большинство узлов, обнаруженных в белках, представляют собой глубокие узлы -трилистники ( 31 ) . Узлы «фигура восемь» (4 1 ) , узлы «трех витков» (5 2 ) , стивидорные узлы (6 1 ) и узел «Септойл» (7 1 ). [1] также были обнаружены. Недавно использование методов машинного обучения для прогнозирования структуры белка привело к высокоточному предсказанию 6 3 узла . [2] Кроме того, с использованием тех же методов составные узлы (а именно 3 1 #3 1 ). были найдены [3] и кристаллизовался. [4]

Математическая интерпретация
[ редактировать ]Математически узел определяется как подмножество трехмерного пространства, гомеоморфное кругу. [6] Согласно этому определению, узел должен существовать в замкнутой петле, тогда как завязанные белки вместо этого существуют в открытых, незамкнутых цепях. Чтобы применить математическую теорию узлов к завязанным белкам, можно использовать различные стратегии для создания искусственного замкнутого цикла. Одна из таких стратегий — выбрать точку в пространстве на бесконечном расстоянии, которая будет соединена с N- и C-концами белка через виртуальную связь, таким образом, белок можно рассматривать как замкнутый контур. Другая такая стратегия — использовать стохастические методы, создающие случайные замыкания.
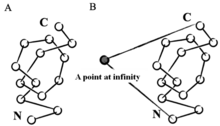
Глубина узла
[ редактировать ]Глубина белкового узла связана со способностью белка сопротивляться развязыванию. Глубокий узел сохраняется, хотя удаление значительного количества остатков с обоих концов не разрушает узел. Чем больше остатков, которые можно удалить, не разрушая узел, тем глубже узел.
Формирование узлов
[ редактировать ]Учитывая, как можно создавать узлы с помощью веревки, сворачивание завязанных белков должно включать сначала образование петли, а затем продевание одного конца через петлю. Это единственный топологический способ формирования узла-трилистника. Для более сложных узлов теоретически возможно, чтобы петля несколько раз перекручивалась вокруг себя, а это означает, что один конец цепочки обматывается хотя бы один раз, а затем происходит заправка. В теоретическом исследовании также было замечено, что узел 61 может образовываться за счет продевания С-конца через петлю и переворота другой петли через первую петлю, а также за счет продевания С-конца через обе петли, которые ранее были перевернули друг друга. [7]
Сворачивание завязанных белков можно объяснить взаимодействием образующейся цепи с рибосомой. В частности, сродство цепи к поверхности рибосомы может привести к созданию петли, в которую затем может быть пропущена образующаяся цепь. Было показано, что такой механизм правдоподобен для одного из известных белков с наиболее глубоко завязанными узлами. [8]
Были проведены экспериментальные исследования с участием YibK и YbeA, узловатых белков, содержащих узлы-трилистники. Было установлено, что эти завязанные белки сворачиваются медленно, и что завязывание узлов при сворачивании является стадией, ограничивающей скорость. [9] В другом экспериментальном исследовании белок длиной 91 остаток был прикреплен к концам YibK и YbeA. [10] Присоединение белка к обоим концам приводит к образованию глубокого узла примерно со 125 удаляемыми остатками на каждом конце, прежде чем узел разрушается. Однако было замечено, что полученные белки могут сворачиваться спонтанно. Было показано, что прикрепленные белки сворачиваются быстрее, чем сами YibK и YbeA, поэтому ожидается, что во время сворачивания они будут действовать как пробки на обоих концах YibK и YbeA. Было обнаружено, что прикрепление белка к N-концу не изменяет скорость сворачивания, но прикрепление к C-концу замедляет сворачивание, что позволяет предположить, что событие образования нити происходит на C-конце. Шапероны, хотя и облегчают связывание белков, не играют решающей роли в самосвязывании белков. [10] [11]
Другие топологически сложные структуры белков.
[ редактировать ]
Класс узловатых белков содержит только структуры, у которых остов после замыкания образует завязанную петлю. Однако некоторые белки содержат «внутренние узлы», называемые скользящими узлами, т.е. структуры без узлов, содержащие завязанную подцепь. [12] Другой топологически сложной структурой является связь, образованная ковалентными петлями, замкнутыми дисульфидными мостиками. [13] [14] В белках идентифицированы три типа дисульфидных связей: два варианта связи Хопфа (различающиеся по хиральности) и один вариант связи Соломона . Другой сложной структурой, возникающей в результате замыкания части цепи ковалентным мостиком, являются сложные белки-лассо, у которых ковалентная петля пронизана цепью один или несколько раз. [15] Еще одной сложной структурой, возникающей в результате существования дисульфидных мостиков, являются цистиновые узлы , в которых два дисульфидных мостика образуют замкнутую ковалентную петлю, в которую пронизана третья цепь. Термин «узел» в названии мотива вводит в заблуждение, поскольку мотив не содержит никакого замкнутого замкнутого цикла. При этом образование цистиновых узлов в целом не отличается от сворачивания незавязанного белка.
Помимо замыкания только одной цепи, можно также выполнить процедуру замыкания цепей для всех цепей, присутствующих в кристаллической структуре. В некоторых случаях получаются нетривиально связанные структуры, называемые вероятностными связями. [16]
Можно также рассмотреть петли в белках, образованные кусками основной цепи и дисульфидными мостиками, и взаимодействие через ионы. Такие петли также можно завязывать из звеньев формы даже в конструкциях с незавязанной основной цепью. [17] [18]
Первые открытия
[ редактировать ]Марк Л. Мэнсфилд в 1994 году предположил, что в белках могут быть узлы. [19] Он дал белкам неузелковые оценки, построив сферу с центром в центре масс альфа-углеродов основной цепи, с радиусом, в два раза превышающим расстояние между центром массы и кальфой, которая находится дальше всего от центра массы, и путем выборки двух случайных точек на поверхности сферы. Он соединил две точки, проведя на поверхности сферы геодезическую (дуги больших кругов), а затем соединил каждый конец белковой цепи с одной из этих точек. Повторив эту процедуру 100 раз и подсчитав количество раз, когда узел разрушался в математическом смысле, можно получить оценку разузла. Было обнаружено, что карбоангидраза человека имеет низкий показатель узлов (22). При визуальном осмотре конструкции было видно, что узел неглубокий, а это означает, что удаление нескольких остатков с обоих концов разрушает узел.
В 2000 году Уильям Р. Тейлор идентифицировал глубокий узел в изомередуктазе ацетогидроксикислоты ( ID PDB : 1YVE), используя алгоритм, который сглаживает белковые цепи и делает узлы более видимыми. [20] Алгоритм сохраняет оба конца фиксированными и итеративно присваивает координатам каждого остатка среднее значение координат соседних остатков. Необходимо следить за тем, чтобы цепи не проходили друг через друга, иначе перекрещивания и, следовательно, узел могут разрушиться. Если узла нет, алгоритм в конечном итоге создает прямую линию, соединяющую оба конца.
Исследования функции узла в белке
[ редактировать ]Некоторые предложения относительно функции узлов заключались в том, что они могут повысить термическую и кинетическую стабильность. Одно из конкретных предположений заключалось в том, что для человеческой убиквитингидролазы, которая содержит узел 5 2 , наличие узла может препятствовать ее втягиванию в протеасому. [21] Поскольку это деубиквитинирующий фермент, его часто обнаруживают вблизи белков, которые вскоре будут расщеплены протеасомой, и поэтому он сталкивается с опасностью разрушения сам. Следовательно, наличие узла может действовать как пробка, предотвращающая его. Это понятие было дополнительно проанализировано на других белках, таких как YbeA и YibK, с помощью компьютерного моделирования. [22] Узлы как будто затягиваются, когда их втягивают в пору, и в зависимости от силы, с которой они втягиваются, они либо застревают и закупоривают пору, вероятность чего увеличивается с увеличением силы втягивания, либо в случае небольшая тянущая сила, они могут распутаться, когда один конец выдернут из узла. При более глубоких узлах более вероятно, что пора будет заблокирована, так как через узел придется протягивать слишком много остатков. В другом теоретическом исследовании [23] было обнаружено, что смоделированный узловатый белок не был термически стабильным, но был кинетически стабильным. Было также показано, что узел в белках создает места на границе гидрофобной и гидрофильной частей цепи, характерные для активных центров. [24] Это может объяснить, почему более 80% узловых белков являются ферментами. [25] Другое исследование показывает, что завязанные и скользящие узлы составляют значительное количество мембранных белков. Они составляют одну из крупнейших групп вторично-активных переносчиков. [26]
Веб-серверы для экстраполяции узловатых белков
[ редактировать ]некоторые местные программы и ряд веб-серверов Доступны , предоставляющие удобные службы запроса узловых структур и инструменты анализа для обнаружения белковых узлов, в том числе:
- Тополя [27] - Пакет Python для анализа топологии полимеров
- Knot_pull [28] - Пакет Python для сглаживания биополимеров и обнаружения узлов.
- УзелПрот 2.0 [18] [25] - База данных белков с узлами и другими запутанными структурами
- АльфаУзел 2.0 [29] [30] - База данных и сервер для анализа запутанности в структурах, предсказанных методами AlphaFold.
- pУЗЕЛ [31] - Веб-сервер для обнаружения узлов в белках
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Сюй, Мин-Фэн; Шрирамоджу, Манодж Кумар; Лай, Чи-Сюань; Чен, Юн-Ру; Хуан, Цзин-Сиу; Ко, Цзы-Пин; Хуан, Кай-Фа; Сюй, Шан-Те Дэнни (январь 2024 г.). «Структура, динамика и стабильность самого маленького и самого сложного узла из 71 белка» . Журнал биологической химии . 300 (1): 105553. doi : 10.1016/j.jbc.2023.105553 . ISSN 0021-9258 . ПМЦ 10840475 . ПМИД 38072060 .
- ^ Перлинская, Агата П.; Немышка, Ванда Х.; Грен, Бартош А.; Рубах, Павел; Сулковска, Иоанна И. (1 января 2022 г.). «Новый узел 63 и другие узлы в протеоме человека по предсказаниям AlphaFold». стр. 2021.12.30.474018. bioRxiv 10.1101/2021.12.30.474018 .
- ^ Лан, Нгуен, Май; Паулина, Перлинская, Агата; Ида, Сулковска, Джоанна; Смита, Пилла; Эмилия, Стасор; Ивона, Левандовска; Рафаль, Августыняк (2024). «Есть ли двойные узлы в белках? Прогнозирование и проверка in vitro на основе слияния TrmD-Tm1570 из C. nitroreducens» . Границы молекулярной биологии . 10 . дои : 10.3389/fmolb.2023.1223830 . ISSN 2296-889X . ПМЦ 11187310 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Бруно да Силва, Фернандо; Левандовска, Ивона; Клюза, Анна; Невецчерзал, Шимон; Августыняк, Рафал; Сулковска, Иоанна И. (14 марта 2023 г.). " "Первая кристаллическая структура белка TrmD-Tm1570 с двойным узлом - изнутри с точки зрения деградации" " . биоRxiv . дои : 10.1101/2023.03.13.532328 . S2CID 257559424 .
- ^ Роберт, Шарейн. «KnotPlot: Программное обеспечение Hypnagogic (Версия 0.1)» . Почти все изображения здесь были созданы с помощью KnotPlot, довольно сложной программы для визуализации и управления математическими узлами в трех и четырех измерениях .
- ^ Кромвель, П.Д. (2004). Узлы и Связи . Кембридж: Издательство Кембриджского университета.
- ^ Болингер, Д.; Сулковская, Дж.И.; Сюй, HP.; Мирный, Луизиана; Кардар, М. (1 апреля 2010 г.). «Белковый узел стивидора» . ПЛОС Компьютерная Биол . 6 (4): e1000731. Бибкод : 2010PLSCB...6E0731B . дои : 10.1371/journal.pcbi.1000731 . ПМЦ 2848546 . ПМИД 20369018 .
- ^ Домбровский-Туманский, Павел; Пейко, Мацей; Невецчерзал, Шимон; Стасяк, Анджей; Сулковска, Иоанна И. (12 октября 2018 г.). «Связывание белков путем активного пронизывания возникающей полипептидной цепи, выходящей из выходного канала рибосомы». Журнал физической химии Б. 122 (49): 11616–11625. doi : 10.1021/acs.jpcb.8b07634 . ISSN 1520-6106 . ПМИД 30198720 . S2CID 52176392 .
- ^ Маллам, Алабама; Джексон, ЮВ (2012). «Образование узлов во вновь транслированных белках происходит спонтанно и ускоряется шаперонинами». Nat Chem Biol . 8 (2): 147–153. дои : 10.1038/nchembio.742 . ПМИД 22179065 .
- ^ Jump up to: а б Лим, Николь Ч.; Джексон, ЮВ (30 января 2015 г.). «Механистическое понимание сворачивания узловых белков in vitro и in vivo» . Дж. Мол. Биол . 427 (2): 248–258. дои : 10.1016/j.jmb.2014.09.007 . ПМИД 25234087 .
- ^ Чжао, Яни; Домбровский-Туманский, Павел; Невецчерзал, Шимон; Сулковска, Иоанна И. (16 марта 2018 г.). «Исключительное влияние шаперонина на поведение белков с 52 узлами» . PLOS Вычислительная биология . 14 (3): e1005970. Бибкод : 2018PLSCB..14E5970Z . дои : 10.1371/journal.pcbi.1005970 . ISSN 1553-7358 . ПМК 5874080 . ПМИД 29547629 .
- ^ Кинг, Нил П.; Йейтс, Эрик О.; Йейтс, Тодд О. (октябрь 2007 г.). «Идентификация редких скользящих узлов в белках и их влияние на стабильность и сворачивание». Журнал молекулярной биологии . 373 (1): 153–166. дои : 10.1016/j.jmb.2007.07.042 . ISSN 0022-2836 . ПМИД 17764691 .
- ^ Домбровский-Туманский, Павел; Сулковска, Иоанна И. (28 марта 2017 г.). «Топологические узлы и связи в белках» . Труды Национальной академии наук . 114 (13): 3415–3420. Бибкод : 2017PNAS..114.3415D . дои : 10.1073/pnas.1615862114 . ISSN 0027-8424 . ПМК 5380043 . ПМИД 28280100 .
- ^ Бутц, Дэниел Р.; Кашио, Дуилио; Уайтлегг, Джулиан; Перри, Л. Жанна; Йейтс, Тодд О. (май 2007 г.). «Открытие термофильного белкового комплекса, стабилизированного топологически связанными цепями» . Журнал молекулярной биологии . 368 (5): 1332–1344. дои : 10.1016/j.jmb.2007.02.078 . ISSN 0022-2836 . ЧВК 1955483 . ПМИД 17395198 .
- ^ Немышка, Ванда; Домбровский-Туманский, Павел; Кадлоф, Михал; Хаглунд, Эллинор; Сулковский, Петр; Сулковска, Иоанна И. (22 ноября 2016 г.). «Сложный аркан: новые запутанные мотивы в белках» . Научные отчеты . 6 (1): 36895. Бибкод : 2016NatSR...636895N . дои : 10.1038/srep36895 . ISSN 2045-2322 . ПМК 5118788 . ПМИД 27874096 .
- ^ Домбровский-Туманский, Павел; Ярмолинская, Александра И.; Немышка, Ванда; Родон, Эрик Дж.; Миллетт, Кеннет К.; Сулковска, Иоанна И. (28 октября 2016 г.). «LinkProt: база данных, собирающая информацию о биологических связях» . Исследования нуклеиновых кислот . 45 (Д1): Д243–Д249. дои : 10.1093/nar/gkw976 . ISSN 0305-1048 . ПМК 5210653 . ПМИД 27794552 .
- ^ Лян, Чэнчжи; Мислоу, Курт (ноябрь 1994 г.). «Узлы в белках». Журнал Американского химического общества . 116 (24): 11189–11190. дои : 10.1021/ja00103a057 . ISSN 0002-7863 .
- ^ Jump up to: а б Домбровский-Туманский, Павел; Рубах, Павел; Гундарулис, Димос; Дорье, Жюльен; Сулковский, Петр; Миллетт, Кеннет К.; Родон, Эрик Дж.; Стасяк, Анджей; Сулковска, Иоанна И. (2018). «KnotProt 2.0: база данных белков с узлами и другими запутанными структурами» . Исследования нуклеиновых кислот . 47 (Д1): Д367–Д375. дои : 10.1093/nar/gky1140 . ПМК 6323932 . ПМИД 30508159 .
- ^ Мэнсфилд, Марк Л. (1994). «Есть ли узлы в белках?». Нат. Структура. Биол . 1 (4): 213–214. дои : 10.1038/nsb0494-213 . ПМИД 7656045 . S2CID 32625699 .
- ^ Тейлор, Уильям Р. (2000). «Глубоко запутанная белковая структура и то, как она может складываться». Природа . 406 (6798): 916–919. Бибкод : 2000Natur.406..916T . дои : 10.1038/35022623 . ПМИД 10972297 . S2CID 4420225 .
- ^ Вирнау, Питер; Мирный, Луизиана; Кардар, М. (2006). «Сложные узлы в белках: функции и эволюция» . ПЛОС Компьютерная Биол . 2 (9): е122. Бибкод : 2006PLSCB...2..122В . дои : 10.1371/journal.pcbi.0020122 . ПМК 1570178 . ПМИД 16978047 .
- ^ Шимчак, П. (2014). «Транслокация узловатых белков через пору». Европейский физический журнал ST . 223 (9): 1805–1812. Бибкод : 2014EPJST.223.1805S . дои : 10.1140/epjst/e2014-02227-6 . S2CID 16379224 .
- ^ Солер, Массачусетс; Нуньес, А.; Фаиска, PFN (2014). «Эффекты типа узла при сворачивании топологически сложных решетчатых белков». Дж. Хим. Физ . 141 (2): 025101. Бибкод : 2014JChPh.141b5101S . дои : 10.1063/1.4886401 . ПМИД 25028045 .
- ^ Домбровский-Туманский, Павел; Стасяк, Анджей; Сулковска, Иоанна И. (2 ноября 2016 г.). «В поисках функциональных преимуществ узлов в белках» . ПЛОС ОДИН . 11 (11): e0165986. Бибкод : 2016PLoSO..1165986D . дои : 10.1371/journal.pone.0165986 . ISSN 1932-6203 . ПМК 5091781 . ПМИД 27806097 .
- ^ Jump up to: а б Джамроз, М; Немышка В; Родон Э.Дж.; Стасяк А; Миллетт К.С.; Сулковский П; Сулковская Дж.И. (2015). «KnotProt: база данных белков с узлами и скользящими узлами» . Исследования нуклеиновых кислот . 43 (База данных): D306–D314. дои : 10.1093/nar/gku1059 . ПМК 4383900 . ПМИД 25361973 .
- ^ Заяц, Василина; Сикора, Мацей; Перлинская, Агата П.; Стасюлевич, Адам; Грен, Бартош А.; Сулковска, Иоанна И. (2 ноября 2023 г.). «Сохранение завязанной и скользящей топологии в трансмембранных транспортерах» . Биофизический журнал . 122 (23): 4528–4541. Бибкод : 2023BpJ...122.4528Z . дои : 10.1016/j.bpj.2023.10.031 . ISSN 0006-3495 . ПМЦ 10719070. ПМИД 37919904 .
- ^ Домбровский-Туманский, Павел; Рубах, Павел; Немышка, Ванда; Грен, Бартош Амбрози; Сулковска, Джоанна Ида (16 сентября 2020 г.). «Topoly: пакет Python для анализа топологии полимеров» . Брифинги по биоинформатике . 22 (3). дои : 10.1093/нагрудник/bbaa196 . ISSN 1467-5463 . ПМЦ 8138882 . ПМИД 32935829 .
- ^ Ярмолинская, А.И.; Гамбин А; Сулковская Дж.И. (2019). «Knot_pull — пакет Python для сглаживания биополимеров и обнаружения узлов» . Биоинформатика . 36 (3): 953–955. doi : 10.1093/биоинформатика/btz644 . ПМЦ 9883683 . ПМИД 31504154 .
- ^ Немышка, Ванда; Рубах, Павел; Грен, Бартош А; Нгуен, Май Лан; Гарстка, Войцех; Бруно да Силва, Фернандо; Родон, Эрик Дж; Сулковска, Иоанна I (24 мая 2022 г.). «AlphaKnot: сервер для анализа запутанности в структурах, предсказанных методами AlphaFold» . Исследования нуклеиновых кислот . 50 (П1): Н44–Н50. дои : 10.1093/nar/gkac388 . ISSN 0305-1048 . ПМЦ 9252816 . ПМИД 35609987 .
- ^ Рубах, Павел; Сикора, Мацей; Ярмолинская, Александра I; Перлинская, Агата П; Сулковска, Иоанна I (6 июня 2024 г.). «AlphaKnot 2.0: веб-сервер для визуализации завязывания белков и база данных завязанных моделей, предсказанных AlphaFold» . Исследования нуклеиновых кислот . дои : 10.1093/nar/gkae443 . ISSN 0305-1048 . ПМЦ 11223836 . ПМИД 38842945 .
- ^ Лай, Ю.-Л.; Йен, Южная Каролина; Ю, С.-Х.; Хван, Ж.-К. (7 мая 2007 г.). «pKNOT: белковый веб-сервер KNOT» . Исследования нуклеиновых кислот . 35 (Веб-сервер): W420–W424. дои : 10.1093/нар/gkm304 . ЧВК 1933195 . ПМИД 17526524 .