ПБТ2
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
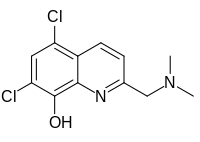
5,7-Дихлор-2-[(диметиламино)метил]хинолин-8-ол | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 12 Н 12 Cl 2 Н 2 О | |
| Молярная масса | 271.14 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
PBT2 — безопасный для человека ионофор цинка. [ 1 ] и экспериментальный кандидат на лекарство. Это 8-гидроксихинолина второго поколения. аналог [ 2 ] призван стать преемником клиохинола и потенциальным средством лечения болезни Альцгеймера. [ 3 ] и болезнь Хантингтона .
Клинические испытания
[ редактировать ]PBT2 был предметом трех клинических исследований фазы II по лечению болезни Альцгеймера («ЕВРО»), [ 4 ] «IMAGINE» и «IMAGINE EXTENSION») и один для болезни Гентингтона («REACH2HD») [ 5 ] пробный.
Результаты эффективности познания при болезни Альцгеймера были неоднозначными. Исследование EURO показало некоторые улучшения когнитивных функций, в частности исполнительных функций, тогда как исследование IMAGINE этого не показало. [ 6 ] [ 7 ] [ 8 ] [ 9 ] Хотя нет никаких доказательств того, что PBT2 приносит какую-либо пользу при деменции Альцгеймера, [ 10 ] Число субъектов, получавших PBT2 от БА в плацебо-контролируемых исследованиях фазы II (N~76), ограничено, и исследования не были направлены на выявление когнитивных результатов. В исследовании фазы II PBT2 при болезни Хантингтона, хотя общие показатели когнитивной совокупности не улучшились, область исполнительных функций в этой совокупности была значительно улучшена. [ 6 ] [ 7 ]
Исследования фазы II при AD
[ редактировать ]PBT2-201 (EURO) представляло собой 12-недельное рандомизированное двойное слепое плацебо-контролируемое параллельное исследование в трех группах (фаза II) для оценки безопасности, переносимости и эффективности двух доз PBT2 для замедления прогрессирования заболевания у пациентов с ранним АД. В исследование были включены семьдесят восемь (78) пациентов, и все они были оценены на предмет безопасности и эффективности. Лечение PBT2 в дозе 50 и 250 мг в день хорошо переносилось пациентами с AD в течение 12 недель лечения, при этом имеются некоторые доказательства того, что доза PBT2 в дозе 250 мг/день может модулировать определенные биомаркеры, связанные с AD, в частности, значительное снижение уровней аббеты в спинномозговой жидкости, и улучшение аспектов когнитивных функций, измеряемых совокупным z-показателем исполнительных функций, а также индивидуальным тестом по созданию маршрутов (TMT), часть B, и тестами на беглость категории. [ 8 ]
PBT2-204 (IMAGINE) представляло собой 12-месячное исследование визуализации амилоида головного мозга, в ходе которого пациентам с легкой формой БА (n=42) вводили PBT2 в дозе 250 мг или плацебо. В исследование были включены сорок два (42) пациента, и все они были оценены на предмет безопасности и эффективности. Было показано, что PBT2 безопасен и очень хорошо переносится в течение 52 недель, при этом профиль нежелательных явлений эквивалентен между группами, получавшими плацебо, и группами, получавшими лечение. По данным PiB, не было различий в уровнях амилоида в мозге между группами, получавшими PBT2 и плацебо. [ 9 ]
PBT2-204-Ext (расширение) [ 11 ] Тридцать три (n=33) пациента продолжили прием 250 мг PBT2 в открытом расширенном исследовании и были оценены на предмет безопасности и эффективности, при этом n=27 пациентов завершили исследование. Результаты безопасности показывают, что длительное лечение (до 104 недель) 250 мг PBT2 хорошо переносилось пациентами с продромальным или легким течением болезни Альцгеймера. Результаты этого исследования по безопасности согласуются с теми, которые можно было бы ожидать в популяции пожилых людей с продромальным или легким течением болезни Альцгеймера.
Исследование фазы II в HD
[ редактировать ]ПБТ2-203 (Reach2HD) [ 5 ] представляло собой 6-месячное исследование безопасности, переносимости и эффективности при ГБ. Пациенты с ранней и средней стадией ГБ (n=109) получали PBT2 100 мг, PBT2 250 мг или плацебо один раз в день. Основная цель исследования заключалась в оценке безопасности и переносимости двух доз PBT2 (100 мг и 250 мг один раз в день) по сравнению с плацебо через 26 недель у участников с ранней и средней стадией ГБ. Было показано, что PBT2 безопасен и хорошо переносится в течение 26 недель, при этом профиль нежелательных явлений эквивалентен между группами плацебо и PBT2.
Вторичные цели исследования были сосредоточены на конкретных симптомах или проявлениях ГБ. Основная цель исследования эффективности состояла в том, чтобы определить влияние PBT2 на когнитивные функции, измеренное с помощью набора когнитивных тестов, состоящего из теста беглости категорий, частей A и B TMT, поиска по карте, теста модальностей символов и цифр, теста чтения слов по Струпу, ускоренного постукивания. Задача и МоСА. Результаты этих оценок были использованы для расчета трех составных z-показателей познания: основного составного z-показателя, исследовательского составного z-показателя и z-показателя исполнительных функций.
В ходе исследования PBT2 показал признаки улучшения некоторых аспектов когнитивных функций. Доза 250 мг PBT2, принимаемая один раз в день, показала лучшую и статистически значимую эффективность в течение 12-недельного периода лечения по сравнению с плацебо по основному комбинированному показателю когнитивных функций (p = 0,020), исследовательскому комбинированному z-показателю когнитивных функций (p = 0,016). , композитный показатель Z управляющих функций (p = 0,005) и TMT Part B (p <0,001), инструмент когнитивной оценки. Через 26 недель показатели ТМТ, часть B, были статистически значимо улучшены (p=0,042), а совокупный z-показатель управляющих функций имел тенденцию к улучшению. У пациентов с ранней стадией ГБ (общая функциональная способность 11–13) совокупный z-показатель исполнительной функции был статистически значимо улучшен (p=0,038).
В целом результаты показывают, что необходимы более крупные исследования для полной оценки профиля безопасности и эффективности PBT2 при AD и HD. [ 10 ] [ 5 ]
Другие приложения
[ редактировать ]PBT2 изучался на предмет его потенциального использования при лечении инфекций, вызванных бактериями с множественной лекарственной устойчивостью . [ 12 ] [ 13 ] Было показано, что в сочетании с цинком PBT2 обращает вспять устойчивость к антибиотикам ряда клинически значимых бактериальных патогенов, включая Streptococcus pneumoniae, метициллин-резистентный Staphylococcus aureus (MRSA), группы А стрептококк (GAS) и ванкомицин-резистентный Enterococcus (VRE). как in vitro, так и на модели заражения мышей . [ 1 ] [ 13 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Больманн, Лиза; Де Оливейра, Дэвид, член парламента; Эль-Диб, Ибрагим М.; Бразел, Эрин Б.; Харбисон-Прайс, Никаэла; Онг, Шерил-Линн Ю.; Ривера-Эрнандес, Таня; Фергюсон, Скотт А.; Корк, Аманда Дж.; Фан, Минь-Дуй; Содерхольм, Амелия Т.; Дэвис, Марк Р.; Ниммо, Грэм Р.; Дуган, Гордон; Шембри, Марк А.; Кук, Грегори М.; Макьюэн, Аластер Г.; фон Ицштайн, Марк; Макдевитт, Кристофер А.; Уокер, Марк Дж.; Клайн, Кимберли А. (11 декабря 2018 г.). «Химическая синергия между ионофором PBT2 и цинком обращает вспять устойчивость к антибиотикам» . мБио . 9 (6). дои : 10.1128/mBio.02391-18 . ПМК 6299484 . ПМИД 30538186 .
- ^ Адлард, Пол А.; Черный, Роберт А.; Финкельштейн, Дэвид И.; Готье, Элизабет; Робб, Элизия; Кортес, Михалина; Волитакис, Ирен; Лю, Сян; и др. (2008). «Быстрое восстановление когнитивных функций у трансгенных мышей с болезнью Альцгеймера с помощью аналогов 8-гидроксихинолина связано со снижением интерстициального Aβ» . Нейрон . 59 (1): 43–55. дои : 10.1016/j.neuron.2008.06.018 . ПМИД 18614028 .
- ^ Дуче, Джеймс А.; Цацанис, Андрей; Катер, Майкл А.; Джеймс, Саймон А.; Робб, Элизия; Вихе, Крутика; Леонг, Су Лин; Перес, Кейла; и др. (2010). «Фероксидазная активность экспорта железа белка-предшественника β-амилоида ингибируется цинком при болезни Альцгеймера» . Клетка . 142 (6): 857–67. дои : 10.1016/j.cell.2010.08.014 . ПМК 2943017 . ПМИД 20817278 .
- «Обнаружена функция белка болезни Альцгеймера» . ScienceDaily (пресс-релиз). 10 сентября 2010 г.
- ^ Ланнфельт, Л; и др. (2008). « Безопасность, эффективность и данные о биомаркерах PBT2 при нацеливании на Абета в качестве модифицирующей терапии болезни Альцгеймера: фаза IIa, двойное слепое, рандомизированное, плацебо-контролируемое исследование» « . Ланцет Нейрол . 7 (9): 779–786. дои : 10.1016/s1474-4422(08)70167-4 . ПМИД 18672400 . S2CID 44765010 .
- ^ Перейти обратно: а б с Исследовательская группа Хантингтона Reach2HD Investigators (2015). «Безопасность, переносимость и эффективность PBT2 при болезни Хантингтона: рандомизированное двойное слепое плацебо-контролируемое исследование фазы 2». Ланцет Нейрол . 14 (1): 39–47. дои : 10.1016/S1474-4422(14)70262-5 . ПМИД 25467848 . S2CID 7199604 .
{{cite journal}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Перейти обратно: а б «Prana Biotech упала на 76%; препарат не прошел исследование болезни Альцгеймера»
- ^ Перейти обратно: а б «PBT2 принимает участие во второй фазе исследования болезни Альцгеймера»
- ^ Перейти обратно: а б Ланнфельт, Л; и др. (2008). «Безопасность, эффективность и результаты биомаркеров PBT2 при нацеливании на Абета в качестве модифицирующей терапии болезни Альцгеймера: двойное слепое рандомизированное плацебо-контролируемое исследование фазы IIa». Ланцет Нейрол . 7 (9): 779–786. дои : 10.1016/s1474-4422(08)70167-4 . ПМИД 18672400 . S2CID 44765010 .
- ^ Перейти обратно: а б «Прана Биотехнология объявляет о главных результатах второй фазы исследования IMAGINE по применению PBT2 при болезни Альцгеймера» . 31 марта 2014 г.
- ^ Перейти обратно: а б «Нет никаких доказательств того, что MPAC (PBT1 или PBT2) полезны при деменции Альцгеймера»
- ^ «Прана объявляет о результатах исследования безопасности IMAGINE Extension» . 30 июня 2015 г.
- ^ Мельбурнский университет (12 января 2022 г.). «Преодоление устойчивости бактерий к антибиотикам для спасения передовых лекарств» .
- ^ Перейти обратно: а б Бразел, Эрин Б.; Тан, Эйми; Невилл, Стефани Л.; Айверсон, Эми Р.; Удагедара, Саумья Р.; Каннингем, Блисс А.; Сиканьика, Мвилье; Оливейра, Дэвид MP Де; Келлер, Бернхард; Больманн, Лиза; Эль-Диб, Ибрагим М. (11 января 2022 г.). «Нарушение регуляции гомеостаза цинка Streptococcus pneumoniae нарушает устойчивость к ампициллину на модели пневмонии» . Отчеты по ячейкам . 38 (2): 110202. doi : 10.1016/j.celrep.2021.110202 . ISSN 2211-1247 . ПМЦ 9084593 . ПМИД 35021083 . S2CID 245890773 .