Термометрическое титрование
Эта статья включает список литературы , связанную литературу или внешние ссылки , но ее источники остаются неясными, поскольку в ней отсутствуют встроенные цитаты . ( Октябрь 2008 г. ) |

Термометрическое титрование — это один из многих инструментального титрования методов , при которых конечные точки можно точно и точно определить без субъективной интерпретации со стороны аналитика относительно их местоположения. Изменение энтальпии , возможно, является наиболее фундаментальным и универсальным свойством химических реакций, поэтому наблюдение за изменением температуры является естественным выбором для мониторинга их хода. Это не новый метод, возможно, о первом известном методе термометрического титрования сообщалось в начале 20 века (Bell and Cowell, 1913). Несмотря на свои привлекательные особенности, несмотря на значительные исследования, проведенные в этой области, и большое количество разработанных приложений; До сих пор этот метод использовался недостаточно в критически важной области промышленных процессов и контроля качества. Автоматизированные системы потенциометрического титрования преобладали в этой области с 1970-х годов. С появлением дешевых компьютеров, способных работать с мощным программным обеспечением для термометрического титрования, развитие достигло той стадии, когда простые в использовании автоматизированные системы термометрического титрования во многих случаях могут предложить превосходную альтернативу потенциометрической титриметрии.
Сравнение потенциометрического и термометрического титрования
[ редактировать ]Потенциометрическая титриметрия является преобладающим автоматизированным титриметрическим методом с 1970-х годов, поэтому стоит рассмотреть основные различия между ней и термометрической титриметрией.
Потенциометрическое титрование основано на изменении свободной энергии в реакционной системе. Необходимо измерение члена, зависящего от свободной энергии.
- ΔΔG 0 = - RT ln К (1)
Где:
- ΔG 0 = изменение свободной энергии
- R = универсальная газовая постоянная
- T = температура в кельвинах (K) или градусах Рэнкина (°R).
- K = константа равновесия при температуре T
- ln — функция натурального логарифма
Чтобы реакция поддавалась потенциометрической титриметрии, изменение свободной энергии должно быть достаточным для того, чтобы соответствующий датчик отреагировал значительным перегибом (или «изломом») на кривой титрования , где ответ датчика отображается в зависимости от количества титранта. доставленного .
Однако свободная энергия — это лишь один из трех связанных параметров, описывающих любую химическую реакцию:
- Δ Н 0 = ΔG 0 + Т Δ С 0 (2)
где:
- Δ Н 0 = изменение энтальпии
- ΔΔG 0 = изменение свободной энергии
- ΔΔS 0 = изменение энтропии
- T = температура в К
Для любой реакции, в которой свободной энергии не противодействует изменение энтропии, изменение энтальпии будет значительно больше, чем свободная энергия. Таким образом, титрование, основанное на изменении температуры (что позволяет наблюдать изменение энтальпии), покажет больший перегиб, чем кривые, полученные с помощью датчиков, реагирующих только на изменения свободной энергии.
Термометрическое титрование
[ редактировать ]При термометрическом титровании титрант добавляют к титранду с известной постоянной скоростью до тех пор, пока об окончании реакции не будет свидетельствовать изменение температуры. Конечная точка определяется перегибом кривой, создаваемой выходным сигналом устройства измерения температуры.
Рассмотрим реакцию титрования:
- а А + б В = п П (3)
Где:
- A = титрант и a = соответствующее количество молей, реагирующих
- B = аналит и b = соответствующее количество молей, реагирующих
- P = продукт и p = соответствующее количество произведенных молей.
По завершении реакции выделяется молярное тепло реакции Δ H r , которое отображается как измеримое изменение температуры Δ T . В идеальной системе, где не происходит никаких потерь или прироста тепла из-за воздействия окружающей среды, течение реакции наблюдается как постоянное повышение или понижение температуры в зависимости соответственно от того, является ли Δ H r отрицательным (что указывает на экзотермическую реакцию) или положительный (указывает на эндотермическую реакцию). В этом контексте воздействия окружающей среды могут включать (в порядке значимости):

- Потери или поступления тепла извне системы через стенки и крышку резервуара;
- Различия в температуре между титрантом и титрантом;
- Потери на испарение с поверхности быстроперемешиваемой жидкости;
- Теплота раствора при смешивании титранта с растворителем аналита;
- Тепло, вносимое механическим действием перемешивания (незначительное влияние); и
- Тепло, выделяемое самим термистором (очень незначительное влияние).
Если равновесие реакции находится далеко вправо (т.е. достигнуто стехиометрическое равновесие), то когда все аналиты прореагировали с титрантом, продолжающееся добавление титранта будет проявляться по резкому излому кривой температура/объем. Рисунки 1а и 1б иллюстрируют идеализированные примеры.

Форма экспериментально полученных графиков термометрического титрования будет отличаться от таких идеализированных примеров, и некоторые из перечисленных выше воздействий окружающей среды могут иметь влияние. Может наблюдаться искривление в конечной точке. Это может быть связано с нечувствительностью датчика или с медленным наступлением теплового равновесия в конечной точке. Это также может произойти, когда реакция между титрантом и титрандом не доходит до стехиометрического завершения. Определяющим фактором того, до какой степени реакция продвинется до завершения, является изменение свободной энергии. Если это благоприятствует, то реакция будет доведена до завершения и будет по существу стехиометрической. В этом случае резкость конечной точки зависит от величины изменения энтальпии. Если это неблагоприятно, конечная точка будет округлена независимо от величины изменения энтальпии. Реакции, в которых очевидно нестехиометрическое равновесие, можно использовать для получения удовлетворительных результатов с использованием подхода термометрического титрования. Если части кривой титрования как до, так и после конечной точки достаточно линейны, то пересечение касательных к этим линиям позволит точно определить конечную точку. Это показано на рисунке 2.
Рассмотрим реакцию для уравнения a A + b B = p P, которая в равновесии нестехиометрична. Пусть А представляет собой титрант, а В — титранд. В начале титрования титранд В находится в сильном избытке, и реакция приближается к завершению. В этих условиях при постоянной скорости добавления титранта повышение температуры является постоянным, и кривая практически линейна до тех пор, пока не будет достигнута конечная точка. Аналогичным образом, когда избыток титранта превышает конечную точку, можно также ожидать линейную температурную реакцию. Таким образом, пересечение касательных покажет истинную конечную точку.
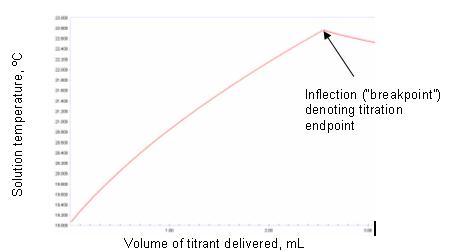
Фактический график термометрического титрования для определения сильного основания показан сильной кислотой на рисунке 3.

Было обнаружено, что наиболее практичным датчиком для измерения изменения температуры титруемых растворов является термистор. Термисторы — это небольшие твердотельные устройства, которые демонстрируют относительно большие изменения электрического сопротивления при небольших изменениях температуры. Они изготовлены из спеченных смешанных оксидов металлов и снабжены проводами, позволяющими подключаться к электрическим схемам. Термистор заключен в подходящую электроизоляционную среду с удовлетворительными характеристиками теплопередачи и приемлемой химической стойкостью. Обычно для термисторов, используемых для химического анализа, герметизирующей средой является стекло, хотя термисторы, герметизированные эпоксидной смолой, могут использоваться в обстоятельствах, когда ожидается либо химическое воздействие (например, кислыми растворами, содержащими фторид), либо серьезное механическое напряжение. Термистор поддерживается подходящей электронной схемой, обеспечивающей максимальную чувствительность к малейшим изменениям температуры раствора. Схема интерфейсного модуля термометрического титрования Metrohm 859 Titrotherm способна распознавать изменения температуры всего в 10 градусов. −5 К.
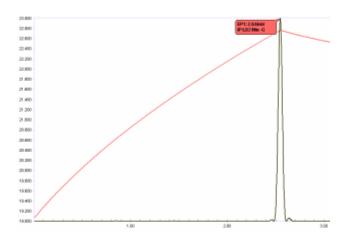
Важнейшим элементом современной автоматизированной термометрической титриметрии является возможность определения конечной точки с высокой степенью воспроизводимости. явно непрактично и недостаточно для современных требований точности и прецизионности Оценивать перегиб по пересечению касательных . Это удобно сделать путем дериватизации температурной кривой. Вторая производная по существу определяет место пересечения касательных к температурной кривой непосредственно до и после точки излома.
Термисторы быстро реагируют на небольшие изменения температуры, например, на температурные градиенты в смешанном растворе для титрования, поэтому сигнал может иметь небольшой шум. Поэтому перед дериватизацией необходимо сгладить (или «отфильтровать») температурную кривую в цифровом виде, чтобы получить резкие, симметричные «пики» второй производной, которые позволят точно определить правильную точку перегиба. Это показано на рисунке 5. Степень цифрового сглаживания оптимизируется для каждого определения и сохраняется как параметр метода для применения каждый раз, когда выполняется титрование для данного конкретного анализа.
Поскольку изменение энтальпии является универсальной характеристикой химических реакций, термометрическое определение конечной точки может применяться к широкому диапазону типов титрования, например
взаимодействие с титровым раствором Кроме того, поскольку сенсору не требуется электрохимическое , можно проводить титрование в непроводящих средах, а также титрование с использованием реакций, для которых нет удобного или экономически эффективного потенциометрического датчика.
Термометрическое титрование обычно требует быстрой кинетики реакции , чтобы получить четкие воспроизводимые конечные точки. Если кинетика реакции медленная и прямое титрование между титрантом и титрандом невозможно, для решения проблемы часто можно использовать непрямое или обратное титрование.
Каталитически улучшенные конечные точки можно использовать в некоторых случаях, когда изменение температуры в конечной точке очень мало и конечные точки не могут быть удовлетворительно обнаружены программным обеспечением для титрования.
Пригодность конкретной химической реакции в качестве кандидата для процедуры термометрического титрования обычно можно предсказать на основе предполагаемого количества аналита, присутствующего в образце, и энтальпии реакции. Однако на результат могут повлиять другие параметры, такие как кинетика реакции, матрица образца сама , теплота разбавления и потери тепла в окружающую среду. Правильно разработанная экспериментальная программа является наиболее надежным способом определения жизнеспособности метода термометрического титрования. Успешное применение термометрического титрования обычно происходит там, где кинетика реакции титрант-титран быстрая, а химическое равновесие является стехиометрическим или почти стехиометрическим.
В каких случаях может быть рекомендовано определение термометрического титрования
[ редактировать ]- Аналитик хочет упростить проведение различных титрований, используя один датчик для всех. Например, лаборатория может регулярно проводить кислотно-основное, окислительно-восстановительное, комплексометрическое, сульфатное и хлоридное титрование. Один термометрический датчик в сочетании с автосамплером позволит выполнять все титрования с одной и той же загрузкой карусели без необходимости замены датчиков титрования. После подготовки проб и размещения их в карусели аналитик назначает соответствующий термометрический метод положению стакана на карусели.
- Среда титрования считается непригодной для обычных датчиков титрования. Например, для правильной работы рН-электроды со стеклянной мембраной необходимо поддерживать в достаточном состоянии гидратированными. Использование таких электродов в практически неводных средах, например, при определении следов кислот в липидах и смазочных маслах, может привести к потере производительности по мере загрязнения и обезвоживания мембраны и/или частичной или полной блокировки контрольного спая. Часто необходимо постоянно использовать несколько электродов в программе омоложения, чтобы справиться с аналитической нагрузкой. Термометрические датчики не имеют электрохимического взаимодействия с титрующим раствором и поэтому могут использоваться непрерывно практически без технического обслуживания. Аналогичным образом, потенциометрическое титрование сульфата хлоридом бария в различных промышленных образцах может привести к быстрой деградации индикаторного ионселективного электрода бария.
- Методика термометрического титрования, которую нельзя имитировать с использованием других типов датчиков титрования, обеспечит превосходные результаты или результаты, которые иным образом недостижимы другими методами. Примерами являются определение фторида титрованием борной кислотой, анализ ортофосфата титрованием ионами магния, прямое титрование алюминия ионами фтора.
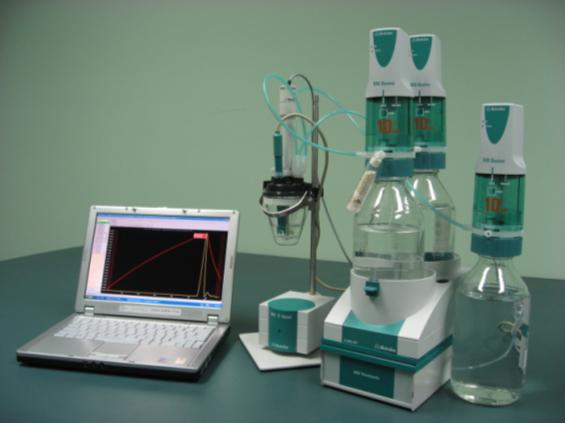
Аппаратура и установка для автоматизированной термометрической титриметрии
[ редактировать ]Подходящая установка для автоматизированной термометрической титриметрии включает в себя следующее:
- Прецизионные дозаторы жидкости – «бюретки» – для добавления титрантов и дозирования других реагентов.
- Термометрический датчик на основе термистора
- Сосуд для титрования
- Перемешивающее устройство, способное высокоэффективно перемешивать содержимое сосуда без разбрызгивания.
- Компьютер с операционной системой термометрического титрования.
- Интерфейсный модуль термометрического титрования – регулирует поток данных между бюретками, датчиками и компьютером.
На рисунке 6 показана современная автоматизированная система термометрического титрования на базе интерфейсного модуля Metrohm 859 Titrotherm с датчиком Thermoprobe, дозирующих устройств Metrohm 800 Dosino и компьютера, на котором установлено операционное программное обеспечение.

На рисунке 7 представлена схема взаимоотношений между компонентами в автоматизированной системе термометрического титрования.
A = дозирующее устройство
B = термометрический датчик
C = перемешивающее устройство
D = интерфейсный модуль термометрического титрования
Э = компьютеры
Виды термометрического титрования
[ редактировать ]Приложения термометрической титриметрии взяты из основных групп, а именно:
- Кислотно-основное титрование
- Редокс-титрование
- Преципитационное титрование
- Комплексометрическое титрование
Поскольку датчик не взаимодействует ни электрически, ни электрохимически с раствором, электропроводность титрующей среды не является обязательным условием для определения. При необходимости титрование можно проводить в полностью непроводящих и неполярных средах. Кроме того, титрование можно проводить в мутных растворах или даже суспензиях твердых веществ, а также можно рассмотреть возможность титрования, когда осадки представляют собой продукты реакции. Диапазон возможных применений термометрического титрования намного превышает реальный опыт автора, и в некоторых случаях читатель будет отослан к соответствующей литературе.
Кислотно-основное титрование
[ редактировать ]
Определение полностью диссоциированных кислот и оснований.
[ редактировать ]Теплота нейтрализации полностью диссоциированной кислоты полностью диссоциированным основанием составляет примерно –56 кДж/моль. Таким образом, реакция является сильно экзотермической и является отличной основой для широкого спектра анализа в промышленности. Преимущество для промышленного аналитика состоит в том, что использование более сильных титрантов (от 1 до 2 моль/л) позволяет уменьшить объем подготовки проб, и пробы часто можно напрямую и точно дозировать в титровальный сосуд перед титрованием.

Титрование слабых кислот
[ редактировать ]Слабо диссоциированные кислоты дают резкие термометрические конечные точки при титровании сильным основанием. Например, бикарбонат можно однозначно определить наряду с карбонатом титрованием гидроксилом (Δ 0 H r =-40,9 кДж/моль).
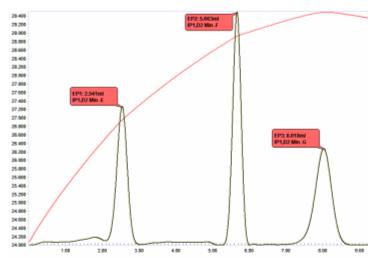
Титрование смесей кислот
[ редактировать ]Смеси комплексных кислот можно разделить термометрическим титрованием стандартным водным раствором NaOH. В смеси азотной, уксусной и фосфорной кислот, используемой при производстве полупроводников, на основе констант диссоциации кислот можно предсказать три конечные точки:
| Конечная точка 1 | Конечная точка 2 | Конечная точка 3 |
|---|---|---|
| ДЕНЬ 3
(pK а = -1,3) |
ТСЖ
(pK а = 4,75) |
|
| Н 3 ПО 4
(pK a 1 = 2,12) |
Н 3 ПО 4
(pK a 2 = 7,21) |
Н 3 ПО 4
(pK a 3 = 12,36) |
Ключом к определению количества каждой кислоты, присутствующей в смеси, является возможность получить точное значение количества присутствующей фосфорной кислоты, определяемое титрованием третьего протона H 3 PO 4 .
На рисунке 10 показан график титрования этой смеси, показывающий 3 резкие конечные точки.
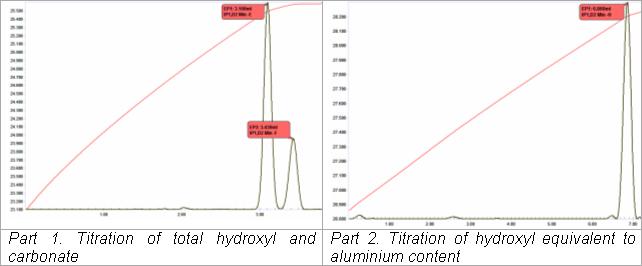
Титрование сложных щелочных растворов
[ редактировать ]Термометрически-титриметрический анализ раствора алюмината натрия (« щелок Байера ») при производстве глинозема из бокситов осуществляют в автоматизированной двухтитровальной последовательности. Это адаптация классического метода термометрического титрования (VanDalen and Ward, 1973). При первом титровании к аликвоте раствора добавляют раствор тартрата для образования комплекса алюмината, высвобождая один моль гидроксила на каждый моль присутствующего алюмината. Его титруют ацидиметрически вместе с наличием «свободного» гидроксила и содержанием карбоната (в качестве второй конечной точки). Второму титрованию предшествует автоматическое добавление раствора фторида. Комплекс оксида алюминия-тартрата разрушается с образованием комплекса фторида алюминия и сопутствующим высвобождением трех молей гидроксила на каждый моль присутствующего алюминия, которые затем титруют ацидиметрически. Все определение может быть выполнено менее чем за 5 минут.

Неводное кислотно-основное титрование
[ редактировать ]Неводное кислотно-основное титрование можно преимущественно проводить термометрическим методом.
Растворы кислотного выщелачивания на некоторых медных рудниках могут содержать большие количества Fe(III), а также Cu(II). Содержание «свободной кислоты» ( серной кислоты ) в этих выщелачивающих растворах является критическим параметром процесса. Хотя термометрическая титриметрия позволяет определить содержание свободной кислоты при небольших количествах Fe(III), в некоторых растворах содержание Fe(III) настолько велико, что вызывает серьезные помехи. Комплексообразование с обязательно большим количеством оксалата нежелательно из-за токсичности реагента. Термометрическое титрование проводили путем разбавления аликвоты пропан-2-олом и титрования стандартным КОН в пропан-2-оле. Большая часть содержания металлов выпадала в осадок до начала титрования, и была получена четкая и четкая конечная точка содержания серной кислоты.

Катализируемое термометрическое кислотно-основное титрование по конечной точке
[ редактировать ]Определение следовых кислот в органических матрицах является распространенной аналитической задачей, выполняемой титриметрией. Примерами являются общее кислотное число (ОКА) в минеральных и смазочных маслах и свободные жирные кислоты (СЖК) в пищевых жирах и маслах. Процедурам автоматизированного потенциометрического титрования присвоен статус стандартного метода, например, ASTM для TAN и AOAC для FFA. Методика в обоих случаях одинакова. Образец растворяют в подходящей смеси растворителей; скажем, углеводород и спирт, которые также должны содержать небольшое количество воды. Вода предназначена для повышения электропроводности раствора. Следовые кислоты титруют стандартным основанием в спирте. Среда пробы по существу враждебна по отношению к pH-электроду, используемому для определения титрования. Электрод необходимо регулярно выводить из эксплуатации для регидратации стеклянной чувствительной мембраны, которая также подвержена риску загрязнения маслянистым раствором пробы.
Недавняя термометрически-титриметрическая процедура определения СЖК, разработанная Cameiro et al. (2002) было показано, что они особенно поддаются автоматизации. Он быстрый, очень точный, и результаты очень хорошо согласуются с результатами, полученными официальным методом AOAC. Изменение температуры при титровании очень слабых кислот, таких как олеиновая кислота, 0,1 моль/л КОН в пропан-2-оле слишком мало, чтобы получить точную конечную точку. В этой процедуре перед титрованием к титранду добавляют небольшое количество параформальдегида в виде мелкодисперсного порошка. В конечном итоге первый избыток гидроксильных ионов катализирует деполимеризацию параформальдегида. Реакция сильно эндотермична и дает резкий перегиб. График титрования показан на рисунке 13. Скорость этого титрования в сочетании с его точностью и аккуратностью делает его идеальным для анализа СЖК в биодизельном сырье и продуктах.
Редокс-титрование
[ редактировать ]Титрование перманганатом и дихроматом
[ редактировать ]Окислительно-восстановительные реакции обычно сильно экзотермичны и могут стать отличными кандидатами для термометрического титрования. При классическом определении ионов двухвалентного железа перманганатом энтальпия реакции более чем в два раза превышает энтальпию реакции сильной кислоты/сильного основания: Δ 0 Ч р = −123,9 кДж/моль Fe. Определение пероксида водорода перманганатным титрованием является еще более экзотермичным при Δ 0 Ч р = −149,6 кДж/моль H 2 O 2
Титрование тиосульфатом
[ редактировать ]При определении гипохлорита (например, в коммерческих составах отбеливателей) можно использовать прямое титрование тиосульфатом, не прибегая к йодометрическому анализу.
- ClO − + Н 2 О + 2е − ↔ Кл − + 2ОН −
- 2S O2S2O3 2− ↔ С 4 О 6 2− + 2е −
- 2S2O2S2O3 2− +ClO − +Н 2 О ↔ С 4 О 6 2− +Cl − +2ОН −
Также практично термометрическое йодометрическое титрование с использованием тиосульфата в качестве титранта, например, при определении Cu(II). В этом случае было обнаружено преимущество включения реагента йодида калия в титрант тиосульфата в таких пропорциях, чтобы йод высвобождался в раствор непосредственно перед его восстановлением тиосульфатом. Это минимизирует потери йода в ходе титрования.
Титрование гипохлоритом
[ редактировать ]будучи относительно нестабильным и требующим частой стандартизации, Гипохлорит натрия, использовался в методе очень быстрого термометрического титрования для определения ионов аммония. Это альтернатива классическому подходу отгонки аммиака из основного раствора и последующего кислотно-основного титрования. Термометрическое титрование проводят в бикарбонатном растворе, содержащем бромид-ион (Браун и др., 1969).

Комплексометрическое (ЭДТА) титрование
[ редактировать ]Термометрическое титрование с использованием натриевых солей этилендиаминтетрауксусной кислоты (ЭДТА) было продемонстрировано для определения ряда ионов металлов. Энтальпии реакции умеренные, поэтому титрование обычно проводят с концентрацией титранта 1 моль/л. Это требует использования тетранатриевой соли ЭДТА, а не более распространенной динатриевой соли, которая является насыщенной при концентрации всего лишь приблизительно 0,25 моль/л.
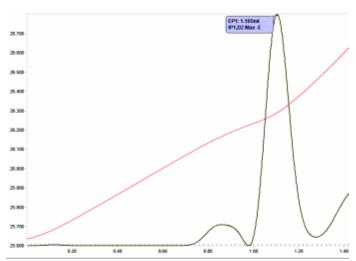
Отличным применением является последовательное определение кальция и магния. Хотя кальций реагирует с ЭДТА экзотермически (теплота хелатирования ~-23,4 кДж/моль), магний реагирует эндотермически с теплотой хелатирования ~+20,1 кДж/моль. Это иллюстрируется графиком титрования ЭДТА кальцием и магнием в морской воде (рис. 14). Следуя кривой температуры раствора, за точкой излома содержания кальция (конечная точка, отмеченная красной меткой) следует область умеренного повышения температуры из-за конкуренции между теплотами разбавления титранта раствором и эндотермической реакции Mg. 2+ и ЭДТА. Точка останова по потреблению Mg 2+ (конечная точка с синей меткой) для ЭДТА обнаруживается по повышению температуры, вызванному исключительно теплотой разбавления.

Прямое титрование ЭДТА ионами металлов возможно, когда кинетика реакции быстрая, например, цинка, меди, кальция и магния. Однако при более медленной кинетике реакции, такой как реакция кобальта и никеля, используется обратное титрование. Титрование кобальта и никеля проводят в аммиачной среде; забуференный раствором аммиака:хлорида аммония. Добавляют избыток ЭДТА и проводят обратное титрование раствором Cu(II). Предполагается, что точка разрыва определяется разницей в энтальпиях реакций образования комплекса Cu-ЭДТА и образования комплекса Cu-амина.
В катализированной процедуре определения конечных количеств ионов металлов в растворе (приблизительно до 10 мг/л) используется 0,01 моль/л ЭДТА. Это применялось для определения низкого содержания Cu(II) в специализированных гальванических ваннах, а также для определения общей жесткости воды. Энтальпии реакции ЭДТА с большинством ионов металлов часто довольно низкие, и обычно концентрации титранта около 1 моль/л используются с соизмеримо высокими количествами титранда, чтобы получить четкие, воспроизводимые конечные точки. Используя каталитически определяемую конечную точку, можно использовать очень низкие концентрации титранта ЭДТА. Используется обратное титрование. Добавляется избыток раствора ЭДТА. Избыток ЭДТА титруют подходящим ионом металла, например Mn. 2+ или Cu 2+ . В конечном итоге первый избыток иона металла катализирует сильно экзотермическую реакцию между многоатомным фенолом (таким как резорцин) и перекисью водорода.
Преципитационное титрование
[ редактировать ]Термометрическая титриметрия особенно подходит для определения ряда аналитов, в которых в результате реакции с титрантом образуется осадок. В некоторых случаях может быть предложена альтернатива традиционной практике потенциометрического титрования. В других случаях могут использоваться химические реакции, для которых нет удовлетворительного эквивалента в потенциометрической титриметрии.
Титрование нитратом серебра
[ редактировать ]термометрическое титрование нитрата серебра Возможно галогенидами и цианидами. Реакция нитрата серебра с хлоридом сильно экзотермична. Например, энтальпия реакции Ag + с Кл − высокий уровень -61,2 кДж/моль. Это позволяет удобно определять хлориды с помощью общедоступного стандарта AgNO 3 0,1 моль/л . Конечные точки очень четкие, и при осторожном подходе можно анализировать концентрации хлоридов до 15 мг/л. Бромид и хлорид можно определять в смеси.
Титрование сульфата
[ редактировать ]Сульфат можно быстро и легко титровать термометрически, используя стандартные растворы Ba. 2+ как титрант. В промышленности эта процедура применялась для определения сульфата в рассоле (включая электролизные рассолы), в растворах для рафинирования никеля и, в частности, для определения сульфата в фосфорной кислоте , полученной мокрым способом , где она оказалась весьма популярной. Эту процедуру также можно использовать для анализа сложных смесей кислот, содержащих серную кислоту , когда титрование в неводных средах невозможно.
Энтальпия реакции образования сульфата бария составляет умеренные -18,8 кДж/моль. Это может наложить ограничение на нижний предел содержания сульфата в анализируемой пробе.
Титрование алюминия фторидом
[ редактировать ]Термометрическая титриметрия предлагает быстрый и высокоточный метод определения алюминия в растворе. Раствор алюминия кондиционируют ацетатным буфером и избытком ионов натрия и калия. Титрование фторидом натрия или калия приводит к экзотермическому осаждению нерастворимой соли фторида алюминия.
- Ал 3+ + Уже + +2К + + 6F − ↔ K 2 NaAlF 6 ↓
Поскольку 6 моль фторида реагируют с одним молем алюминия, титрование является особенно точным, и при анализе квасцов достигается коэффициент дисперсии (CV) 0,03.
Когда в качестве титранта используется ион алюминия (например, нитрат алюминия), фторид можно определить с помощью того же химического метода. Это титрование полезно при определении фторида в смесях сложных кислот, используемых в качестве травителей в полупроводниковой промышленности.
Титрование общего ортофосфата
[ редактировать ]Ортофосфат-ион можно удобно термометрически титровать ионами магния в присутствии иона аммония. Аликвоту образца забуферивают до pH примерно 10 раствором NH 3 /NH 4 Cl.
Реакция:
- мг 2+ + НХ 4 + + ПО 4 3− ↔ MgNH 4 PO 4 ↓
Является экзотермическим. В тестовых приложениях были достигнуты значения CV ниже 0,1. Методика подходит для определения ортофосфата в удобрениях и других продуктах.
Титрование никеля
[ редактировать ]Никель можно титровать термометрически, используя диметилглиоксимат натрия в качестве титранта. Химия аналогична классической гравиметрической процедуре, но время определения можно сократить со многих часов до нескольких минут. Необходимо учитывать возможные помехи.
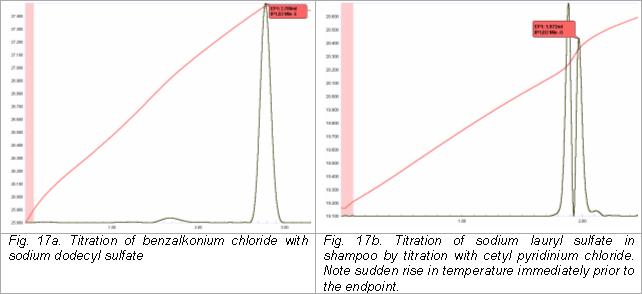
Титрование анионных и катионных ПАВ
[ редактировать ]Анионные и катионные поверхностно-активные вещества можно определить термометрически путем титрования одного типа другим. Например, хлорид бензалкония (катионное поверхностно-активное вещество четвертичного типа) можно определить в чистящих средствах и альгицидах для плавательных бассейнов и спа путем титрования стандартным раствором додецилсульфата натрия. Альтернативно, анионные поверхностно-активные вещества, такие как лаурилсульфат натрия, можно титровать хлоридом цетилпиридиния .

Титрование неионогенных поверхностно-активных веществ
[ редактировать ]При избытке Ba 2+ При добавлении неионогенного ПАВ типа производного алкилпропиленоксида образуется псевдокатионный комплекс. Его можно титровать стандартным тетрафенилборатом натрия. Два моля тетрафенилбората реагируют с одним молем Ba 2+ / комплекс неионогенных ПАВ.
Разное водное титрование
[ редактировать ]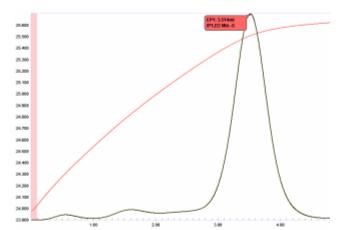
Титрование фторида борной кислотой
[ редактировать ]Кислые растворы фторидов (в том числе плавиковой кислоты) можно определить простым термометрическим титрованием борной кислотой.
- Б(ОН) 3 + 3F − + 3H + ↔ БФ 3 + 3Н 2 О
График титрования, показанный на рисунке 19, показывает, что конечная точка довольно округленная, что позволяет предположить, что реакция может не достичь стехиометрического равновесия. Однако, поскольку области температурной кривой непосредственно до и после конечной точки довольно линейны, вторая производная этой кривой (представляющая пересечение касательных) точно определит конечную точку. Действительно, с помощью этого титрования можно получить превосходную точность с CV менее 0,1.
Определение формальдегида
[ редактировать ]Формальдегид можно определить в растворах химического меднения путем добавления избытка раствора сульфита натрия и титрования высвободившегося гидроксильного иона стандартной кислотой.
- Н 2 С=О + HSO 3 − + H 2 O → [HO-CH 2 -SO 3 − ] + ОН −
Ссылки
[ редактировать ]- Дж. М. Белл и К. Ф. Коуэлл. Дж. Ам. хим. Соц. 35 , 49–54 (1913)
- Э. ВанДален и Л.Г. Уорд. Термометрическое титрование определения гидроксида и глинозема в процессе Байера.
solutions. Anal. Chem. 45 (13) 2248-2251, (1973)
- МЖД Карнейру, М.А. Ферес Жуниор и ОЕС Годиньо. Определение кислотности масел с использованием параформальдегида в качестве термометрического конечного индикатора. Ж. Браз. хим. Соц. 13 (5) 692-694 (2002)
Библиография
[ редактировать ]- Барк, Л.С. и Барк, С.М.; (1969). Термометрическая титриметрия. Международная серия монографий по аналитической химии, том 33 Pergamon Press (Оксфорд), каталог Библиотеки Конгресса, карточка № 68-57883
- Бартель, Дж.; (1975) Термометрическое титрование. Джон Уайли и сыновья, Нью-Йорк. ISBN 0-471-05448-8 Карточка каталога Библиотеки Конгресса № 75-17503
- Ито, диджей; Кристенсен, Джей Джей и Изатт Р.М.; (1974) Эксперименты по термометрической титриметрии и титрационной калориметрии. Издательство Университета Бригама Янга , Прово, Юта . ISBN 0-8425-0145-2 Карточка каталога Библиотеки Конгресса 74-13074
- Грайм, Дж. К.; (1985) Аналитическая калориметрия растворов. Джон Уайли и сыновья, Нью-Йорк. ISBN 0-471-86942-2 Карточка каталога Библиотеки Конгресса № 84-28424
- Воган, Джорджия; (1973) Термометрическая и энтальпиметрическая титриметрия. Компания Ван Ностранд Рейнхольд (Лондон) ISBN 0-442-78385-X Карточка каталога Библиотеки Конгресса № 79-186764