Корректирующие и предупреждающие действия
Корректирующие и предупреждающие действия ( CAPA или просто корректирующие действия ) состоят из улучшений процессов организации, предпринимаемых для устранения причин несоответствий или других нежелательных ситуаций. Обычно это набор действий, законов или правил, которые организация должна предпринять при производстве, документации, процедурах или системах для исправления и устранения повторяющихся несоответствий. Несоответствие выявляется после систематической оценки и анализа основной причины несоответствия. Несоответствие может быть жалобой рынка или жалобой клиента, отказом оборудования или системы управления качеством или неправильным толкованием письменных инструкций по выполнению работы. Корректирующие и предупреждающие действия разрабатываются командой, в которую входят сотрудники службы обеспечения качества и персонал, участвующий в фактическом месте наблюдения за несоответствием. Его необходимо систематически внедрять и наблюдать за его способностью исключать дальнейшее повторение такого несоответствия. Метод решения проблем восьми дисциплин , или структура 8D, может использоваться в качестве эффективного метода структурирования CAPA. [1]
Корректирующее действие : Действия, предпринятые для устранения причин несоответствий или других нежелательных ситуаций, чтобы предотвратить повторение.
Превентивные меры : Действия, предпринятые для предотвращения возникновения таких несоответствий, как правило, в результате анализа рисков.
На некоторых рынках и в некоторых отраслях CAPA может потребоваться как часть системы управления качеством, например, в производстве медицинского оборудования и фармацевтической промышленности в США. В этом случае несоблюдение правил обращения с CAPA считается нарушением федеральных правил США по надлежащей производственной практике. Как следствие, лекарство или медицинское изделие можно назвать фальсифицированным или некачественным, если компания не смогла расследовать, зарегистрировать и проанализировать основную причину несоответствия, а также не смогла разработать и внедрить эффективный CAPA. [ нужна ссылка ]
CAPA используется для улучшения процессов организации и часто применяется для устранения причин несоответствий или других нежелательных ситуаций. [2] CAPA — это концепция в рамках надлежащей производственной практики (GMP), анализа рисков и критических контрольных точек / анализа рисков и превентивного контроля на основе рисков ( HACCP / HARPC ) и многочисленных ISO бизнес-стандартов . Основное внимание уделяется систематическому исследованию коренных причин выявленных проблем или выявленных рисков в попытке предотвратить их повторение (для корректирующих действий) или предотвратить возникновение (для предупреждающих действий).
Корректирующие действия реализуются в ответ на жалобы клиентов, неприемлемые уровни несоответствия продукции, проблемы, выявленные в ходе внутреннего аудита , а также неблагоприятные или нестабильные тенденции в мониторинге продукции и процессов, которые могут быть выявлены статистическим контролем процессов (SPC). Превентивные действия реализуются в ответ на выявление потенциальных источников несоответствий.
Для обеспечения эффективности корректирующих и предупреждающих действий решающее значение имеет систематическое расследование коренных причин неудач. CAPA является частью общей системы управления качеством (СМК).
Концепции
[ редактировать ]- Четко определенные источники данных, которые определяют проблемы, требующие расследования.
- Анализ первопричин , который определяет причину несоответствия или отклонения и предлагает корректирующие действия.
Распространенным заблуждением является то, что целью профилактических действий является предотвращение возникновения аналогичной потенциальной проблемы. Этот процесс является частью корректирующих действий, поскольку это процесс определения таких сходств, которые должны иметь место в случае несоответствия.
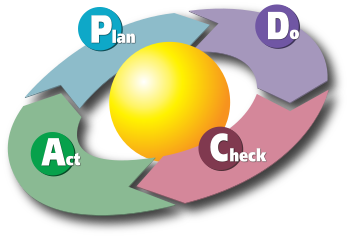
Превентивные действия — это любой упреждающий метод, используемый для определения потенциальных несоответствий до их возникновения и обеспечения их предотвращения (включая, например, профилактическое обслуживание, анализ со стороны руководства или другие распространенные формы предотвращения рисков). Корректирующие и предупреждающие действия включают этапы расследования, действия, проверки и необходимости дальнейших действий. Можно видеть, что оба они вписываются в философию PDCA (планируй-делай-проверяй-действуй), определенную циклом Деминга-Шухарта.
Расследование первопричин может привести к выводу, что корректирующие или предупреждающие действия не требуются, а также может предложить простые исправления проблемы без выявленной системной первопричины. Если многочисленные расследования не приносят никаких корректирующих действий, может быть сгенерировано новое описание проблемы с расширенным объемом и проведено более тщательное исследование основной причины.
Внедрение корректирующих и предупреждающих действий – это путь к совершенствованию и эффективности систем менеджмента качества. Корректирующие действия – это не что иное, как действия, основанные на выявлении проблемы. Проблема или несоответствие могут быть выявлены внутри компании посредством предложений персонала, проверок со стороны руководства, проверки документов или внутреннего аудита. Внешние факторы, ведущие к поиску основной причины проблемы, могут включать жалобы и предложения Клиента; отказы клиентов; несоответствия, выявленные в ходе аудитов клиентов или третьих сторон; рекомендации аудиторов.
Коренная причина – это идентификация и исследование источника проблемы, когда человек(а), система, процесс или внешний фактор идентифицируются как причина несоответствия. Анализ первопричин можно провести с помощью метода «5 почему» или других методов, например диаграммы Исикавы .
Коррекция – это действие по устранению обнаруженного несоответствия или несоответствия. [4]
Превентивные действия включают прогнозирование проблем и попытки избежать таких случаев (безопасность) посредством самоинициируемых действий и анализа, связанного с процессами или продуктами. Это может быть инициировано с помощью активного участия сотрудников и работников посредством групп по улучшению, встреч по улучшению, возможностей для улучшения во время внутренних аудитов, анализа со стороны руководства, обратной связи с клиентами и определения собственных целей, квантованных с точки зрения роста бизнеса, сокращения отказов, использования оборудование эффективно и т. д.
Медицинские устройства и соответствие требованиям FDA
[ редактировать ]США. Управления по санитарному надзору за качеством пищевых продуктов и медикаментов Соответствовать требованиям FDA 21 CFR 820.100 [5] Компании, производящие медицинское оборудование, должны внедрить процесс CAPA [6] в рамках своей СМК. Эта часть системы может быть бумажной или цифровой, но именно на нее обращают внимание во время посещения FDA. [7] В 2015 году в системах CAPA компаний, производящих медицинское оборудование, было обнаружено более 450 проблем. Чтобы иметь систему управления качеством, соответствующую требованиям FDA, требовалась возможность собирать, анализировать, утверждать, контролировать и извлекать процессы замкнутого цикла. [8]
Корректирующим действием также может быть коррекция на месте, то есть действие, предпринятое для устранения проблем с несоответствующей продукцией. [9] Примером может служить фармацевтическая компания Avanos Medical , которая в 2022 году провела добровольную коррекцию на месте после сообщений о 60 травмах и 23 смертях пациентов, связанных с неправильным расположением назогастральных зондов для кормления при использовании системы энтерального доступа CORTRAK* 2 . [10]
Добровольная коррекция на местах привела к тому, что компания Avanos Medical отозвала продукт. FDA . определило отзыв как класс I , самый серьезный тип отзыва [11]
Примеры корректирующих действий
[ редактировать ]- Проверка ошибок
- Видимые или звуковые сигналы тревоги
- Редизайн процесса
- Редизайн продукта
- Определить и реализовать план действий
- Обучение или улучшение или модификация существующих программ обучения
- Улучшения в технического обслуживания графике
- Улучшения в обработке и хранении материалов.
В некоторых случаях для полного устранения проблемы может потребоваться комбинация таких действий.
См. также
[ редактировать ]- Восемь дисциплин решения проблем
- Хорошая практика документирования
- Надлежащая практика автоматизированного производства (GAMP)
Ссылки
[ редактировать ]- ^ Прюитт, В. Фрейзер (май 2019 г.). «Дисциплинированный подход» . Качественный прогресс . 52 (5):64 . Проверено 31 октября 2019 г.
- ^ Система менеджмента качества ISO 9000. Основы и словарь . ИСО. 2005.
- ^ «Первый шаг с PDCA» . 2 февраля 2009 года . Проверено 17 марта 2011 г.
- ^ ИСО 9000:2015 (3.12.3)
- ^ «CFR — Свод федеральных правил, раздел 21» . www.accessdata.fda.gov . Проверено 20 мая 2016 г.
- ^ «Процесс CAPA» . 2020. Архивировано из оригинала 05 января 2022 г.
- ^ «Нужен ли вашему процессу CAPA CAPA?» . СОЛАБЫ . Проверено 29 августа 2016 г.
- ^ «Руководство для фармацевтической системы качества Q10» (PDF) . www.fda.gov . Проверено 29 августа 2016 г.
- ^ «Определение коррекции поля» . Lawinsider.com . Проверено 9 марта 2023 г.
- ^ «СРОЧНО: ПОЛЕВАЯ КОРРЕКЦИЯ CORTRAK* 2 Система энтерального доступа (EAS)» (PDF) . static.foxnews.com . Проверено 9 марта 2023 г.
- ^ «Avanos Medical отзывает систему энтерального доступа Cortrak*2 из-за риска неправильного размещения энтеральных трубок, которые могут причинить вред пациенту» . FDA.gov . 16 мая 2022 г. Проверено 9 марта 2023 г.