Ортоэфир

В органической химии ортоэфир , — это функциональная группа содержащая три алкоксигруппы, присоединенные к одному атому углерода, т.е. с общей формулой RC(ИЛИ') 3 . Ортоэфиры можно рассматривать как продукты исчерпывающего алкилирования нестабильных ортокарбоновых кислот , и именно от них произошло название «ортоэфир». Примером является этилортоацетат . CH 3 C(OCH 2 CH 3 ) 3 , более правильно известный как 1,1,1-триэтоксиэтан. [ 1 ]
Синтез
[ редактировать ]Ортоэфиры можно получить по реакции Пиннера , в которой нитрилы реагируют со спиртами в присутствии одного эквивалента хлористого водорода. Реакция протекает с образованием гидрохлорида имидоэфира :
- RCN + R’OH + HCl → [RC(OR’)=NH 2 ] + кл. −
В присутствии избытка спирта это промежуточное соединение превращается в ортоэфир:
- [RC(OR')=NH 2 ] + кл. − + 2 R’OH → RC(OR’) 3 + NH 4 Cl
Реакция требует безводных условий. [ 1 ]
Хотя это менее распространенный метод, ортоэфиры сначала были получены реакцией 1,1,1-трихлоралканов с алкоксидом натрия: [ 1 ]
- RCCl 3 + 3 NaOR′ → RC(OR′) 3 + 3 NaCl
Реакции
[ редактировать ]Гидролиз
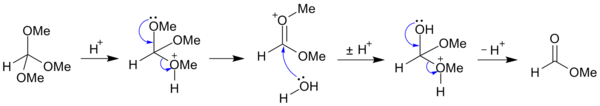
[ редактировать ]Ортоэфиры легко гидролизуются в слабой водной кислоте с образованием сложных эфиров :
- RC(OR') 3 + H 2 O → RCO 2 R' + 2 R'OH
Например, триметилортоформиат CH(OCH 3 ) 3 может быть гидролизован (в кислых условиях) до метилформиата и метанола ; [ 2 ] и может быть дополнительно гидролизован (в щелочных условиях) до солей муравьиной кислоты и метанола. [ 3 ]
Перегруппировка Джонсона – Кляйзена
[ редактировать ]Перегруппировка Джонсона-Кляйзена представляет собой реакцию аллилового спирта с орто-эфиром, содержащим депротонируемый альфа-углерод (например, триэтилортоацетат ), с образованием γ,δ-ненасыщенного сложного эфира . [ 4 ]
Синтез альдегидов Бодру – Чичибабина
[ редактировать ]В синтезе альдегида Бодру-Чичибабина орто-эфир реагирует с реактивом Гриньяра с образованием альдегида ; это пример реакции формилирования .
Примеры
[ редактировать ]
Гигромицин B , антибиотик , является одним из нескольких встречающихся в природе ортоэфиров.

Примеры ортоэфиров включают реагенты триметилортоформиат и триэтилортоацетат . Другим примером является бициклическая защитная группа ОВО (4-метил-2,6,7-триоксабицикло ] 2.2.2 [ октан - 1-ил), образующаяся под действием (3-метилоксетан-3 -ил)метанол на активированных карбоновых кислотах в присутствии кислот Льюиса. Группа устойчива к основаниям и может быть расщеплена в две стадии в мягких условиях. В результате слабокислого гидролиза образуется эфир трис(гидроксиметил)этана, который затем расщепляется, например, с помощью водного раствора карбоната. [ 5 ]
Трехкратная симметрия циклогексангексола изомера цилло- инозитола (циллита) дает тройные мостиковые эфиры ортоформиата, ортоформиат сциллита с адамантан -подобным скелетом и бис-ортоформиат сциллита с двумя конденсированными адамантанподобными скелетами. [ 6 ]
См. также
[ редактировать ]- Ацеталь , C(OR) 2 R 2
- Ортокарбонат , C(OR) 4 .
Ссылки
[ редактировать ]- ^ Jump up to: а б с Э. Х. Кордес (1969). «Орто Эфиры». У Саула Патая (ред.). Карбоновые кислоты и сложные эфиры . Химия функциональных групп ПАТАИ. стр. 623–667. дои : 10.1002/9780470771099.ch13 . ISBN 9780470771099 .
- ^ Клейден, Джонатан ; Гривз, Ник; Уоррен, Стюарт ; Уотерс, Питер (2001). Органическая химия (1-е изд.). Издательство Оксфордского университета. п. 345. ИСБН 978-0-19-850346-0 .
- ^ Заявка на патент США 20070049501, Сайни; Раджеш К.; и Савери; Карен, 1 марта 2007 г.
- ^ Джонсон, Уильям Саммер; Вертеманн, Люциус; Бартлетт, Уильям Р.; Броксом, Тимоти Дж.; Ли, Цунг-Ти.; Фолкнер, Д. Джон; Петерсен, Майкл Р. (февраль 1970 г.). «Простая стереоселективная версия перегруппировки Кляйзена, приводящая к транс-тризамещенным олефиновым связям. Синтез сквалена». Журнал Американского химического общества . 92 (3): 741–743. дои : 10.1021/ja00706a074 .
- ^ Коценский, Филип Дж. (2005). Защитные группы (3-е изд.). Штутгарт: Тиме. ISBN 978-3-13-135603-1 .
- ^ Хё Вон Ли и Ёсито Киши (1985): «Синтез моно- и несимметричных бис-ортоэфиров сцилло -инозитола». Журнал органической химии , том 50, выпуск 22, страницы 4402–4404. два : 10.1021/jo00222a046