Сегрегация хромосом
Сегрегация хромосомы - это процесс у эукариот, с помощью которого две сестринские хроматиды образовались в результате репликации ДНК или парных гомологичных хромосомов , отделенных друг от друга и мигрируют на противоположные полюсы ядра . Этот процесс сегрегации происходит как во время митоза , так и во мейозе . Сегрегация хромосом также происходит у прокариот . Однако, в отличие от сегрегации эукариотической хромосомы, репликация и сегрегация не разделены во времени. Вместо этого сегрегация происходит постепенно после репликации. [ 1 ]
Митотическая хроматидная сегрегация
[ редактировать ]
Во время сегрегации хромосомы митоза регулярно встречается в качестве стадии деления клеток (см. Диаграмму митоза). Как указано на диаграмме митоза, митозу предшествует раунд репликации ДНК, так что каждой хромосоме образуют две копии, называемые хроматидами . Эти хроматиды отделяются от противоположных полюсов, процесс, облегченный белковым комплексом, называемым Когезином . После надлежащей сегрегации полный набор хроматид заканчивается в каждом из двух ядер, и когда деление клеток завершено, каждая копия ДНК, ранее называемой хроматидом, теперь называется хромосомой.
Мейотическая хромосома и хроматидная сегрегация
[ редактировать ]Сегрегация хромосом происходит на двух отдельных этапах во время мейоза, называемого анафазой I и анафазой II (см. Диаграмму мейоза). В диплоидных клетках существует два набора гомологичных хромосом различного родительского происхождения (например, отцовский и материнский набор). Во время фазы мейоза, помеченной «Интерфазой» на диаграмме мейоза, есть раунд репликации ДНК, так что каждая из первоначальных хромосом, первоначально присутствующих, теперь состоит из двух копий, называемых хроматидами . Эти хромосомы (парные хроматиды) затем сочетаются с гомологичной хромосомой (также парными хроматидами), присутствующими в том же ядре (см. Prophase I на диаграмме мейоза). Процесс выравнивания парных гомологичных хромосом называется синапсисом (см. Синапс ). Во время синапсиса обычно происходит генетическая рекомбинация. Некоторые из событий рекомбинации происходят путем пересечения (включающий физический обмен между двумя хроматидами), но большинство событий рекомбинации включают обмен информацией, но не физический обмен между двумя хроматидами (см. Синтез-зависимый отжиг нити (SDSA) ). После рекомбинации сегрегация хромосомы происходит, как указывает этапами метафазы I и анафазы I на диаграмме мейоза.
Различные пары хромосом разделяют независимо друг от друга, процесс, названный «независимым ассортиментом не гомологичных хромосом» . Этот процесс приводит к тому, что каждый гамет обычно содержит смесь хромосом от обоих оригинальных родителей.
Неправильная сегрегация хромосом (см. Несооооооооооомицию , диссомия ) может привести к тому, что анеуплоидные гаметы имеют слишком мало или слишком много хромосом.
Второй этап, на которой сегрегация происходит во время мейоза, - это профаза II (см. Диаграмму мейоза). На этом этапе сегрегация возникает в процессе, аналогичного процессу во время митоза, за исключением того, что в этом случае профазе II не предшествует раунд репликации ДНК. Таким образом, две хроматиды, составляющие каждую хромосому, разделяются в разные ядра , так что каждое ядро получает один набор хроматид (теперь называемый хромосом), и каждое ядро включает в гаплоидную гамету (см. Стадии, следующие за профазой II в диаграмме мейоза). Этот процесс сегрегации также облегчается с помощью Когезина . Отказ надлежащей сегрегации во время профазы II также может привести к анеуплоидным гаметам. Анеуплоидные гаметы могут подвергаться оплодотворенности с образованием анеуплоидных зигот и, следовательно, с серьезными неблагоприятными последствиями для потомства.
Кроссоверы облегчают сегрегацию, но не необходимы
[ редактировать ]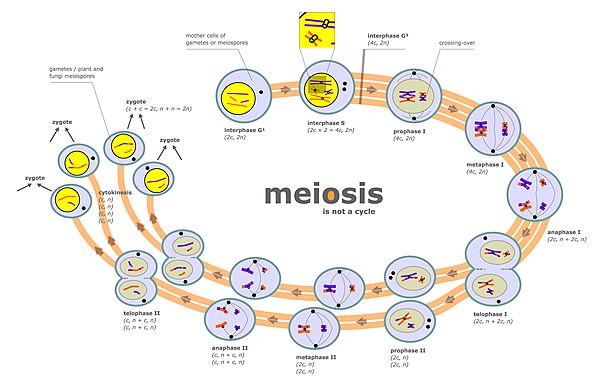

Мейотическая хромосомная кроссовер (CO) рекомбинация облегчает правильную сегрегацию гомологичных хромосом . Это связано с тем, что в конце мейотической профазы I рекомбинация обеспечивает физическую связь, которая содержит гомологичные пары хромосом вместе. Эти связи устанавливаются Chiasmata , которые являются цитологическими проявлениями рекомбинации CO. Вместе с связью сплоченной связи между сестринскими хроматидами , рекомбинация CO может помочь обеспечить упорядоченную сегрегацию парных гомологичных хромосом на противоположные полюсы. В поддержку этого, исследование анеуплоидии в отдельных сперматозоиде с помощью секвенирования цельного генома показало, что в среднем человеческие сперматозоиды с анеуплоидными аутосомами демонстрируют значительно меньше кроссоверов, чем нормальные клетки. [ 2 ] После того, как первая сегрегация хромосом в мейозе I завершена, существует дальнейшая сегрегация хромосом во время второго уравнения мейоза II . Как надлежащая начальная сегрегация хромосом в профазе I, так и в следующей сегрегации хромосомы во время уравнения деления в мейозе II необходимы для создания гамет с правильным количеством хромосом.
CO recombinants are produced by a process involving the formation and resolution of Holliday junction intermediates. As indicated in the figure titled "A current model of meiotic recombination", the formation of meiotic crossovers can be initiated by a double-strand break (DSB). The introduction of DSBs in DNA often employs the topoisomerase-like protein SPO11.[3] CO recombination may also be initiated by external sources of DNA damage such as X-irradiation,[4] or internal sources.[5][6]
There is evidence that CO recombination facilitates meiotic chromosome segregation.[2] Other studies, however, indicate that chiasma, while supportive, are not essential to meiotic chromosome segregation. The budding yeast Saccharomyces cerevisiae is a model organism used for studying meiotic recombination. Mutants of S. cerevisiae defective in CO recombination at the level of Holliday junction resolution were found to efficiently undergo proper chromosome segregation. The pathway that produces the majority of COs in S. cerevisiae, and possibly in mammals, involves a complex of proteins including the MLH1-MLH3 heterodimer (called MutL gamma).[7] MLH1-MLH3 binds preferentially to Holliday junctions.[8] It is an endonuclease that makes single-strand breaks in supercoiled double-stranded DNA,[8][9] and promotes the formation of CO recombinants.[10] Double mutants deleted for both MLH3 (major pathway) and MMS4 (which is necessary for a minor Holliday junction resolution pathway) showed dramatically reduced crossing over compared to wild-type (6- to 17-fold reduction); however spore viability was reasonably high (62%) and chromosomal disjunction appeared mostly functional.[10]
The MSH4 and MSH5 proteins form a hetero-oligomeric structure (heterodimer) in S. cerevisiae and humans.[11][12][13] In S. cerevisiae, MSH4 and MSH5 act specifically to facilitate crossovers between homologous chromosomes during meiosis.[11] The MSH4/MSH5 complex binds and stabilizes double Holliday junctions and promotes their resolution into crossover products. An MSH4 hypomorphic (partially functional) mutant of S. cerevisiae showed a 30% genome-wide reduction in crossover numbers, and a large number of meioses with non-exchange chromosomes.[14] Nevertheless, this mutant gave rise to spore viability patterns suggesting that segregation of non-exchange chromosomes occurred efficiently.[14] Thus it appears that CO recombination facilitates proper chromosome segregation during meiosis in S. cerevisiae, but it is not essential.
The fission yeast Schizosaccharomyces pombe has the ability to segregate homologous chromosomes in the absence of meiotic recombination (achiasmate segregation).[15] This ability depends on the microtubule motor dynein that regulates the movement of chromosomes to the poles of the meiotic spindle.
See also
[edit]References
[edit]- ^ Nielsen, H. J.; Youngren, B.; Hansen, F. G.; Austin, S. (2007-12-01). "Dynamics of Escherichia coli Chromosome Segregation during Multifork Replication". Journal of Bacteriology. 189 (23): 8660–8666. doi:10.1128/JB.01212-07. ISSN 0021-9193. PMC 2168957. PMID 17905986.
- ^ Jump up to: a b Lu S, Zong C, Fan W, Yang M, Li J, Chapman AR, Zhu P, Hu X, Xu L, Yan L, Bai F, Qiao J, Tang F, Li R, Xie XS (2012). "Probing meiotic recombination and aneuploidy of single sperm cells by whole-genome sequencing". Science. 338 (6114): 1627–30. Bibcode:2012Sci...338.1627L. doi:10.1126/science.1229112. PMC 3590491. PMID 23258895.
- ^ Sansam CL, Pezza RJ (2015). "Connecting by breaking and repairing: mechanisms of DNA strand exchange in meiotic recombination". FEBS J. 282 (13): 2444–57. doi:10.1111/febs.13317. PMC 4573575. PMID 25953379.
- ^ Dernburg AF, McDonald K, Moulder G, Barstead R, Dresser M, Villeneuve AM (1998). "Meiotic recombination in C. elegans initiates by a conserved mechanism and is dispensable for homologous chromosome synapsis". Cell. 94 (3): 387–98. doi:10.1016/s0092-8674(00)81481-6. PMID 9708740. S2CID 10198891.
- ^ Farah JA, Cromie G, Davis L, Steiner WW, Smith GR (2005). "Activation of an alternative, rec12 (spo11)-independent pathway of fission yeast meiotic recombination in the absence of a DNA flap endonuclease". Genetics. 171 (4): 1499–511. doi:10.1534/genetics.105.046821. PMC 1456079. PMID 16118186.
- ^ Pauklin S, Burkert JS, Martin J, Osman F, Weller S, Boulton SJ, Whitby MC, Petersen-Mahrt SK (2009). "Alternative induction of meiotic recombination from single-base lesions of DNA deaminases". Genetics. 182 (1): 41–54. doi:10.1534/genetics.109.101683. PMC 2674839. PMID 19237686.
- ^ Zakharyevich K, Tang S, Ma Y, Hunter N (2012). "Delineation of joint molecule resolution pathways in meiosis identifies a crossover-specific resolvase". Cell. 149 (2): 334–47. doi:10.1016/j.cell.2012.03.023. PMC 3377385. PMID 22500800.
- ^ Jump up to: a b Ranjha L, Anand R, Cejka P (2014). "The Saccharomyces cerevisiae Mlh1-Mlh3 heterodimer is an endonuclease that preferentially binds to Holliday junctions". J. Biol. Chem. 289 (9): 5674–86. doi:10.1074/jbc.M113.533810. PMC 3937642. PMID 24443562.
- ^ Rogacheva MV, Manhart CM, Chen C, Guarne A, Surtees J, Alani E (2014). "Mlh1-Mlh3, a meiotic crossover and DNA mismatch repair factor, is a Msh2-Msh3-stimulated endonuclease". J. Biol. Chem. 289 (9): 5664–73. doi:10.1074/jbc.M113.534644. PMC 3937641. PMID 24403070.
- ^ Jump up to: a b Sonntag Brown M, Lim E, Chen C, Nishant KT, Alani E (2013). "Genetic analysis of mlh3 mutations reveals interactions between crossover promoting factors during meiosis in baker's yeast". G3: Genes, Genomes, Genetics. 3 (1): 9–22. doi:10.1534/g3.112.004622. PMC 3538346. PMID 23316435.
- ^ Jump up to: a b Pochart P, Woltering D, Hollingsworth NM (1997). "Conserved properties between functionally distinct MutS homologs in yeast". J. Biol. Chem. 272 (48): 30345–9. doi:10.1074/jbc.272.48.30345. PMID 9374523.
- ^ Winand NJ, Panzer JA, Kolodner RD (1998). "Cloning and characterization of the human and Caenorhabditis elegans homologs of the Saccharomyces cerevisiae MSH5 gene". Genomics. 53 (1): 69–80. doi:10.1006/geno.1998.5447. PMID 9787078.
- ^ Bocker T, Barusevicius A, Snowden T, Rasio D, Guerrette S, Robbins D, Schmidt C, Burczak J, Croce CM, Copeland T, Kovatich AJ, Fishel R (1999). "hMSH5: a human MutS homologue that forms a novel heterodimer with hMSH4 and is expressed during spermatogenesis". Cancer Res. 59 (4): 816–22. PMID 10029069.
- ^ Jump up to: a b Krishnaprasad GN, Anand MT, Lin G, Tekkedil MM, Steinmetz LM, Nishant KT (2015). "Variation in crossover frequencies perturb crossover assurance without affecting meiotic chromosome segregation in Saccharomyces cerevisiae". Genetics. 199 (2): 399–412. doi:10.1534/genetics.114.172320. PMC 4317650. PMID 25467183.
- ^ Davis L, Smith GR (2005). "Dynein promotes achiasmate segregation in Schizosaccharomyces pombe". Genetics. 170 (2): 581–90. doi:10.1534/genetics.104.040253. PMC 1450395. PMID 15802518.