Гетероядерная отдельная квантовая спектроскопия когерентности
Эксперимент с гетероядерной единой квантовой когерентностью или гетероядерной единой квантовой корреляционной экспериментом, обычно сокращенным как HSQC , часто используется в спектроскопии ЯМР органических молекул и имеет особое значение в поле белка ЯМР . Эксперимент был впервые описан Джеффри Боденхаузеном и DJ Ruben в 1980 году. [ 1 ] Полученный спектр является двумерным (2D) с одной осью для протона ( 1 H) и другой для гетеронуклеуса ( атомного ядра, отличного от протона), который обычно 13 C или 15 Не Спектр содержит пик для каждого уникального протона, прикрепленного к рассматриваемому гетеронуклеусу. 2D HSQC также может быть объединен с другими экспериментами в экспериментах с более высоким уровнем ЯМР, такими как NOESY-HSQC или TOCSY-HSQC.
Общая схема
[ редактировать ]Эксперимент HSQC является высокочувствительным экспериментом 2D-ЯМР и впервые был описан в 1 ЧАС- 15 N Система, но также применима к другим ядрам, таким как 1 ЧАС- 13 C и 1 ЧАС- 31 P. Основная схема этого эксперимента включает в себя передачу намагниченности на протоне во второе ядро, которое может быть 15 N, 13 C или 31 P, через бесчувственные ядра, усиленные поляризационной переносом). После временной задержки ( T 1 ) намагничность переносится обратно на протон через шаг ретро-рубца, и затем сигнал записывается. В HSQC серию экспериментов регистрируется, когда временная задержка t 1 увеличивается . А 1 H Сигнал обнаруживается в непосредственном измеренном измерении в каждом эксперименте, в то время как сдвиг химический 15 Ни 13 C записывается в косвенном измерении, которое образуется из серии экспериментов.
HSQC в белковом ЯМР
[ редактировать ]1 ЧАС- 15 N HSQC
[ редактировать ]
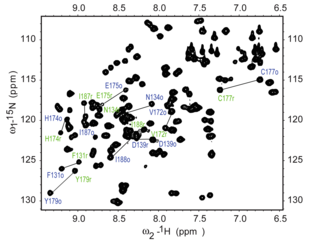
А 15 N HSQC Эксперимент является одним из наиболее часто зарегистрированных экспериментов в ЯМР белка. Эксперимент HSQC может быть выполнен с использованием естественной изобилии 15 N изотоп , но обычно для ЯМР белка используются изотопно меченные белки. Такие меченые белки обычно продуцируются путем экспрессии белка в клетках, выращенных в 15 N метелки СМИ.
Каждый остаток белка азоту , за исключением пролина , имеет амидный протон, прикрепленный к в пептидной связи . HSQC обеспечивает корреляцию между азотом и амидным протоном, и каждый амид дает пик в спектрах HSQC. Поэтому каждый остаток (кроме пролина) может привести к наблюдаемому пику в спектрах, хотя на практике не все пики всегда наблюдаются из -за ряда факторов. Обычно N-концевой остаток (который имеет NH 3 + Группа, прикрепленная) не легко наблюдается из -за обмена с растворителем. [ 3 ] В дополнение к амидным резонансам магистра, боковые ходы с азот-связанными протонами также будут производить пики.
В типичном спектре HSQC пики NH 2 из боковых холмов аспарагина и глютамина появляются в виде дублетов в верхнем правом углу, а поверхностный пик может появляться поверх каждого пика из -за дейтерийного обмена из D 2 O, обычно добавляемого в Образец ЯМР, придающий эти пики на боковых странах отличительный вид. Пики амин -боковой амины от триптофана обычно смещены вниз и появляются около нижнего левого уголка. Амидные пики глицина на основе обычно появляются вблизи вершины спектра.
А 15 N HSQC обычно является первым гетероядерным спектром, полученным для назначения резонансов, где каждый амидный пик назначается конкретному остатке в белке. Если белок сложен, пики обычно хорошо диспергированы, и большинство отдельных пиков можно различить. Если есть большой кластер из сильно перекрывающихся пиков вокруг середины спектра, это указывает на наличие значительных неструктурированных элементов в белке. В таких случаях, когда существует серьезное совпадение резонансов, назначение резонансов в спектрах может быть затруднено. Назначение спектра HSQC требует других экспериментов, в идеале с использованием тройных резонансных экспериментов с 15 N и 13 C-меченные белки, которые обеспечивают последовательные соединения между остатками, так что резонансы могут быть связаны с конкретными остатками и последовательно назначены. Назначение спектра имеет важное значение для значимой интерпретации более продвинутых экспериментов ЯМР, таких как определение структуры и анализ релаксации .
Химические вещества помечены 15 N изотоп относительно недорогие, а 15 N HSQC - чувствительный эксперимент, посредством которого спектр может быть получен в относительно короткое время, 15 Поэтому N HSQC часто используется для проверки кандидатов для их пригодности для определения структуры с помощью ЯМР, а также оптимизации условий выборки. Заемный процесс определения структуры обычно не проводится до тех пор, пока не может быть получен хороший спектр HSQC. Эксперимент HSQC также полезен для обнаружения границы раздела связывания при взаимодействии белкового белка, а также взаимодействия с лигандами, такими как лекарства. Сравнивая HSQC свободного белка с одним, связанным с лигандом, могут наблюдаться изменения в химических сдвигах некоторых пиков, и эти пики, вероятно, будут лежать на поверхности связывания, где связывание нарушает их химические сдвиги. [ 4 ] А 15 N HSQC также может использоваться в анализе релаксации в исследованиях молекулярной динамики белков, определения постоянной ионизации и других исследований.
1 ЧАС- 13 C HSQC
[ редактировать ]Этот эксперимент обеспечивает корреляции между углеродом и его прикрепленными протонами. Постоянная версия времени (CT) 1 ЧАС- 13 C HSQC обычно используется, когда он обходит проблему расщепления сигнала из -за гомонуклеарного 13 C— 13 C j Связывание, которые уменьшают спектральное разрешение. [ 5 ] «Постоянное время» относится ко всему периоду эволюции между двумя неумелыми шагами, которые сохраняются постоянными в этом эксперименте. Если этот период эволюции устанавливается как обратная константа J-связанного , то знак намагниченности этих углеродов с нечетным числом алифатического углерода будет противоположным тем, кто имеет равномерное количество. Например, если C β лейцина (3 прикрепленные появляется в виде положительного пика (прикрепленные 2 алифатические углероды), то C γ алифатические углероды) и C α (1 прикрепленные алифатические углероды) будут выглядеть отрицательными.
HSQC в липидном ЯМР
[ редактировать ]1 ЧАС- 31 P HSQC
[ редактировать ]Использование 1 ЧАС- 31 P hsqc относительно редкость в липидомике, однако использование 31 P в липидомике восходит к 1990 -м годам. [ 6 ] Использование этой методики ограничено в отношении масс -спектрометрии из -за его требования к гораздо большему размеру выборки, однако комбинация 1 ЧАС- 31 P HSQC с масс -спектрометрией рассматривается как тщательный подход к липидомике и методам «двойной спектроскопии» становится доступной. [ 7 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Bodenhausen, G.; Рубен, DJ (1980). «Природная численность азота-15 ЯМР с помощью усиленной гетероядерной спектроскопии» . Химические физические буквы . 69 (1): 185–189. Bibcode : 1980cpl .... 69..185b . doi : 10.1016/0009-2614 (80) 80041-8 . S2CID 96730420 .
- ^ Wu, bin; Skarina, Tatiana, Yee, Adelinda, Jobin, Marie-Claude, Dileo, Rosa, Semesi, Anthony, Fares, Christophe, Lemak, Alexander, Coombes, Brian K., Arrowsmith, Cheryl H., Singer, Alexander U., Savchenko, Алексей, Стеббинс, С. Эрек (июнь 2010 г.). «Эффекторы NLEG типа 3 из энтерогаморрагической эсшерихии-coli являются U-box e3-убиквитиновыми лигазами» . PLO -патогены . 6 (6): E1000960. doi : 10.1371/journal.ppat.1000960 . PMC 2891834 . PMID 20585566 .
{{cite journal}}: Cs1 maint: несколько имен: список авторов ( ссылка ) - ^ Стивен М. Паскаль (2008). Праймер ЯМР: подход на основе HSQC с векторной анимацией . Im Publications LLP. С. 29–31. ISBN 978-1901019087 .
- ^ Уильямсон, Майк П. (2013-08-01). «Использование возмущения химического сдвига для характеристики связывания лиганда» . Прогресс в ядерной магнитно -резонансной спектроскопии . 73 : 1–16. doi : 10.1016/j.pnmrs.2013.02.001 . ISSN 0079-6565 . PMID 23962882 .
- ^ Гертен В. Вуистер; Ad Bax (1992). «Улучшение разрешения и спектральное редактирование равномерно 13 -х белков с гомонуклеарной широкополосной связью 13C развязки» (PDF) . Журнал магнитного резонанса . 98 (2): 428–435. Bibcode : 1992jmagr..98..428v . doi : 10.1016/0022-2364 (92) 90144-V .
- ^ Bosco, M.; Culeddu, N.; Тоффанин, Р.; Pollesello, P. (1997). «Системы органического растворителя для ядерного магнитно-резонансного анализа 31p фосфолипидов лецитина: применение к двумерному градиентному увеличению1H-дететуальным экспериментам с гетероядерным множественной квантовой когерентностью» . Аналитическая биохимия . 245 (1): 38–47. doi : 10.1006/abio.1996.9907 . PMID 9025966 .
- ^ Furse, Самуил; Фернандес-Твинн, Дениз; Дженкинс, Бенджамин; Кроткий, Клэр Л.; Williams, Huw E.; Смит, Гордон К.С.; Чарнок-Джонс, Д. Стивен; Озанна Сьюзен, Е.; Коулман, Альберт (2020). «Высокая пропускная платформа для детального липидомического анализа ряда тканей мыши и человека» . Аналитическая и биоаналитическая химия . 412 (12): 2851–2862. doi : 10.1007/s00216-020-02511-0 . PMC 7196091 . PMID 32144454 .
Общие ссылки
[ редактировать ]- Спектроскопия ЯМР белка: принципы и практика (1995) Джон Кавана, Уэйн Дж. Фэрбротер, Артур Г. Палмер III, Николас Дж. Скелтон, Академическая пресса
Внешние ссылки
[ редактировать ]- Белок ЯМР белок ЯМР ЯМР