Гетероядерная одноквантовая когерентная спектроскопия
Гетероядерная одноквантовая когерентность или гетероядерный одноквантовый корреляционный эксперимент, обычно сокращенно HSQC , часто используется в ЯМР- спектроскопии органических молекул и имеет особое значение в области ЯМР белков . Эксперимент был впервые описан Джеффри Боденхаузеном и DJ Рубеном в 1980 году. [1] Результирующий спектр является двумерным (2D) с одной осью для протона ( 1 H), а другой — для гетероядра ( атомного ядра, отличного от протона), которое обычно 13 С или 15 Н. Спектр содержит пик для каждого уникального протона, присоединенного к рассматриваемому гетероядру. 2D HSQC также можно комбинировать с другими экспериментами в экспериментах ЯМР более высокой размерности, такими как NOESY-HSQC или TOCSY-HSQC.
Общая схема
[ редактировать ]Эксперимент HSQC представляет собой высокочувствительный эксперимент 2D-ЯМР и впервые был описан в 1 ЧАС- 15 N-система, но также применима и к другим ядрам, таким как 1 ЧАС- 13 С и 1 ЧАС- 31 П. Основная схема этого эксперимента предполагает передачу намагниченности протона второму ядру, что может быть 15 Н, 13 С или 31 P, через этап INEPT (нечувствительные ядра, усиленные переносом поляризации). После временной задержки ( t 1 ) намагниченность передается обратно протону посредством ретро-INEPT-шага, и затем сигнал записывается. В HSQC записывается серия экспериментов, в которых время задержки t 1 увеличивается. 1 Сигнал H обнаруживается в непосредственно измеряемом измерении в каждом эксперименте, а сдвиг химический 15 Ни 13 C регистрируется в косвенном измерении, которое формируется в результате серии экспериментов.
HSQC в ЯМР белков
[ редактировать ]1 ЧАС- 15 Н HSQC
[ редактировать ]
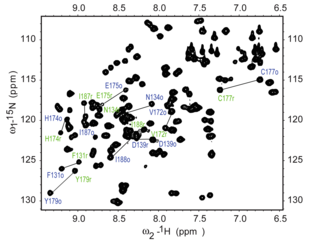
The 15 Эксперимент N HSQC - один из наиболее часто записываемых экспериментов по ЯМР белков. Эксперимент HSQC можно провести, используя естественное содержание 15 N Изотоп , но обычно для ЯМР белков используются меченные изотопами белки. Такие меченые белки обычно получают путем экспрессии белка в клетках, выращенных в 15 N-меченные носители.
Каждый остаток белка азоту , за исключением пролина , имеет амидный протон, присоединенный к в пептидной связи . HSQC обеспечивает корреляцию между протоном азота и амида, и каждый амид дает пик в спектрах HSQC. Таким образом, каждый остаток (кроме пролина) может давать заметный пик в спектрах, хотя на практике не все пики всегда видны из-за ряда факторов. Обычно N-концевой остаток (который имеет NH 3 + присоединенная группа) трудно обнаружить из-за обмена с растворителем. [3] В дополнение к резонансам основной цепи амидов боковые цепи с протонами, связанными с азотом, также будут давать пики.
В типичном спектре HSQC пики NH 2 боковых цепей аспарагина и глутамина появляются в виде дублетов в верхнем правом углу, а пик меньшего размера может появляться поверх каждого пика из-за обмена дейтерия с D 2 O, обычно добавляемого к Образец ЯМР, придающий этим пикам боковой цепи характерный вид. Пики боковых аминов триптофана обычно сдвинуты вниз по полю и появляются в левом нижнем углу. Пики основной амидной цепи глицина обычно появляются в верхней части спектра.
The 15 N HSQC обычно представляет собой первый гетероядерный спектр, полученный для определения резонансов, где каждый амидный пик соответствует определенному остатку в белке. Если белок свернут, пики обычно хорошо разбросаны, и можно различить большинство отдельных пиков. Если вокруг середины спектра имеется большой кластер сильно перекрывающихся пиков, это может указывать на наличие в белке значительных неструктурированных элементов. В таких случаях, когда имеется сильное перекрытие резонансов, отнесение резонансов в спектрах может быть затруднено. Определение спектра HSQC требует других экспериментов, в идеале с использованием экспериментов с тройным резонансом с 15 Н и 13 Белки, меченные C, которые обеспечивают последовательные связи между остатками, так что резонансы могут быть связаны с конкретными остатками и последовательно присвоены. Назначение спектра важно для значимой интерпретации более сложных экспериментов ЯМР, таких как определение структуры и релаксационный анализ.
Химические вещества с маркировкой 15 N Изотоп относительно недорог, а 15 N HSQC — это чувствительный эксперимент, в ходе которого спектр можно получить за относительно короткое время. 15 Поэтому N HSQC часто используется для проверки кандидатов на предмет их пригодности для определения структуры методом ЯМР, а также для оптимизации условий образца. Трудоемкий процесс определения структуры обычно не проводится до тех пор, пока не будет получен хороший спектр HSQC. Эксперимент HSQC также полезен для обнаружения интерфейса связывания при межбелковом взаимодействии, а также взаимодействий с лигандами, такими как лекарства. Сравнивая HSQC свободного белка с белком, связанным с лигандом, можно наблюдать изменения химических сдвигов некоторых пиков, и эти пики, вероятно, лежат на поверхности связывания, где связывание нарушило их химические сдвиги. [4] 15 N HSQC также может быть использован в релаксационном анализе при исследованиях молекулярной динамики белков, определении константы ионизации и других исследованиях.
1 ЧАС- 13 С HSQC
[ редактировать ]Этот эксперимент обеспечивает корреляции между углеродом и присоединенными к нему протонами. Версия с постоянным временем (CT) 1 ЧАС- 13 C HSQC обычно используется, поскольку позволяет обойти проблему расщепления сигнала из-за гомоядерных 13 С— 13 C J -связи, снижающие спектральное разрешение. [5] «Постоянное время» относится ко всему периоду эволюции между двумя этапами INEPT, который в этом эксперименте остается постоянным. Если этот период эволюции установить как величину, обратную константе J-связи , то знак намагниченности тех атомов углерода с нечетным числом присоединенных алифатических атомов углерода будет противоположным знаку намагниченности тех атомов углерода с четным числом. Например, если C β лейцина ( присоединено выглядит как положительный пик (присоединено 2 алифатических углерода), то C γ 3 алифатических углерода) и C α (присоединено 1 алифатический углерод) будут отрицательными.
HSQC в ЯМР липидов
[ редактировать ]1 ЧАС- 31 П HSQC
[ редактировать ]Использование 1 ЧАС- 31 P HSQC относительно редко встречается в липидомике, однако использование 31 P в липидомике берет свое начало в 1990-х годах. [6] Использование этого метода ограничено в отношении масс-спектрометрии из-за необходимости использования гораздо большего размера выборки, однако сочетание 1 ЧАС- 31 P HSQC с масс-спектрометрией считается тщательным подходом к липидомике, и становятся доступными методы «двойной спектроскопии». [7]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Боденхаузен, Г.; Рубен, диджей (1980). «ЯМР азота-15 естественного содержания с помощью усиленной гетероядерной спектроскопии» . Письма по химической физике . 69 (1): 185–189. Бибкод : 1980CPL....69..185B . дои : 10.1016/0009-2614(80)80041-8 . S2CID 96730420 .
- ^ Ву, Бин; Скарина, Татьяна, Йи, Аделинда, Джобин, Мари-Клод, ДиЛео, Роза, Семеси, Энтони, Фарес, Кристоф, Лемак, Александр, Кумбс, Брайан К., Эроусмит, Шерил Х., Сингер, Александр Ю., Савченко, Алексей, Стеббинс, К. Эрек (июнь 2010 г.). «Эффекторы NleG типа 3 из энтерогеморрагической Escherichia coli представляют собой убиквитинлигазы U-Box E3» . ПЛОС Патогены . 6 (6): e1000960. дои : 10.1371/journal.ppat.1000960 . ПМЦ 2891834 . ПМИД 20585566 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Стивен М. Паскаль (2008). Учебник по ЯМР: подход на основе HSQC с векторной анимацией . ТОО «IM Publications». стр. 29–31. ISBN 978-1901019087 .
- ^ Уильямсон, Майк П. (01 августа 2013 г.). «Использование возмущений химического сдвига для характеристики связывания лигандов» . Прогресс в спектроскопии ядерного магнитного резонанса . 73 : 1–16. дои : 10.1016/j.pnmrs.2013.02.001 . ISSN 0079-6565 . ПМИД 23962882 .
- ^ Гертен В. Вуистер; Ад Бакс (1992). «Повышение разрешения и спектральное редактирование однородно обогащенных 13C белков путем гомоядерной широкополосной развязки 13C» (PDF) . Журнал магнитного резонанса . 98 (2): 428–435. Бибкод : 1992JMagR..98..428V . дои : 10.1016/0022-2364(92)90144-в .
- ^ Боско, М.; Куледду, Н.; Тоффанин Р.; Поллеселло, П. (1997). «Системы органических растворителей для ядерного магнитно-резонансного анализа 31P фосфолипидов лецитина: применение к двумерным экспериментам по гетероядерной множественной квантовой когерентности с детектированием градиента 1H» . Аналитическая биохимия . 245 (1): 38–47. дои : 10.1006/abio.1996.9907 . ПМИД 9025966 .
- ^ Фурс, Сэмюэл; Фернандес-Твинн, Дениз; Дженкинс, Бенджамин; Мик, Клэр Л.; Уильямс, Хью Э.; Смит, Гордон CS; Чарнок-Джонс, Д. Стивен; Озанн Сьюзен, Э.; Коулман, Альберт (2020). «Высокопроизводительная платформа для детального липидомного анализа ряда тканей мыши и человека» . Аналитическая и биоаналитическая химия . 412 (12): 2851–2862. дои : 10.1007/s00216-020-02511-0 . ПМК 7196091 . ПМИД 32144454 .
Общие ссылки
[ редактировать ]- ЯМР-спектроскопия белков: принципы и практика (1995) Джон Кавана, Уэйн Дж. Фэйрбразер, Артур Г. Палмер III, Николас Дж. Скелтон, Academic Press
Внешние ссылки
[ редактировать ]- ЯМР белков Спектры ЯМР белков