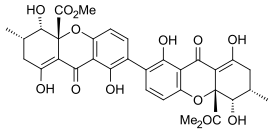
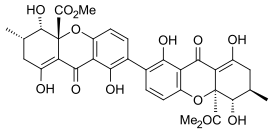
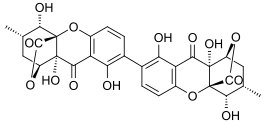
Секалоновая кислота
Секалоновые кислоты представляют собой группу производных ксантона , тесно связанных с эргофлавином и эргохризином А, которые вместе называются эргохромами и принадлежат к классу микотоксинов, первоначально выделенных в качестве основных пигментов спорыньи из грибов Claviceps purpurea , которые паразитически растут на ржаных травах. [ 1 ] [ 2 ] С древних времен, особенно в средневековой Европе, потребление зерен, содержащих спорынью, неоднократно приводило к массовым отравлениям, известным как эрготизм , вызванным токсичными алкалоидами спорыньи и микотоксинами, такими как эргохромы, из-за загрязнения муки C. purpurea . кластер генов, ответственных за синтез секалоновых кислот у C. purpurea . Идентифицирован [ 3 ] Секалоновая кислота D, энантиомер секалоновой кислоты А, представляет собой основной токсин окружающей среды, выделенный из гриба Penicillium oxalicum , и является основным микробным загрязнителем свежесобранной кукурузы, который вызывает токсичность в результате загрязнения пищевых продуктов. [ 1 ] [ 2 ]
- Основные эргохромы спорыньи и секалоновая кислота D.
-
Секалоновая кислота А
-
Секалоновая кислота Б
-
Секалоновая кислота С
-
Секалоновая кислота D
-
Эргофлавин
-
Эргохризин А
возникновение
[ редактировать ]Помимо встречающихся в C. purpurea секалоновых кислот A, B, D и эргофлавина также были выделены из других грибов, а три секалоновые кислоты также были обнаружены в различных лишайниках. [ 1 ] На сегодняшний день выделены и структурно идентифицированы по меньшей мере двадцать два члена семейства эргохромов. [ 4 ] включая секалоновую кислоту E (энантиомер секалоновой кислоты A) из гриба Phoma terrestris , секалоновую кислоту F из гриба Aspergillus aculeatus и секалоновую кислоту G из гриба Pyrenochaeta terrestris . [ 1 ] были выделены мономерные единицы димерных секалоновых кислот, а именно гемисекалоновые кислоты B и E (бленнолиды A и E). Кроме того, из Blennoria sp ., эндофитного гриба Carpobrotus edulis , [ 4 ]
Биоактивность
[ редактировать ]Семейство секалонов вторичных метаболитов микотоксинов демонстрирует интересную биологическую активность. Секалоновая кислота А обладает противоопухолевыми свойствами, а также снижает токсичность колхицина крыс в корковых нейронах . [ 5 ] было продемонстрировано, что секалоновая кислота А защищает от гибели дофаминергических нейронов Кроме того, на мышиной модели болезни Паркинсона . [ 6 ] Секалоновая кислота B также обладает противоопухолевой активностью. При тестировании против мышиной меланомы B16 было обнаружено, что он активен в низкомикромолярном диапазоне. [ 7 ] Он также оказался эффективным противомикробным средством против грамположительных бактерий ( Bacillus megaterium ) и грамотрицательных бактерий ( Escherichia coli ), а также оказался противогрибковым против ( Microbotryum violaceum ) и противоводорослевым ( Chlorella fusca ). [ 4 ] Секалоновая кислота D (САД) является токсичным и тератогенным метаболитом. Тератогенные эффекты наблюдались при развитии крыс, подвергшихся воздействию САД, введенного во время внутриутробного развития. [ 1 ] SAD проявлял сильную цитотоксичность в отношении клеток множественной лекарственной устойчивости (MDR) и их родительских клеток. Исследование противоопухолевой активности SAD показало, что он оказывает мощное цитотоксическое действие на SP-клетки за счет индукции ABCG2 деградации за счет активации кальпаина-1 . [ 8 ] Эргофлавин продемонстрировал хорошую противовоспалительную активность и хорошую противораковую активность, включая значительное ингибирование пролиферации, особенно в клетках рака поджелудочной железы, почек и легких. [ 9 ] и может оказывать свое действие посредством механизмов, аналогичных механизмам действия секалоновой кислоты D.
Структура
[ редактировать ]Эргофлавин был впервые выделен в чистом виде из Claviceps purpurea (спорыньи) в 1958 году. [ 10 ] В 1963 году было показано, что это 2,2'-биарилсвязанный димер, и в том же году его структура была подтверждена монокристаллическим рентгеновским анализом. [ 1 ] В течение следующего десятилетия структуры секалоновых кислот A, B, C, D и эргохризина A были точно установлены. [ 11 ] и хотя раньше существовали некоторые разногласия относительно того, были ли они 2,2'-, 4,4'- или даже 2,4'-связанными [ 1 ] было подтверждено, что все они также были 2,2'-связаны между бифенильными остатками. [ 12 ] Во всех известных секалоновых кислотах метильный и метоксикарбонильный заместители расположены транс по отношению друг к другу, а рентгеноструктурный анализ кристаллической структуры секалоновой кислоты А показал, что 2,2'-биарильная связь неплоская и угол между двух бифенильных плоскостей составлял 36,5°. [ 1 ]

Было показано, что тетрагидроксантонсодержащие секалоновые кислоты нестабильны в основных условиях и могут легко подвергаться изомеризации, возникающей в результате замены эфирной связи. [ 1 ] 2-2'-связанная секалоновая кислота А изомеризуется в ДМСО при комнатной температуре с образованием 2-4'-связанной секалоновой кислоты А и 4-4'-связанной секалоновой кислоты А в течение 13 часов с достижением равновесия 3,2:2:1. [ 13 ] Эта изомеризация идет быстрее в присутствии основания (ДМСО/пиридин).
Синтез
[ редактировать ]Общей ключевой особенностью синтеза эргофлавина и секалоновых кислот является биариловая димеризация защищенных йод-арильных мономеров с Cu или Pd. Синтез Уолли эргофлавина 3 из гемиэргофлавина 1 в 1971 году был достигнут путем сочетания с низким выходом двух защищенных мономеров 2-йодгемиегофлавина 2 с медью в условиях реакции Ульмана с последующим снятием защиты кислотой. [ 11 ] [ 12 ]

Аналогичным образом, более сорока лет спустя Порко синтезировал более лабильную секалоновую кислоту D с выходом 60%, включающую связывание двух защищенных йодмономеров через их оловы с CuCl при комнатной температуре. [ 14 ] тогда как Титце достиг аналогичного синтеза секалоновой кислоты E путем сочетания двух защищенных йодмономеров с Pd (OAc) 2 в условиях Сузуки при 70 ° C с выходом 85%. [ 15 ]


Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я Магистр КС; Брезе С. (май 2012 г.). «Ксантоны грибов, лишайников и бактерий: натуральные продукты и их синтез». Химические обзоры . 112 (7): 3717–3776. дои : 10.1021/cr100446h . ПМИД 22617028 .
- ^ Jump up to: а б Веземан Т., Брез С., Мастерс КС (январь 2015 г.). «Ксантоновые димеры: семейство соединений, которое одновременно является распространенным и привилегированным» . Отчеты о натуральных продуктах . 32 (1): 6–28. дои : 10.1039/c4np00050a . ПМИД 25226564 .
- ^ Нойбауэр, Лиза; Допштадт, Джулиан; Хампф, Ганс-Ульрих; Тудзинский, Пол (2016). «Идентификация и характеристика кластера генов эргохрома у фитопатогенного гриба Claviceps purpurea» . Грибковая биология и биотехнология . 3 : 2. дои : 10.1186/s40694-016-0020-z . ISSN 2054-3085 . ПМК 5611617 . ПМИД 28955461 .
- ^ Jump up to: а б с Чжан В., Крон К., Флёрке У., Пескителли Г., Ди Бари Л., Антус С., Куртан Т., Райнхаймер Дж., Дрегер С., Шульц Б. (май 2008 г.). «Новые моно- и димерные члены семейства секалоновых кислот: бленнолиды A – G, выделенные из гриба Blennoria sp». Химия: Европейский журнал . 14 (16): 4913–4923. дои : 10.1002/chem.200800035 . ПМИД 18425741 .
- ^ Чжай А, Чжан Ю, Чжу Х, Лян Дж, Ван Х, Линь Ю, Чен Р (январь 2011 г.). «Секалоновая кислота А снижает цитотоксичность колхицина за счет подавления JNK, p38 MAPK и притока кальция». Нейрохимия Интернэшнл . 58 (1): 85–91. дои : 10.1016/j.neuint.2010.10.016 . ПМИД 21073911 . S2CID 207121053 .
- ^ Чжай, Айфэн; Чжу, Сяонань; Ван, Сюэлань; Чен, Ружу; Ван, Хай (2013). «Секалоновая кислота А защищает дофаминергические нейроны от гибели клеток, вызванной 1-метил-4-фенилпиридинием (MPP +), через митохондриальный путь апоптоза». Европейский журнал фармакологии . 713 (1–3): 58–67. дои : 10.1016/j.ejphar.2013.04.029 . ISSN 0014-2999 . ПМИД 23665112 .
- ^ Милло М., Томаси С., Студзинска Э., Руо И., Бусти Дж. (ноябрь 2009 г.). «Цитотоксические компоненты лишайника Diploicia canescens». Журнал натуральных продуктов . 72 (12): 2177–2180. дои : 10.1021/np9003728 . ПМИД 19919064 .
- ^ Ху, Я-пэн; Тао, Ли-ян; Ван, Фанг; Чжан, Цзянь-е; Лян, Ён Чжу; Фу, Ли-у (2013). «Секалоновая кислота D снизила процент побочных популяций за счет снижения экспрессии ABCG2». Биохимическая фармакология . 85 (11): 1619–1625. дои : 10.1016/j.bcp.2013.04.003 . ISSN 0006-2952 . ПМИД 23583455 .
- ^ Дешмукх С.К., Мишра П.Д., Кулкарни-Алмейда А., Верекар С., Саху М.Р., Периясами Г., Госвами Х., Кханна А., Балакришнан А., Вишвакарма Р. (май 2009 г.). «Противовоспалительная и противораковая активность эргофлавина, выделенного из эндофитного гриба» . Химия и биоразнообразие . 6 (5): 784–789. дои : 10.1002/cbdv.200800103 . ПМИД 19479845 . S2CID 6353623 .
- ^ Эглинтон Дж., Кинг Ф.Е., Ллойд Дж., Лодер Дж.В., Маршалл Дж.Р., Робертсон А., Уолли В.Б. (1958). «373. Химия грибов. Часть XXXV. Предварительное исследование эргофлавина». Журнал Химического общества (возобновленный) : 1833–1842 гг. дои : 10.1039/JR9580001833 .
- ^ Jump up to: а б Хупер Дж.В., Марлоу В., Уолли В.Б., Бортвик А.Д., Боуден Р. (1971). «Химия грибов. Часть LXV. Структуры эргохризина А, изоэргохризина А и эргоксантина, а также секалоновых кислот А, В, С и D». Журнал Химического общества C: Organic . 21 : 3580–3590. дои : 10.1039/J39710003580 . ПМИД 5167268 .
- ^ Jump up to: а б Хупер Дж.В., Марлоу В., Уолли В.Б., Бортвик А.Д., Боуден Р. (1971). «Положение бифенильной связи в пигментах спорыньи. Частичный синтез эргофлавина». Журнал Химического общества D: Химические коммуникации (2): 111–112. дои : 10.1039/C29710000111 .
- ^ Цинь Т., Ивата Т., Рэнсом Т.Т., Бейтлер Дж.А., Порко-младший Дж.А. (ноябрь 2015 г.). «Синтез димерных тетрагидроксантонов с различными связями: исследование свойств «изменения формы»» . Журнал Американского химического общества . 137 (48): 15225–15233. дои : 10.1021/jacs.5b09825 . ПМЦ 4863954 . ПМИД 26544765 .
- ^ Цинь Т., Порко Дж.А. (март 2014 г.). «Полный синтез секалоновых кислот А и D» . Angewandte Chemie, международное издание . 53 (12): 3107–3110. дои : 10.1002/anie.201311260 . ПМЦ 4098722 . ПМИД 24519991 .
- ^ Ганапати Д., Райнер Дж.Р., Леффлер Л.Е., Ма Л., Гнанапракасам Б., Нипёттер Б., Кёне И., Титце Л.Ф. (ноябрь 2015 г.). «Энантиоселективный полный синтез секалоновой кислоты Е». Химия: Европейский журнал . 21 (47): 16807–16810. дои : 10.1002/chem.201503593 . ПМИД 26447631 .