сюжет Аррениуса
Эта статья нуждается в дополнительных цитатах для проверки . ( октябрь 2023 г. ) |
В химической кинетике отображает график Аррениуса константы скорости реакции ( логарифм , ось ординат ), построенная в зависимости от обратной температуры ( , абсцисса ). [1] Графики Аррениуса часто используются для анализа влияния температуры на скорость химических реакций. Для одного термически активированного процесса с ограниченной скоростью график Аррениуса представляет собой прямую линию, по которой энергию активации , так и предэкспоненциальный множитель можно определить как .
Уравнение Аррениуса можно представить в виде: где:
- = константа скорости
- = предэкспоненциальный коэффициент
- = (молярная) энергия активации
- = газовая постоянная , ( , где – постоянная Авогадро ).
- = энергия активации (для одного события реакции)
- = постоянная Больцмана
- = абсолютная температура
Единственная разница между двумя формами выражения — это величина, используемая для энергии активации: первая будет иметь единицу джоуль / моль , которая распространена в химии, а вторая будет иметь единицу джоуля и будет относиться к одной молекулярной реакции. событие, часто встречающееся в физике. Различные единицы учитываются либо с использованием газовой постоянной или постоянная Больцмана .
Если взять натуральный логарифм первого уравнения, получим:
При построении графика описанным выше способом значение точки пересечения оси y (при ) будет соответствовать , а наклон линии будет равен . Значения точки пересечения по оси Y и наклона можно определить по экспериментальным точкам с помощью простой линейной регрессии с помощью электронной таблицы .
Предэкспоненциальный фактор, , является эмпирической константой пропорциональности, которая оценивалась с помощью различных теорий, которые учитывают такие факторы, как частота столкновений между реагирующими частицами, их относительная ориентация и энтропия активации .
Выражение представляет собой долю молекул, присутствующих в газе, которые имеют энергию, равную или превышающую энергию активации при определенной температуре. Практически во всех практических случаях , так что эта доля очень мала и быстро увеличивается с увеличением . В результате константа скорости реакции быстро увеличивается с температурой , как показано на прямом графике против . (Математически при очень высоких температурах, так что , выровнялся бы и приблизился как предел, но в практических условиях этот случай не встречается.)
Рабочий пример
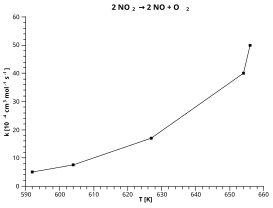
[ редактировать ]Рассмотрим в качестве примера разложение диоксида азота на монооксид азота и молекулярный кислород :
- 2 НО 2 → 2 НО + О 2
На основе красной «линии наилучшего соответствия», изображенной на графике выше:
Точки, считанные с графика:
Наклон красной линии = (4,1–2,2) / (0,0015–0,00165) = –12 667
Пересечение [ значение y в точке x = 0 ] красной линии = 4,1 + (0,0015 × 12667) = 23,1
Вставка этих значений в форму выше: дает:

как показано на графике справа.
для:
- к из 10 −4 см 3 моль −1 с −1
- Т в К
Подставляя частное в показатель степени : где приблизительное значение R составляет 8,31446 Дж К. −1 моль −1
Тогда энергия активации этой реакции по этим данным составит:
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «6.2.3.4: Закон Аррениуса – графики Аррениуса» . Химия LibreTexts . 02.10.2013 . Проверено 14 октября 2023 г.