Карбоксимидат
Эта статья нуждается в дополнительных цитатах для проверки . ( август 2022 г. ) |

Карбоксимидаты (или более общие имидаты ) представляют собой органические соединения, которые можно рассматривать как сложные эфиры, образованные имидовой кислотой (RC(=NR')OH) и спиртом , с общей формулой RC(=NR')OR».
Их также называют иминоэфирами , поскольку они напоминают имины (>C=N-) с атомом кислорода, соединенным с атомом углерода двойной связи C=N. [ 1 ]
Синтез
[ редактировать ]Имидаты могут быть получены несколькими синтетическими путями. [ 2 ] но обычно образуются в результате реакции Пиннера . Это происходит за счет катализируемой кислотой атаки нитрилов спиртами.

Имидаты, полученные таким способом, образуются в виде их гидрохлоридных солей, которые иногда называют солями Пиннера. Карбоксимидаты также образуются в качестве промежуточных продуктов при перегруппировке Мумма и перегруппировке Овермана .
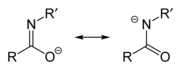
Имидатные/амидатные анионы
[ редактировать ]Амидат /имидат- образуется при депротонировании амида анион или имидовой кислоты . Поскольку амиды и имидовые кислоты являются таутомерами , при депротонировании они образуют один и тот же анион. Таким образом, эти два названия являются синонимами, описывающими один и тот же анион, хотя, возможно, имидат относится к вкладчику резонанса слева, а амидат относится к вкладчику резонанса справа. Однако их различают, когда они действуют как лиганды для переходных металлов: соединения, связанные с O, называются имидатами, а соединения, связанные с N , называются амидатами. Их можно считать азазамещенными аналогами енолятов с формулой RN=C(O − ) Р.
Реакции
[ редактировать ]Карбоксимидаты являются хорошими электрофилами и вступают в ряд реакций присоединения; при этом алифатические имидаты обычно реагируют быстрее, чем ароматические имидаты. [ 2 ] Они могут гидролизоваться с образованием сложных эфиров и аналогичным образом вступать в реакцию с аминами (включая аммиак) с образованием амидинов . Алифатические имидаты реагируют с избытком спирта в условиях кислотного катализа с образованием ортоэфиров RC(OR) 3 . Ароматические имидаты также могут быть превращены, но гораздо менее легко.

Перегруппировка Чепмена
[ редактировать ]Перегруппировка Чепмена представляет собой термическое превращение арил -N -арилбензимидатов в соответствующие амиды посредством внутримолекулярной миграции арильной группы от кислорода к азоту. [ 4 ] Он назван в честь Артура Уильяма Чепмена , который впервые его описал. [ 5 ] и концептуально похож на перегруппировку Ньюмана-Кварта .

Как защитная группа
[ редактировать ]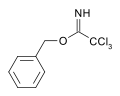
Карбоксимидаты могут действовать как защитная группа для спиртов. [ 6 ] Например, катализируемая основанием реакция бензилового спирта с трихлорацетонитрилом дает трихлорацетимидат . Этот вид обладает ортогональной стабильностью по отношению к защитным средствам ацетата и TBS и может расщепляться кислотным гидролизом. [ 7 ]
См. также
[ редактировать ]- Амидины
- Эфиры
- Имидоилхлорид - вариант «ацилхлорида».
- Оксазолин — соответствующий 5-членный гетероцикл.
Ссылки
[ редактировать ]- ^ «Реакция Пиннера» . Портал органической химии . Бактен, CH: Рето Мюллер . Проверено 26 сентября 2023 г.
- ^ Jump up to: а б Роджер, Роберт; Нилсон, Дуглас Г. (1961). «Химия имидатов». Химические обзоры . 61 (2): 179–211. дои : 10.1021/cr60210a003 .
- ^ Б. П. Манди, М. Г. Эллерд, Ф. Г. Фавалоро: Назовите реакции и реагенты в органическом синтезе , 2. Auflage, Wiley-Interscience, Хобокен, Нью-Джерси, 2005 г. , ISBN 978-0-471-22854-7 , стр. 516.
- ^ Шуленберг, Дж.В.; Арчер, С. (1965). «Перестановка Чепмена». Органические реакции . 14 :1–51. дои : 10.1002/0471264180.или014.01 . ISBN 0471264180 .
- ^ Чепмен, Артур Уильям (1925). «CCLXIX. — Иминоариловые эфиры. Часть III. Молекулярная перегруппировка N- фенилбензиминофенилового эфира». Дж. Хим. соц., пер . 127 : 1992–1998. дои : 10.1039/CT9252701992 .
- ^ Вутс, Питер ГМ; Грин, Теодора В. (2006). Защитные группы в органическом синтезе (4-е изд.). Хобокен, Нью-Джерси: УАЙЛИ. п. 244. ИСБН 978-0-471-69754-1 .
- ^ г.). «Трихлорацетимидат как эффективная защитная группа для спиртов». Synlett . 1999 (6): 753–755 . Ю, Бяо ; Хуэй, Юнчжэн; Хан, Сювэнь (июнь 1999 2736 .