Синтез Паала – Кнорра
| Синтез Паала-Кнорра | |
|---|---|
| Назван в честь | Карл Паал Людвиг Кнорр |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| RSC Идентификатор онтологии | RXNO: 0000161 |
В органической химии синтез Паала -Кнорра — реакция, используемая для синтеза замещенных фуранов , пирролов или тиофенов из 1,4-дикетонов . Это синтетически ценный метод получения замещенных фуранов и пирролов, которые являются общими структурными компонентами многих природных продуктов. Первоначально о нем независимо сообщили немецкие химики Карл Паал и Людвиг Кнорр в 1884 году как о методе получения фуранов, и он был адаптирован для пирролов и тиофенов. [ 1 ] [ 2 ] Хотя синтез Паала-Кнорра получил широкое распространение, механизм не был полностью понят, пока он не был объяснен В. Амарнатом и др. в 1990-е годы. [ 3 ] [ 4 ]
Синтез фурана требует кислотного катализатора: [ 5 ]
В синтезе пиррола участвует первичный амин :
а в тиофене , например, соединение пентасульфид фосфора :
Механизмы
[ редактировать ]Синтез фурана
[ редактировать ]| Синтез фурана Паала-Кнорра | |
|---|---|
| Идентификаторы | |
| Портал органической химии | синтез паал-кнорра-фурана |
| RSC Идентификатор онтологии | RXNO: 0000162 |
Синтез фурана, катализируемый кислотой, протекает путем протонирования одного карбонила, который подвергается атаке образующегося енола другого карбонила. Дегидратация полуацеталя дает фуран. [ 6 ]

Механизм синтеза фурана Паала-Кнорра был выяснен в 1995 г. В. Амарнатом и др . [ 3 ] Работа Амарнатха показала, что диастереомеры 3,4-дизамещенных-2,5-гександионов реагируют с разной скоростью. В общепринятом механизме эти дионы должны проходить через общий енольный промежуточный продукт, а это означает, что мезо- и d,l -рацемические изомеры будут циклизироваться с той же скоростью, с которой они образуются из общего промежуточного продукта. Следствием другой реакции является то, что циклизация должна происходить одновременно с образованием енола. Таким образом, было предложено, чтобы механизм реализовался через атаку протонированного карбонила с образованием енола. Амарнат также обнаружил, что непрореагировавший дион не подвергся конформационной изомеризации, что также указывало на то, что енол не является промежуточным соединением.
Синтез пиррола
[ редактировать ]| Синтез пиррола Паала-Кнорра | |
|---|---|
| Идентификаторы | |
| Портал органической химии | Паал-Кнорр-пиррол-синтез |
| RSC Идентификатор онтологии | RXNO: 0000164 |
Механизм синтеза пиррола был исследован В. Амарнатом и др. в 1991 году. [ 4 ] Его работа предполагает, что протонированный карбонил подвергается атаке амина с образованием гемиаминаля. Амин атакует другой карбонил с образованием производного 2,5-дигидрокситетрагидропиррола, которое подвергается дегидратации с образованием соответствующего замещенного пиррола. [ 7 ]

Реакцию обычно проводят в протонных или кислых условиях Льюиса с использованием первичного амина. Использование гидроксида аммония или ацетата аммония (как сообщил Паал) дает N-незамещенный пиррол.
Синтез тиофена
[ редактировать ]| Синтез тиофена Паала-Кнорра | |
|---|---|
| Идентификаторы | |
| Портал органической химии | Паал-Кнорр-тиофен-синтез |
| RSC Идентификатор онтологии | RXNO: 0000163 |
Синтез тиофена осуществляется по механизму, очень похожему на синтез фурана. Исходный дикетон преобразуется в тиокетон с помощью сульфурирующего агента, который затем подвергается тому же механизму, что и синтез фурана. [ 8 ]

Большинство агентов сульфуризации являются сильными дегидраторами и способствуют завершению реакции. Ранние постулаты о механизме синтеза фурана Паала-Кнорра предполагали, что тиофен был получен путем сульфурирования фуранового продукта. Кампейн и Фой показали, что обработка изолированных фуранов в результате синтеза фуранов Паала-Кнорра пентасульфидом фосфора дала противоречивые результаты с обработкой 1,4-дикарбонилов пентасульфидом фосфора, что исключало сульфирование фуранового механизма и предполагало, что реакция протекает путем сульфурирования дикарбонила с образованием тиокетона . [ 8 ]
Объем
[ редактировать ]
Реакция Паала-Кнорра весьма универсальна. Во всех синтезах почти все дикарбонилы можно превратить в соответствующий гетероцикл. R2 и R5 могут представлять собой H, арил или алкил. R3 и R4 могут представлять собой H, арил, алкил или сложный эфир. В синтезе пиррола (X = N) R1 может представлять собой H, арил, алкил, амино или гидроксил. [ 9 ]
Для проведения этих реакций можно использовать различные условия, большинство из которых являются мягкими. Синтез фурана Паала-Кнорра обычно проводится в водно-кислых условиях с использованием протонных кислот, таких как водный раствор серной или соляной кислоты , или в безводных условиях с использованием кислоты Льюиса или дегидратирующего агента. Обычные дегидратирующие агенты включают пентоксид фосфора , ангидриды или хлорид цинка. Для синтеза пиррола требуется первичный амин в аналогичных условиях, или можно использовать аммиак (или предшественники аммиака). Синтез тиофена требует сульфурирующего агента, который обычно является достаточным дегидратором, такого как пентасульфид фосфора , реактив Ловессона или сероводород .
Традиционно масштабы реакции Паала-Кнорра были ограничены доступностью 1,4-дикетонов в качестве синтетических предшественников. Современные химические методы значительно расширили доступность этих реагентов, а варианты Паала-Кнорра теперь позволяют использовать различные прекурсоры. Также считалось, что метод Паала-Кнорра ограничивается суровыми условиями реакции, такими как длительное нагревание в кислоте, которое может ухудшить чувствительные функциональные группы многих потенциальных предшественников фурана. Современные методы позволяют создавать более мягкие условия, позволяющие вообще избежать нагревания, включая циклизацию , катализируемую микроволновым излучением .
Вариации
[ редактировать ]Вместо 1,4-дикарбонила можно использовать несколько заменителей 1,4-дикарбонила. Хотя эти заместители имеют структуру, отличную от 1,4-дикарбонила, их реакции протекают по механизмам, очень похожим на механизмы Паала-Кнорра.
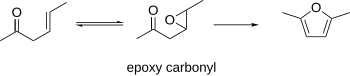
β-эпоксидные карбонилы
[ редактировать ]Известно, что β-эпоксидные карбонилы циклизуются с образованием фуранов. В этой процедуре в качестве исходных материалов можно использовать β-γ-ненасыщенные карбонилы, которые можно эпоксидировать. Полученный эпоксикарбонил можно циклизовать до фурана в кислых или основных условиях. [ 10 ]
1,4-Диол-2-ины
[ редактировать ]Системы 1,4-диол-2-ин также использовались в химии Паала-Кнорра. Используя палладий, 1,4-диол-2-ин можно изомеризовать на месте до соответствующего 1,4-дикетона , а затем дегидратировать до соответствующего фурана с помощью дегидратирующего агента. [ 11 ]

Значение этого варианта заключается в том, что он расширяет возможности метода Паала-Кнорра за счет использования богатства существующей химии ацетилена, в частности, для получения пропаргиловых спиртов.
Ацетали
[ редактировать ]Ацетали также оказались полезными исходными материалами для Паала-Кнорра. Кетон с удаленной от него ацетальной 3-связью может быть превращен в соответствующий гетероцикл точно в тех же условиях, что и 1,4-дикетон.
Паал – Кнорр с помощью микроволновой печи
[ редактировать ]Другим вариантом было введение микроволнового излучения для усиления Паала-Кнорра. Традиционные условия Паала-Кнорра включали длительное нагревание сильных кислот, вызывающее обезвоживание, которое происходило в течение нескольких часов. Было продемонстрировано, что реакции Паала-Кнорра с помощью микроволнового излучения происходят во временных масштабах, измеряемых минутами, и в открытых колбах при комнатной температуре. [ 12 ]
Связанные реакции
[ редактировать ]Синтез пиррола Кнорра , о котором сообщил Кнорр в 1884 году, представляет собой синтез замещенного пиррола из аминокетона и кетона. [ 13 ]
| Синтез пиразола Кнорра | |
|---|---|
| Назван в честь | Людвиг Кнорр |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| RSC Идентификатор онтологии | RXNO: 0000391 |
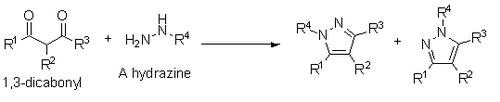
Кнорр также сообщил о синтезе пиразолов из 1,3-дикарбонилов и гидразинов , гидразидов или семибикарбазидов. Этот синтез происходит по механизму конденсации, аналогичному механизму Паала-Кнорра, однако, если используется замещенный гидразин, это приводит к смеси региоизомеров, где замещенный гетероатом находится либо рядом с заместителем R1, либо с заместителем R3. [ 14 ]
Синтетические приложения
[ редактировать ]В 2000 году Б.М. Трост и др. сообщили об официальном синтезе антибиотика розофилина. Путь Троста к макроциклическому ядру розеофилина, как и другие, основывался на синтезе пиррола Паала-Кнорра для получения конденсированного пиррола. [ 15 ] Нагревание 1,4-дикетона с ацетатом аммония в метаноле с камфорсульфоновой кислотой и молекулярными ситами 4 ангстрем привело к образованию пиррола без N-замещения. обрабатывали триметилсилилэтоксиметоксихлоридом Было обнаружено, что этот пиррол нестабилен, и поэтому перед выделением его (SEM-Cl) для защиты пиррола.

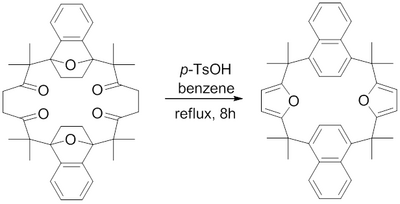
В 1982 г. Х. Харт и др. сообщили о синтезе макроцикла, содержащего конденсированные фурановые кольца, с использованием синтеза фурана Паала-Кнорра. [ 16 ] Было обнаружено, что кипячение пара -толуолсульфоновой кислоты в бензоле дегидратирует 1,4-дикетоны до соответствующих фуранов, что позволяет получить сложные макроциклические конденсированные фураны.
См. также
[ редактировать ]- Синтез пиррола Ганча
- Синтез пиррола Кнорра
- Синтез Файста – Бенари
- Циклизация Фольхарда – Эрдмана
- Синтез пиридина Ганча
Ссылки
[ редактировать ]- ^ Паал, К. (1884), «О производных ацетоуксусного эфира ацетофенона и ацетонилацетоуксусного эфира» , отчеты Немецкого химического общества , 17 (2): 2756–2767, doi : 10.1002/cber.188401702228
- ^ Кнорр, Л. (1884), «Синтез производных фурфурана из эфира диацецянтарной кислоты» , Отчеты Немецкого химического общества , 17 (2): 2863–2870, doi : 10.1002/cber.188401702254
- ^ Перейти обратно: а б Амарнатх, В.; Амарнат, К. (1995), «Промежуточные соединения в синтезе фуранов Паала-Кнорра», Журнал органической химии , 60 (2): 301–307, doi : 10.1021/jo00107a006
- ^ Перейти обратно: а б Амарнатх, В.; Энтони, округ Колумбия; Амарнатх, К.; Валентин, ВМ; Веттерау, Луизиана; Грэм, Д.Г. (1991), «Промежуточные соединения пирролов в синтезе Паала-Кнорра», Журнал органической химии , 56 (24): 6924–6931, doi : 10.1021/jo00024a040
- ^ Томас Л. Гилкрист (1987). Гетероциклическая химия . Харлоу: Longman Scientific. ISBN 0-582-01421-2 .
- ^ Ласло Курти; Барбара Чако (2005), Стратегическое применение названных реакций в органическом синтезе , Elsevier Science & Technology Books, ISBN 9780123694836
- ^ Адальберт Волльраб (1999), Органическая химия (на немецком языке), Springer-Verlag, стр. 850, ISBN 3-540-43998-6
- ^ Перейти обратно: а б Кампан, Э.; Фой, WO (1952), «Синтез 2,5-диарилтиофена», Журнал органической химии , 17 (10): 1405–1412, doi : 10.1021/jo50010a023
- ^ Холман, Р.В. (2005), «Стратегическое применение названных реакций в органическом синтезе: предыстория и подробные механизмы (Кюрти, Ласло; Чако, Барбара)», Журнал химического образования , 82 (12): 1780, Бибкод : 2005JChEd..82S1780H , дои : 10.1021/ed082p1780.3
- ^ Кормье, РА; Фрэнсис, доктор медицинских наук (1981), «Перегруппировка эпоксикетона и фурана», Synthetic Communications , 11 (5): 365, doi : 10.1080/00397918108064300
- ^ Джи, Дж.; Лу, X. (1993), «Легкий синтез 2,5-дизамещенных фуранов с помощью палладиевого комплекса и перфторированной смолы, катализируемой сульфоновой кислотой изомеризации-дегидратации алкиндиолов», Журнал Химического общества, Chemical Communications (9): 764–765, doi : 10.1039/C39930000764
- ^ Минетто, Дж.; Равелья, LF; Таддеи, М. (2004), «Реакция Паала-Кнорра с помощью микроволновой печи. Быстрый подход к замещенным пирролам и фуранам», Organic Letters , 6 (3): 389–392, doi : 10.1021/ol0362820 , PMID 14748600
- ^ Кнорр, Л. (1884), «Синтез производных пиррола» , Отчеты Немецкого химического общества , 17 (2): 1635–1642, doi : 10.1002/cber.18840170220
- ^ Кнорр, Л. (1883), «Действие ацетоуксусного эфира на фенилгидразин» , Отчеты Немецкого химического общества , 16 (2): 2597–2599, номер документа : 10.1002/cber.188301602194.
- ^ Трост, Б.М.; Доэрти, Джорджия (2000), «Асимметричный синтез трициклического ядра и формальный полный синтез розеофилина посредством метатезиса энина», Журнал Американского химического общества , 122 (16): 3801–3810, doi : 10.1021/ja9941781
- ^ Харт, Х.; Такехира, Ю. (1982), «Аддукты, полученные из макроциклов фурана и бензона», Журнал органической химии , 47 (22): 4370–4372, doi : 10.1021/jo00143a049


