3D клеточная культура
3D -культура клеток — это искусственно созданная среда, в которой биологическим клеткам разрешено расти или взаимодействовать с окружающей средой во всех трех измерениях. В отличие от 2D-среды (например, чашки Петри ), 3D-культура клеток позволяет клеткам in vitro расти во всех направлениях, подобно тому, как это происходит in vivo . [1] Эти трехмерные культуры обычно выращивают в биореакторах, небольших капсулах, в которых клетки могут превращаться в сфероиды, или в трехмерные клеточные колонии. В одном биореакторе обычно культивируют около 300 сфероидов. [1]
Фон
[ редактировать ]3D-культуры клеток используются в исследованиях уже несколько десятилетий. [2] Один из первых зарегистрированных подходов к их разработке был сделан в начале 20-го века, когда Алексис Каррел разработал методы длительного культивирования тканей in vitro. [3] Ранние исследования 80-х годов, проведенные Миной Бисселл из Национальной лаборатории Лоуренса в Беркли , подчеркнули важность 3D-методов для создания точных моделей культивирования in vitro. Эта работа была сосредоточена на важности внеклеточного матрикса и способности культур в искусственных 3D-матрицах производить физиологически значимые многоклеточные структуры, такие как ацинарные структуры в моделях здоровой и раковой ткани молочной железы. Эти методы были применены к моделям заболеваний in vitro, используемым для оценки клеточных ответов на фармацевтические соединения. [4]
Эрик Саймон в отчете о гранте NIH SBIR 1988 года показал, что электропрядение можно использовать для производства нано- и субмикронных волокнистых матов из полистирола и поликарбоната (теперь известных как каркасы), специально предназначенных для использования в качестве клеточных субстратов in vitro. Это раннее использование электроформованных волокнистых решеток для клеточной культуры и тканевой инженерии показало, что различные типы клеток, включая фибробласты крайней плоти человека (HFF), трансформированную карциному человека (HEp-2) и эпителий легких норки (MLE), будут прилипать к волокнам и размножаться на них. . Было отмечено, что в отличие от уплощенной морфологии, обычно наблюдаемой в 2D-культуре, клетки, выращенные на волокнах электропрядения, демонстрировали более гистотипическую округлую трехмерную морфологию, обычно наблюдаемую in vivo. [5]
3D-культура клеток, имитируя основные аспекты среды in vivo, включая взаимодействие между клетками и внеклеточным матриксом, позволяет точно воссоздать структурную архитектуру и специализированные функции в нормальных тканях или опухолях в лабораторных условиях. Этот подход достоверно моделирует условия и процессы в живых тканях, вызывая реакции, аналогичные тем, которые наблюдаются in vivo. С момента своего создания в 1970-х годах 3D-культура клеток дала существенное представление о механизмах, регулирующих гомеостаз тканей и рак. [6] Более того, он ускорил трансляционные исследования в области биологии рака и тканевой инженерии. [7]
Характеристики
[ редактировать ]В живой ткани клетки существуют в трехмерном микроокружении со сложными межклеточными взаимодействиями и межклеточными взаимодействиями, а также со сложной динамикой транспорта питательных веществ и клеток. [8] [9] [10] [11] [12] [13] [14] [15] [16] Стандартные двумерные или однослойные клеточные культуры не являются адекватным представлением этой среды, что часто делает их ненадежными предикторами in vivo . эффективности и токсичности лекарств [17] [14] 3D-сфероиды больше напоминают ткани in vivo с точки зрения клеточной коммуникации и развития внеклеточного матрикса . [1] Эти матрицы помогают клеткам двигаться внутри своего сфероида аналогично тому, как клетки перемещаются в живой ткани. [10] Таким образом, сфероиды представляют собой улучшенные модели клеточной миграции , дифференциации , выживания и роста. [15] Кроме того, 3D-культуры клеток обеспечивают более точное изображение поляризации клеток, поскольку в 2D клетки могут быть поляризованы только частично. [10] Более того, клетки, выращенные в 3D, демонстрируют иную экспрессию генов, чем клетки, выращенные в 2D. [10]
Третье измерение клеточного роста обеспечивает больше контактного пространства для механических воздействий и клеточной адгезии , что необходимо для лигирования интегрина , сокращения клеток и даже внутриклеточной передачи сигналов. [18] [19] Нормальная диффузия растворенных веществ и связывание с эффекторными белками (такими как факторы роста и ферменты ) также зависят от трехмерного клеточного матрикса, поэтому это имеет решающее значение для установления градиентов концентрации растворенных веществ в тканевом масштабе. [20] [21]
Для целей токсикологического скрининга лекарств гораздо полезнее тестировать экспрессию генов в клетках in vitro, выращенных в 3D, чем в 2D, поскольку экспрессия генов в 3D-сфероидах будет больше напоминать экспрессию генов in vivo. Наконец, 3D-культуры клеток обладают большей стабильностью и продолжительностью жизни, чем клеточные культуры в 2D. [22] Это означает, что они больше подходят для долгосрочных исследований и для демонстрации долгосрочных эффектов препарата. Трехмерная среда также позволяет клеткам беспрепятственно расти. В 2D клетки должны подвергаться регулярной трипсинизации , чтобы обеспечить их достаточным количеством питательных веществ для нормального роста клеток. [23] 3D-сфероиды культивировались в лабораторных условиях в течение 302 дней, сохраняя при этом здоровый, нераковый рост. [22]
В междисциплинарных исследованиях в области биологии и аэрокосмической отрасли 3D-печатные каркасы также используются для защиты клеток от воздействия гравитации во время запуска. [24]
Классификация методов 3D-культуры
[ редактировать ]Существует большое количество коммерчески доступных инструментов для культивирования, которые, как утверждают, обеспечивают преимущества 3D-культуры клеток. В общем, платформы можно разделить на два типа методов 3D-культивирования: методы с каркасами и методы без каркасов .
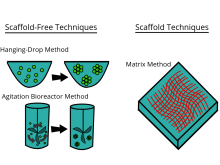
Техника строительных лесов
[ редактировать ]Методы создания каркасов включают использование твердых каркасов, гидрогелей и других материалов. В недавнем исследовании потенциальные возможности стволовых клеток CD34+ человека изучались путем создания 3D-модели в агарозном геле in vitro для понимания процесса окостенения костей. [25] Каркасы можно использовать для создания 3D-модели микроткани путем культивирования фибробластов вне опухолевых клеток, имитируя взаимодействие стромы опухоли. [26]
На эффективность каркасов в различных приложениях, особенно в тканевой инженерии, существенно влияют такие факторы, как распределение пор, площадь открытой поверхности и пористость. Количество и расположение этих элементов влияют как на глубину, так и на скорость проникновения клеток в объем каркаса, на структуру образующегося внеклеточного матрикса и, в конечном итоге, на успех регенеративного процесса. [27] Каркасы могут быть изготовлены с различной архитектурой в зависимости от метода производства, что приводит либо к случайному, либо к точно рассчитанному распределению пор. [28] Недавно для создания каркасов с хорошо организованной геометрией были использованы передовые методы быстрого прототипирования с компьютерным управлением. [29]
Гидрогели
[ редактировать ]Поскольку природный внеклеточный матрикс (ЕСМ) важен для выживания, пролиферации, дифференцировки и миграции клеток, различные гидрогелевые матрицы, имитирующие естественную структуру ЕСМ, рассматриваются как потенциальные подходы к культивированию клеток, подобному in vivo. [30] [31] [32] Гидрогели состоят из взаимосвязанных пор с высокой степенью удержания воды, что обеспечивает эффективный транспорт, например, питательных веществ и газов. Для 3D-культуры клеток доступно несколько различных типов гидрогелей из природных и синтетических материалов, включая, например, гидрогели экстракта ЕСМ животных, белковые гидрогели, пептидные гидрогели, полимерные гидрогели и гидрогель наноцеллюлозы на основе древесины .
Подход к созданию оптимальной реплики ЕСМ зависит от конкретных характеристик рассматриваемой культуры и обычно включает использование разнообразных и независимых химических процессов. [33] Например, использование фотолабильных химических веществ может привести к эрозии определенных областей внутри геля, а последующее обнажение этих областей позволяет применять адгезивные лиганды, способствующие адгезии и миграции клеток. [34] Ожидается разработка более сложных структур, включающих переплетенные сети химических веществ под контролем как клеток, так и пользователей. По сути, не существует единой сети, способной точно имитировать сложный ЕСМ каждого типа ткани. Однако продуманная интеграция биоинспирированных сигналов в синтетические гели потенциально может создать устойчивые и универсальные каркасы, применимые в различных системах клеточных культур. [35]
Безкаркасные методы
[ редактировать ]Методы без каркасов используют другой подход, независимый от используемого каркаса. Методы без каркасов включают, например, использование пластин с низкой адгезией, подвесных пластин, поверхностей с микроузорами и вращающихся биореакторов , магнитной левитации и магнитной 3D-биопечати .
Сфероиды
[ редактировать ]
Сфероиды — это тип трехмерного моделирования клеток, который лучше имитирует условия окружающей среды живой клетки по сравнению с двумерной моделью клетки, в частности, реакции между клетками и реакции между клетками и матриксом. [37] Сфероиды полезны при изучении изменения физиологических характеристик клеток. [38] различие в строении здоровых клеток и опухолевых клеток, а также изменения, которым подвергаются клетки при формировании опухоли. [39] Сфероиды, культивированные совместно с опухолевыми и здоровыми клетками, использовались для моделирования взаимодействия раковых клеток с нормальными клетками. [40] Сфероиды также можно культивировать совместно с фибробластами, чтобы имитировать взаимодействие опухоли и стромы. [41] Сфероиды можно выращивать несколькими различными методами. Одним из распространенных методов является использование планшетов с низкой клеточной адгезией, обычно 96-луночных планшетов, для массового производства сфероидных культур, где агрегаты образуются на закругленном дне клеточных планшетов. [36] [42] Сфероиды также можно культивировать методом висячей капли. [43] включающий образование агрегатов клеток в каплях, свисающих с поверхности клеточной пластинки. [37] Другие исследуемые методы включают использование биореакторов с вращающимися стенками сосудов, которые вращают и культивируют клетки, когда они постоянно находятся в свободном падении, и образуют агрегаты слоями. [44] Недавно некоторые протоколы были стандартизированы для получения однородных и надежных сфероидов. [45] Исследователи также изучили стандартизированные, экономичные и воспроизводимые методы трехмерной культуры клеток. [46] Чтобы улучшить воспроизводимость и прозрачность экспериментов со сфероидами, международный консорциум разработал MISpheroID (Минимальная информация в идентификации сфероидов). [47]
Клюстероиды
[ редактировать ]кластероиды — это тип трехмерного моделирования клеток, похожий на сфероиды, но отличающийся методом создания; выращивают в виде кластеров клеток в водной двухфазной системе эмульсии Пикеринга «вода в воде», используя межфазное натяжение и осмотическую усадку для упаковки клеток в плотные кластеры, которые затем культивируют в гидрогеле в тканях или органоидах . [48] [49]
При отсутствии кровеносных сосудов кислородная проницаемость ухудшается во время образования некротического ядра, что препятствует использованию 3D-клеточной культуры ex vivo. Существует шаблон эмульсии, который может решить эту проблему. Этот подход позволил исследователям скорректировать клеточный состав для достижения идеальных условий для стимулирования синтеза различных маркеров ангиогенных белков в совместно культивируемых кластероидах. [49] Клетки HUVEC реагируют на присутствие клеток Hep-G2 и их производных путем образования ростков эндотелиальных клеток в матригеле, причем все это без внешнего введения фактора роста эндотелия сосудов (VEGF) или других агентов, индуцирующих ангиогенез. [50] [51] Репликация этого метода культивирования проста для создания различных сфероидов для совместной культуры клеток. [52] Шаблон с эмульсией Пикеринга значительно помогает в построении трехмерных моделей совместной культуры, предлагая значительный потенциал для применения в тестировании лекарств и тканевой инженерии. [53]
Биореакторы
[ редактировать ]Биореакторы, используемые для 3D-культур клеток, представляют собой небольшие пластиковые цилиндрические камеры, специально разработанные для выращивания клеток в трех измерениях. В биореакторе используются биоактивные синтетические материалы, такие как мембраны из полиэтилентерефталата, для окружения сфероидных клеток в среде, поддерживающей высокий уровень питательных веществ. [54] [55] Их легко открывать и закрывать, поэтому сфероиды клеток можно вынимать для тестирования, при этом в камере сохраняется 100% влажность. [1] Эта влажность важна для достижения максимального роста и функционирования клеток. Камера биореактора является частью более крупного устройства, которое вращается, чтобы обеспечить одинаковый рост клеток в каждом направлении в трех измерениях. [1]
Компания MC2 Biotek разработала биореактор для инкубации прототканей, который использует газообмен для поддержания высокого уровня кислорода в клеточной камере. [56] Это улучшение по сравнению с предыдущими биореакторами, поскольку более высокий уровень кислорода помогает клеткам расти и нормально дышать. [15]
Совместные усилия фирм тканевой инженерии (TE), академических учреждений и промышленных партнеров могут способствовать преобразованию биореакторов, ориентированных на исследования, в эффективные коммерческие производственные системы. [57] Академические сотрудники вносят основополагающие аспекты, а промышленные партнеры предоставляют необходимые элементы автоматизации, обеспечивая соответствие нормативным стандартам и удобство для пользователя. [58] Известные консорциумы в Европе, такие как REMEDI, AUTOBONE и STEPS, сосредоточены на разработке автоматизированных систем для оптимизации разработки аутологичных клеточных трансплантатов. [59] Цель состоит в том, чтобы соответствовать нормативным критериям и гарантировать экономическую эффективность, делая продукты тканевой инженерии более клинически доступными и продвигая трансляционную парадигму TE от исследований к конкурентоспособной коммерческой области. [60]
Микрофлюидика
[ редактировать ]Использование микрофлюидной технологии облегчает создание сложных микромасштабных структур и точное манипулирование параметрами, тем самым имитируя клеточную среду in vivo. Интеграция микрофлюидной технологии с 3D-культурой клеток имеет значительный потенциал для приложений, стремящихся воспроизвести характеристики тканей in vivo, примером чего, в частности, является развивающаяся система «орган-на-чипе». [61] Различные клеточные структуры человеческого тела должны быть васкуляризированы , чтобы получать питательные вещества и газообмен , чтобы выжить. Точно так же 3D-клеточные культуры in vitro требуют определенного уровня циркуляции жидкости, что может быть проблематичным для плотных 3D-культур, где не все клетки могут иметь достаточный доступ к питательным веществам. Это особенно важно для культур гепатоцитов , поскольку печень является органом с высокой васкуляризацией. В одном исследовании гепатоциты и сосудистые клетки культивировались вместе на каркасе из коллагенового геля между микрофлюидными каналами, сравнивались рост клеток в статической и проточной средах и была показана необходимость в моделях с тканями и микрососудистой сетью. [62] Другое исследование показало, что устройство для совместного культивирования сфероидов на основе висячей капли может быть полезным, генерируя два разных клеточных сфероида в соседних каналах микрожидкостного устройства висячей капли и совместно культивируя сфероиды со сливающимися каплями для мониторинга ангиогенеза, индуцированного опухолью. [63]
Микрофлюидная 3D-культура клеток с ее потенциальным применением в биомедицинских исследованиях и тканевой инженерии является областью растущего интереса. Однако его продвижение сопровождается рядом серьезных проблем. [64] Одна из таких проблем связана с трудностью доступа к культивируемым клеткам внутри микросистем в сочетании со сложной природой извлечения образцов для последующих анализов. [65] Кроме того, разработка методологий и устройств, предназначенных для изучения клеточного метаболизма и функций in vivo, а также открытие лекарств представляет собой серьезное препятствие для микрофлюидных устройств для 3D-культуры клеток. [66] Еще одним заслуживающим внимания препятствием является ограниченная доступность приборов для микропроизводства в обычных биологических лабораториях. Более того, коммерциализация зрелых и удобных в использовании микрофлюидных устройств представляет собой серьезную проблему, затрудняющую их доступность для биологов. [67] Наконец, в то время как биологи часто ищут высокопроизводительные инструменты анализа с оптимальной воспроизводимостью, микрофлюидика сталкивается с техническими ограничениями в удовлетворении этих требований, несмотря на потенциальную осуществимость параллельных анализов. [68]
Высокопроизводительный скрининг
[ редактировать ]Расширенная разработка 3D-моделей для высокопроизводительного скрининга в форматах высокой плотности в последнее время стала возможной благодаря технологическим достижениям, связанным с увеличением плотности микропланшетов . Их можно найти в форматах с 384 и 1536 лунками, которые отталкивают клетки, экономичны и подходят для полностью автоматизированных платформ скрининга. [69] Два варианта, которые позволяют использовать форматы с 1536 лунками, доступны в Greiner Bio-One с использованием магнитной 3D-биопечати m3D. [70] и Corning Life Sciences, которая включает покрытие поверхности со сверхнизким прилеганием, а также геометрию микрополостей и гравитацию для создания 3D-моделей. [71] [72] Благодаря быстрым и доступным методам и технологиям, разработанным для 3D-скрининга, стали доступны параллельные высокопроизводительные подходы скрининга для тестирования изогенных пар мутантов, связанных с онкогенами, по сравнению с диким типом. [73] Более того, методы высокопроизводительного скрининга играют ключевую роль в объединении областей фармакологии и токсикологии в рамках 3D-культуры клеток.
Фармакология и токсикология
[ редактировать ]Основной целью выращивания клеток в 3D-каркасах и в виде 3D-клеточных сфероидов in vitro является проверка фармакокинетических и фармакодинамических эффектов лекарств и наноматериалов в доклинических испытаниях. [15] [74] [75] [76] [77] Токсикологические исследования показали, что 3D-культуры клеток почти не уступают исследованиям in vivo с целью проверки токсичности лекарственных соединений. При сравнении значений LD50 для 6 распространенных препаратов: ацетаминофена , амиодарона , диклофенака , метформина , фенформина и вальпроевой кислоты значения 3D-сфероидов напрямую коррелировали с показателями исследований in vivo. [78] Хотя 2D-клеточные культуры ранее использовались для проверки токсичности наряду с исследованиями in vivo, 3D-сфероиды лучше подходят для тестирования токсичности при хроническом воздействии из-за их большей продолжительности жизни. [79] Матрица в 3D-сфероидах заставляет клетки сохранять актиновые нити и более важна с физиологической точки зрения для организации цитоскелета, а также полярности и формы клеток человека. [80] Трехмерное расположение позволяет культурам создать модель, которая более точно напоминает человеческую ткань in vivo, без использования подопытных животных. [81]
Текущие протоколы оценки потенциальных лекарств и оценки токсичности во многом зависят от результатов, полученных на ранних стадиях клеточных анализов in vitro, с ожиданием, что эти анализы точно отразят критические аспекты фармакологии и токсикологии in vivo. [82] Различные конструкции in vitro были настроены на высокую производительность для повышения эффективности скрининга, что позволяет исчерпывающим библиотекам потенциально фармакологически значимых или потенциально токсичных молекул подвергаться тщательному изучению на предмет клеточных сигналов, указывающих на повреждение тканей или соответствующих терапевтическим целям. [83] Инновационные подходы к разработке мультиплексных клеточных анализов, включающие выбор конкретных типов клеток, сигнальных путей и репортеров, стали стандартной практикой. [84]
Несмотря на эти достижения, значительный процент новых химических и биологических объектов (NCE/NBE) сталкивается с неудачами на поздних стадиях тестирования лекарств на людях. Некоторые из них получают предупреждения «черного ящика» регулирующих органов, в то время как другие изымаются с рынка из-за проблем безопасности после получения одобрения регулирующих органов. [85] Эта повторяющаяся картина подчеркивает неадекватность клеточных анализов in vitro и последующих доклинических исследований in vivo для получения полных данных о фармакологии и токсичности или надежной прогностической способности для понимания эффективности потенциальных лекарств in vivo. [86]
Отсутствие надежного набора инструментов для трансляционного анализа для фармакологии и токсикологии способствует высокой стоимости и неэффективности перехода от первоначального клеточного скрининга in vitro к тестированию in vivo и последующим клиническим одобрениям. [87] Особое внимание уделяется их способности сохранять важные клеточные и молекулярные взаимодействия, а также физиологические параметры, влияющие на фенотипы клеток и реакцию на биологически активные агенты. Отличительные преимущества и проблемы, связанные с этими моделями, тщательно изучаются с особым акцентом на их пригодность для клеточных анализов и их прогностические возможности, имеющие решающее значение для установления точных корреляций с механизмами токсичности лекарств in vivo. [88]
При оценке безопасности и эффективности эти модели хорошо подходят для моделирования широкого спектра болезненных состояний. Каждая из этих моделей имеет преимущества и ограничения, которые требуют разработки модели и интерпретации данных. Государственно-частное партнерство имеет решающее значение для продвижения и стимулирования исследований в этой области. [89]
Критика
[ редактировать ]Существующие 3D-методы не лишены ограничений, включая масштабируемость, воспроизводимость, чувствительность и совместимость с инструментами высокопроизводительного скрининга (HTS). HTS на основе клеток основан на быстром определении клеточного ответа на взаимодействие с лекарственными средствами, например, зависимой от дозы жизнеспособности клеток, взаимодействия клетка-клетка/клетка-матрица и/или миграции клеток, но доступные анализы не оптимизированы для трехмерного культивирования клеток. Еще одна проблема, с которой сталкивается 3D-культивирование клеток, — это ограниченное количество данных и публикаций, посвященных механизмам и корреляциям взаимодействия лекарств, дифференциации клеток и передачи сигналов клетками в этих 3D-средах. Ни один из 3D-методов еще не заменил 2D-культивирование в больших масштабах, в том числе в процессе разработки лекарств ; хотя количество публикаций по 3D-культуре клеток быстро растет, текущие ограниченные биохимические характеристики 3D-тканей уменьшают внедрение новых методов.
Лекарственное повреждение печени (ЛПП) является основной причиной сокращения числа соединений в фармацевтической сфере в ходе разработки лекарств. [90] Для превентивной оценки токсичности соединений перед началом лабораторных испытаний на животных на протяжении многих лет использовался ряд анализов токсичности на клеточных культурах in vitro. [91] Хотя двумерные (2D) модели клеточных культур in vitro широко используются и внесли значительный вклад в наше понимание, они часто имеют ограничения в точном воспроизведении естественных структур тканей in vivo. [92] Хотя наиболее логичный метод тестирования предполагает участие людей, этические ограничения, связанные с испытаниями на людях, создают серьезные проблемы. [93] Следовательно, существует острая необходимость в улучшенных, актуальных для человека и прогнозирующих моделях для преодоления этих ограничений. [94]
За последнее десятилетие были предприняты значительные усилия, направленные на развитие трехмерных (3D) моделей клеточных культур in vitro, чтобы лучше имитировать физиологические условия in vivo. Внутренние преимущества 3D-культуры клеток заключаются в ее способности отображать клеточные взаимодействия, аналогичные тем, которые происходят in vivo. При соответствующей проверке 3D-модели клеточных культур могут служить ключевым посредником, устраняющим разрыв между традиционными 2D-моделями клеточных культур и моделями животных in vivo. В этом обзоре предпринята попытка предложить всесторонний обзор проблем, связанных с чувствительностью биомаркеров, используемых при обнаружении ЛПП во время разработки лекарств. [95] Кроме того, он исследует потенциал 3D-моделей клеточных культур для устранения существующих пробелов в текущей парадигме, предлагая многообещающий путь для более точной оценки токсичности. [96]
Существуют также проблемы с использованием сфероидов в качестве модели раковой ткани. Несмотря на то, что опухолевые сфероиды полезны для 3D-культуры тканей, их критиковали за то, что ими сложно или невозможно «манипулировать градиентами растворимых молекул в конструкциях [3D-сфероидов] и характеризовать клетки в этих сложных градиентах», в отличие от 3D-культуры клеток на бумажной подложке для биоанализы на основе тканей, исследованные Ratmir et al. [55] Дополнительные проблемы, связанные со сложными методами 3D-культуры клеток, включают: визуализацию из-за больших размеров каркаса и несовместимости со многими флуоресцентными микроскопами, проточную цитометрию, поскольку она требует диссоциации сфероидов в суспензию отдельных клеток, и автоматизацию обработки жидкостей. [97]
2D-модели не могут изучать межклеточные взаимодействия и межклеточные взаимодействия. В результате нехватки доклинических моделей, относящихся к 2D-культурам, [98] [12] [99] 3D-культура обеспечивает патофизиологическую микросреду и потенциально может сыграть роль в открытии лекарств от рака. [100] [101] [102] [103] [104]
Тканевая инженерия требует трехмерных клеточных каркасов. В качестве биоматериалов ученые использовали различные природные и синтетические полимерные гидрогели для создания 3D-каркасов. Поскольку этот барьер представляет собой структуру, имитирующую естественное микроокружение внеклеточного матрикса, синтетические каркасы могут быть более полезны для изучения конкретных онкогенных стадий. [35] Наконец, предлагается тщательно выбирать наиболее подходящие трехмерные модели в соответствии с конкретными целями. [104]
См. также
[ редактировать ]- Клеточная культура
- Клеточные линии
- Анализ клеточной культуры
- Гидрогель
- почек собак Мадина-Дарби Линия клеток
- Микрофизиометрия
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и Фей С., Вжесински К. (2013). «Определение порогов острой и хронической летальности вальпроевой кислоты с использованием трехмерных сфероидов, созданных из клеточной линии бессмертных гепатоцитов человека HEPG2/C3A» (PDF) . В Баучере А (ред.). Вальпроевая кислота . Nova Science Publishers, Inc., стр. 141–165. ISBN 978-1-62417-952-5 . Архивировано из оригинала (PDF) 2 декабря 2013 года.
- ^ Мапанао АК, Волиани В (июнь 2020 г.). «Трехмерные модели опухолей: содействие прорывам в трансляционных исследованиях нанотераностики». Прикладные материалы сегодня . 19 : 100552. doi : 10.1016/j.apmt.2019.100552 . S2CID 213634060 .
- ^ Каррел А. (май 1912 г.). «О постоянной жизни тканей вне организмов» . Журнал экспериментальной медицины . 15 (5): 516–28. дои : 10.1084/jem.15.5.516 . ПМК 2124948 . ПМИД 19867545 .
- ^ Лауреат премии MERIT: Мина Дж. Бисселл, доктор философии. (без даты). Получено 16 июня 2016 г. с http://www.cancer.gov/research/nci-role/spotlight/merit/Bissell. Архивировано 17 сентября 2020 г. в Wayback Machine.
- ^ Саймон, Эрик М. (1988). «Заключительный отчет фазы I Национального института здравоохранения: волокнистые субстраты для клеточных культур (R3RR03544A) (доступна загрузка в формате PDF)» . Исследовательские ворота . Проверено 22 мая 2017 г.
- ^ Сюй Ц, Ян М, Тан Ю (2023). «Метод 3D-аутологичной культуры для прецизионной онкологии». Раковые системы и интегративная биология . Методы Мол Биол. Том. 2660. стр. 61–68. дои : 10.1007/978-1-0716-3163-8_5 . ISBN 978-1-0716-3162-1 . ПМИД 37191790 .
- ^ Коледова З. (2017). «3D-клеточная культура: Введение». 3D-культура клеток . Методы Мол Биол. Том. 1612. стр. 1–11. дои : 10.1007/978-1-4939-7021-6_1 . ISBN 978-1-4939-7019-3 . ПМИД 28634931 .
- ^ Маркс, Вивьен (11 апреля 2013 г.). «Лучшее пиво» (PDF) . Природа . Проверено 9 июля 2013 г.
- ^ Соуза Г.Р., Молина Дж.Р., Рафаэль Р.М., Озава М.Г., Старк Д.Д., Левин К.С. и др. (апрель 2010 г.). «Трехмерная культура тканей на основе магнитной левитации клеток» . Природные нанотехнологии . 5 (4): 291–6. Бибкод : 2010НатНа...5..291С . дои : 10.1038/nnano.2010.23 . ПМЦ 4487889 . ПМИД 20228788 .
- ^ Перейти обратно: а б с д Пампалони Ф., Рейно Э.Г., Стельцер Э.Х. (октябрь 2007 г.). «Третье измерение устраняет разрыв между клеточной культурой и живой тканью». Nature Reviews Молекулярно-клеточная биология . 8 (10): 839–45. дои : 10.1038/nrm2236 . ПМИД 17684528 . S2CID 23837249 .
- ^ Чун Т.Х., Хотари К.Б., Сабе Ф., Салтиэль А.Р., Аллен Э.Д., Вайс С.Дж. (май 2006 г.). «Перицеллюлярная коллагеназа управляет трехмерным развитием белой жировой ткани» . Клетка . 125 (3): 577–91. дои : 10.1016/j.cell.2006.02.050 . ПМИД 16678100 . S2CID 15822397 .
- ^ Перейти обратно: а б Ямада К.М., Кукиерман Э (август 2007 г.). «Моделирование морфогенеза тканей и рака в 3D» . Клетка . 130 (4): 601–10. дои : 10.1016/j.cell.2007.08.006 . ПМИД 17719539 . S2CID 9233152 .
- ^ Фридрих Дж., Зайдель С., Эбнер Р., Кунц-Шугарт Л.А. (12 февраля 2009 г.). «Скрининг наркотиков на основе сфероидов: соображения и практический подход». Протоколы природы . 4 (3): 309–24. дои : 10.1038/nprot.2008.226 . ПМИД 19214182 . S2CID 21783074 .
- ^ Перейти обратно: а б Прествич Г.Д. (август 2007 г.). «Упрощение внеклеточного матрикса для трехмерной клеточной культуры и тканевой инженерии: прагматический подход». Журнал клеточной биохимии . 101 (6): 1370–83. дои : 10.1002/jcb.21386 . ПМИД 17492655 . S2CID 45152239 .
- ^ Перейти обратно: а б с д Гриффит Л.Г., Шварц М.А. (март 2006 г.). «Изучение сложной физиологии трехмерных тканей in vitro». Nature Reviews Молекулярно-клеточная биология . 7 (3): 211–24. дои : 10.1038/nrm1858 . ПМИД 16496023 . S2CID 34783641 .
- ^ Ли Дж., Каддихи М.Дж., Котов Н.А. (март 2008 г.). «Трехмерные матрицы клеточных культур: современное состояние» (PDF) . Тканевая инженерия. Часть Б, Обзоры . 14 (1): 61–86. дои : 10.1089/теб.2007.0150 . hdl : 2027.42/63369 . ПМИД 18454635 .
- ^ Хейкок Дж.В. (2011). «3D-клеточная культура: обзор современных подходов и методов». 3D-культура клеток . Методы молекулярной биологии. Том. 695. стр. 1–15. дои : 10.1007/978-1-60761-984-0_1 . ISBN 978-1-60761-983-3 . ПМИД 21042962 .
- ^ Сууронен Э.Дж., Ширдаун Х., Ньюман К.Д., Маклафлин С.Р., Гриффит М. (2005). «Построение моделей органов in vitro». Обзор клеточной биологии . Международный обзор цитологии. Том. 244. стр. 137–73. дои : 10.1016/s0074-7696(05)44004-8 . ISBN 9780123646484 . ПМИД 16157180 .
- ^ Лукари К. (октябрь 2004 г.). «Состояние и перспективы испытаний in vitro в оценке риска» . Альтернативы лабораторным животным . 32 (4): 431–5. дои : 10.1177/026119290403200416 . ПМИД 15651929 . S2CID 25708371 .
- ^ Найт Б., Лаукайтис С., Ахтар Н., Хотчин Н.А., Эдлунд М., Хорвиц А.Р. (май 2000 г.). «Визуализация миграции мышечных клеток in situ» . Современная биология . 10 (10): 576–85. Бибкод : 2000CBio...10..576K . дои : 10.1016/s0960-9822(00)00486-3 . ПМИД 10837222 . S2CID 5830501 .
- ^ Роскелли CD, Деспре П.Ю., Бисселл М.Дж. (декабрь 1994 г.). «Экспрессия тканеспецифических генов, зависимая от внеклеточного матрикса, в эпителиальных клетках молочной железы требует как физической, так и биохимической передачи сигнала» . Труды Национальной академии наук Соединенных Штатов Америки . 91 (26): 12378–82. Бибкод : 1994PNAS...9112378R . дои : 10.1073/pnas.91.26.12378 . ПМК 45441 . ПМИД 7528920 .
- ^ Перейти обратно: а б Вжесински К., Магноне М.К., Хансен Л.В., Крузе М.Е., Бергауэр Т., Бобадилья М., Гублер М., Мизрахи Дж., Чжан К., Андреасен К.М., Йоэнсен К.Е. (2013). «Сфероиды HepG2/C3A демонстрируют стабильную физиологическую функциональность в течение как минимум 24 дней после восстановления после трипсинизации» . Токсикол. Рез . 2 (3): 163–172. дои : 10.1039/C3TX20086H .
- ^ «После трипсинизации трехмерным сфероидам гепатоцитов C3A требуется 18 дней, чтобы восстановить уровни ключевых физиологических функций, аналогичные тем, которые наблюдаются в печени» (PDF) . Архивировано из оригинала (PDF) 2 апреля 2015 года . Проверено 25 ноября 2013 г.
- ^ Хан, Ю; Зегер, Л; Трипати, Р; Эгли, М; Иль, Ф; Локовандт, К; Флорин, Г; Атик, Э; Редван, Индиана; Фредрикссон, Р; Козлова Е.Н. (октябрь 2021). «Молекулярно-генетический анализ нервных стволовых клеток после космического полета и моделирования микрогравитации на Земле» . Биотехнология и биоинженерия . 118 (10): 3832–46. дои : 10.1002/бит.27858 . ПМИД 34125436 . S2CID 235425528 .
- ^ Шрикант Л., Сунита М.М., Кумар П.С., Чандрасекхар С., Венгамма Б., Сарма П.В. (ноябрь 2016 г.). «+ стволовые клетки». Отчеты по молекулярной биологии . 43 (11): 1233–42. дои : 10.1007/s11033-016-4053-4 . ПМИД 27497820 . S2CID 13230517 .
- ^ Педнекар, Кунал П.; Генрих, Марсель А.; ван Баарлен, Йоп; Пракаш, Джай (6 октября 2021 г.). «Новые 3D-ткани, имитирующие фиброзную строму при раке поджелудочной железы, для изучения клеточных взаимодействий и терапии, модулирующей строму» . Раки . 13 (19): 5006. doi : 10.3390/cancers13195006 . ПМК 8508009 . ПМИД 34638490 .
- ^ Ван Х, ван Блиттерсвейк, Калифорния (май 2010 г.). «Роль конфигурации трехмерного полимерного каркаса в равномерности формирования соединительной ткани жировыми стромальными клетками». Биоматериалы . 31 (15): 4322–9. doi : 10.1016/j.bimaterials.2010.02.008 . ПМИД 20199809 .
- ^ Мелчелс Ф.П., Баррадас А.М., ван Блиттерсвейк К.А., де Бур Дж., Фейен Дж., Грийпма Д.В. (ноябрь 2010 г.). «Влияние архитектуры каркасов тканевой инженерии на посев и культивирование клеток» (PDF) . Акта Биоматер . 6 (11): 4208–17. doi : 10.1016/j.actbio.2010.06.012 . ПМИД 20561602 .
- ^ Карлетти Э., Мотта А., Мильярези С. (2011). «Скаффолды для тканевой инженерии и 3D-культуры клеток». 3D-культура клеток . Методы Мол Биол. Том. 695. стр. 17–39. дои : 10.1007/978-1-60761-984-0_2 . ISBN 978-1-60761-983-3 . ПМИД 21042963 .
- ^ Садат-Шоджаи М (2018). «Контролируемый характер роста клеток в модулированных белковых нанокомплексах: регулирование распространения клеток в трех измерениях». Материалы сегодня . 21 (6): 686–8. дои : 10.1016/j.mattod.2018.06.003 . S2CID 139837561 .
- ^ Тиббит М.В., Ансет К.С. (июль 2009 г.). «Гидрогели как имитаторы внеклеточного матрикса для 3D-культуры клеток» . Биотехнология и биоинженерия . 103 (4): 655–63. дои : 10.1002/бит.22361 . ПМЦ 2997742 . ПМИД 19472329 .
- ^ Геккил Х., Сюй Ф., Чжан Х., Мун С., Демирчи У. (апрель 2010 г.). «Инженерные гидрогели как имитаторы внеклеточного матрикса» . Наномедицина . 5 (3). Лондон, Англия: 469–84. дои : 10.2217/nnm.10.12 . ПМК 2892416 . ПМИД 20394538 .
- ^ Биргерсдоттер А., Сандберг Р., Эрнберг И. (октябрь 2005 г.). «Нарушение экспрессии генов in vitro - растущий случай трехмерных (3D) культурных систем». Семин Рак Биол . 15 (5): 405–12. doi : 10.1016/j.semcancer.2005.06.009 . ПМИД 16055341 .
- ^ Барралет Дж. Э., Ван Л., Лоусон М., Триффит Дж. Т., Купер П. Р., Шелтон Р. М. (июнь 2005 г.). «Сравнение роста клеток костного мозга на 2D и 3D альгинатных гидрогелях». J Mater Sci Mater Med . 16 (6): 515–9. дои : 10.1007/s10856-005-0526-z . ПМИД 15928866 .
- ^ Перейти обратно: а б Тиббит М.В., Ансет К.С. (июль 2009 г.). «Гидрогели как имитаторы внеклеточного матрикса для 3D-культуры клеток» . Биотехнология Биоинж . 103 (4): 655–63. дои : 10.1002/бит.22361 . ПМЦ 2997742 . ПМИД 19472329 .
- ^ Перейти обратно: а б Сян X, Фунг Ю, Фэн М, Нагашима К, Чжан Дж, Броддус В.К. и др. (январь 2011 г.). «Разработка и характеристика 3D-модели мезотелиомы человека in vitro для исследования терапии иммунотоксинами» . ПЛОС ОДИН . 6 (1): e14640. Бибкод : 2011PLoSO...614640X . дои : 10.1371/journal.pone.0014640 . ПМК 3031536 . ПМИД 21305058 .
- ^ Перейти обратно: а б Феннема Э., Риврон Н., Рукема Дж., ван Блиттерсвейк С., де Бур Дж. (февраль 2013 г.). «Сфероидная культура как инструмент для создания сложных трехмерных тканей» (PDF) . Тенденции в биотехнологии . 31 (2): 108–15. дои : 10.1016/j.tibtech.2012.12.003 . ПМИД 23336996 .
- ^ Цзян Ю, Песивац-Грбович Дж, Кантрелл С, Фрейер Дж. П. (декабрь 2005 г.). «Многомасштабная модель аваскулярного роста опухоли» . Биофизический журнал . 89 (6): 3884–94. Бибкод : 2005BpJ....89.3884J . дои : 10.1529/biophysj.105.060640 . ПМК 1366955 . ПМИД 16199495 .
- ^ Гуттилла И.К., Феникс К.Н., Хонг X, Тирнауэр Дж.С., Клаффи К.П., Уайт BA (февраль 2012 г.). «Продолжительная маммосферная культура клеток MCF-7 индуцирует ЕМТ и репрессию рецептора эстрогена микроРНК». Исследование и лечение рака молочной железы . 132 (1): 75–85. дои : 10.1007/s10549-011-1534-y . ПМИД 21553120 . S2CID 6930899 .
- ^ Кунц-Шугарт Л.А., Хейдер П., Шредер Дж., Кнухель Р. (май 2001 г.). «Гетерологичная трехмерная модель совместной культуры клеток опухоли молочной железы и фибробластов для изучения опухолеассоциированной дифференцировки фибробластов». Экспериментальные исследования клеток . 266 (1): 74–86. дои : 10.1006/excr.2001.5210 . ПМИД 11339826 .
- ^ Привитанингрум, Дви Л.; Блонде, Жан-Батист Г.; Шридхар, Адитья; ван Баарлен, Йоп; Хеннинк, Вим Э.; Шторм, Герт; Ле Гак, Северин; Пракаш, Джай (декабрь 2016 г.). «Трёхмерные сфероидные массивы, содержащие строму опухоли: инструмент для изучения проникновения наночастиц» . Журнал контролируемого выпуска . 244 (Часть Б): 257–268. дои : 10.1016/j.jconrel.2016.09.004 . hdl : 1874/346099 . ПМИД 27616660 .
- ^ Фунг Ю.Т., Барбоне Д., Броддус В.К., Хо М. (2011). «Быстрое создание многоклеточных сфероидов in vitro для изучения терапии моноклональными антителами» . Журнал рака . 2 : 507–14. дои : 10.7150/jca.2.507 . ПМЦ 3204399 . ПМИД 22043235 .
- ^ Тун Ю.К., Сяо А.Ю., Аллен С.Г., Торисава Ю.С., Хо М., Такаяма С. (февраль 2011 г.). «Высокопроизводительная 3D-культура сфероидов и тестирование лекарств с использованием подвесной матрицы 384» . Аналитик . 136 (3): 473–8. Бибкод : 2011Ана...136..473Т . дои : 10.1039/c0an00609b . ПМК 7454010 . ПМИД 20967331 .
- ^ Сюй X, Фарах-Карсон MC , Цзя X (ноябрь 2014 г.). «Трехмерные модели опухолей in vitro для исследования рака и оценки лекарств» . Достижения биотехнологии . 32 (7): 1256–68. doi : 10.1016/j.biotechadv.2014.07.009 . ПМК 4171250 . ПМИД 25116894 .
- ^ Санти, Мелисса; Мапанао, Ана Катрина; Каппелло, Валентина; Волиани, Валерио (1 июля 2020 г.). «Создание 3D-моделей плоскоклеточного рака головы и шеи для оценки нанотераностики» . ACS Биоматериалы, наука и инженерия . 6 (9): 4862–9. doi : 10.1021/acsbimaterials.0c00617 . ПМЦ 7735655 . ПМИД 33395269 .
- ^ Тан, Ло Тенг Херн; Лоу, Лян И; Тан, Сиа Ин; Да, Вэй Сюм; Чуа, Лэй Хонг; Чан, Чим Кей; Ли, Изучи Хана; Го, Бей Хинг (2019). «Надежная и доступная трехмерная сфероидная модель опухоли для открытия натуральных лекарств: пример куркумина» . Прогресс в открытии лекарств и биомедицинской науке . 2 . дои : 10.36877/pddbs.a0000017 .
- ^ Пирсман, Арне; Блондель, Ева; Ахмед, Тасдик; Анкарт, Джаспер; Оденарт, Доминик; Ботерберг, Том; Бузас, Кристина; Каррагер, Нил; Кастеллани, Гастоне; Кастро, Флавия; Данглс-Мари, Вирджиния (1 ноября 2021 г.). «MISpheroID: база знаний и инструмент прозрачности для минимальной информации об идентификации сфероидов» . Природные методы . 18 (11): 1294–1303. дои : 10.1038/s41592-021-01291-4 . ПМЦ 8566242 . ПМИД 34725485 .
- ^ Челик; Доминичи; Филби; Дас; Мэдден; Паунов (11 июля 2019 г.). «Изготовление кластеров клеток кератиноцитов человека для применения кожных трансплантатов путем создания шаблонов эмульсий пикеринга «вода в воде»» . Биомиметика . 4 (3): 50. doi : 10.3390/biomimetics4030050 . ПМК 6784416 . ПМИД 31336810 .
- ^ Перейти обратно: а б Ван А., Мэдден Л.А., Паунов В.Н. (2020). «Высокопроизводительное производство кластероидов печеночных клеток с улучшенным ростом и функциональностью для применения в тканевой инженерии». Матер. Адв . 1 (8): 3022–32. дои : 10.1039/D0MA00635A .
- ^ Чиу Г.Г., Фу А., Пернг Лоу К., Цянь Луо К. (2015). «Физическая поддержка со стороны клеток рака печени необходима для дифференциации и ремоделирования эндотелиальных клеток в модели совместной культуры HepG2-HUVEC» . наук. Представитель . 5 (1): 10801. Бибкод : 2015NatSR...510801C . дои : 10.1038/srep10801 . ПМЦ 4459107 . ПМИД 26053957 .
- ^ Ласли С., Ким Х.Дж., Ли К., Суурмонд С.Э., Гуди М., Бандару П., Сунь В., Чжан С., Чжан Н., Ахадиан С., Докмечи М.Р., Ли Дж., Хадемхоссейни А (август 2019 г.). «Платформа «Печень человека на чипе» для моделирования неалкогольной жировой болезни печени» . Адв Биосист . 3 (8): e1900104. дои : 10.1002/adbi.201900104 . ПМЦ 7473489 . ПМИД 32648699 .
- ^ Ван А., Уэлдрик П.Дж., Мэдден Л.А., Паунов В.Н. (май 2021 г.). «Платформа для трехмерной кокультуры человека, инфицированной биопленкой клустероида, для замены животных моделей при тестировании антимикробных нанотехнологий» . Интерфейсы прикладных программ ACS . 13 (19): 22182–22194. дои : 10.1021/acsami.1c02679 . ПМИД 33956425 .
- ^ Ван А., Мэдден Л.А., Паунов В.Н. (март 2022 г.). «Васкуляризованные совместные культуры клюстероидов первичных эндотелиальных клеток и клеток Hep-G2 на основе водных двухфазных эмульсий Пикеринга» . Биоинженерия . 9 (3): 126. doi : 10.3390/bioengineering9030126 . ПМЦ 8945860 . ПМИД 35324815 .
- ^ Ду Ю, Хан Р., Вэнь Ф., Нг Сан Сан С., Ся Л., Воланд Т. и др. (январь 2008 г.). «Синтетическая сэндвич-культура трехмерного монослоя гепатоцитов». Биоматериалы . 29 (3): 290–301. doi : 10.1016/j.bimaterials.2007.09.016 . ПМИД 17964646 .
- ^ Перейти обратно: а б Дерда Р., Ларомейн А., Маммото А., Тан С.К., Маммото Т., Ингбер Д.Е., генеральный менеджер Уайтсайдс (ноябрь 2009 г.). «Трехмерная культура клеток на бумажной подложке для биоанализа тканей» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (44): 18457–62. Бибкод : 2009PNAS..10618457D . дои : 10.1073/pnas.0910666106 . ПМЦ 2773961 . ПМИД 19846768 .
- ^ Фей, Стивен Дж. «WO2012022351». Европейский патентный реестр.
- ^ Фрид Л.Е., Вуньяк-Новакович Г. (2002). «Космические биореакторные исследования клеток и тканей». Adv Space Biol Med . Достижения космической биологии и медицины. 8 : 177–95. дои : 10.1016/s1569-2574(02)08019-x . ISBN 978-0-444-50735-8 . ПМИД 12951697 .
- ^ Вендт Д., Рибольди С.А., Чоффи М., Мартин И. (2009). «Биореакторы в тканевой инженерии: научные проблемы и клинические перспективы». Биореакторные системы для тканевой инженерии . Достижения в области биохимической инженерии/биотехнологии. Том. 112. стр. 1–27. Бибкод : 2009bste.book....1W . дои : 10.1007/978-3-540-69357-4_1 . ISBN 978-3-540-69356-7 . ПМИД 19290495 .
- ^ Шмид Дж., Шварц С., Мейер-Штауде Р., Судхоп С., Клаузен-Шауманн Х., Шикер М., Хубер Р. (октябрь 2018 г.). «Система перфузионного биореактора для посева клеток и контролируемого кислородом культивирования трехмерных клеточных культур» . Tissue Eng . Методы части C. 24 (10): 585–595. дои : 10.1089/ten.TEC.2018.0204 . ПМК 6208160 . ПМИД 30234443 .
- ^ Вендт Д., Рибольди С.А., Чоффи М., Мартин И. (сентябрь 2009 г.). «Потенциал и узкие места биореакторов в 3D-культуре клеток и производстве тканей». Адв Матер . 21 (32–33): 3352–67. Бибкод : 2009AdM....21.3352W . дои : 10.1002/adma.200802748 . ПМИД 20882502 .
- ^ Ли XJ, Валадес А.В., Цзо П., Не З. (июнь 2012 г.). «Микрофлюидная 3D-культура клеток: потенциальное применение для биоанализа тканей» . Биоанализ . 4 (12): 1509–25. дои : 10.4155/био.12.133 . ПМЦ 3909686 . ПМИД 22793034 .
- ^ Судо Р., Чунг С., Зервантонакис И.К., Викерман В., Тошимицу Ю., Гриффит Л.Г., Камм Р.Д. (июль 2009 г.). «Транспорт-опосредованный ангиогенез в 3D-эпителиальной совместной культуре» . Журнал ФАСЭБ . 23 (7): 2155–64. дои : 10.1096/fj.08-122820 . ПМЦ 2718841 . ПМИД 19246488 .
- ^ Родоплу, Дидем; Матахум, Джефанни Сьерра; Сюй, Цзя-Сянь (29 марта 2022 г.). «Микрофлюидная подвесная платформа для совместного культивирования сфероидов на основе капель для исследования опухолевого ангиогенеза» . Лаборатория на чипе . 22 (7): 1275–85. дои : 10.1039/D1LC01177D . ПМИД 35191460 . S2CID 247024765 .
- ^ Маримуту М., Ким С. (июнь 2011 г.). «Микрофлюидные методы совместного культивирования клеток для понимания клеточной биологии, анализа био/фармацевтических препаратов и разработки тканевых конструкций». Анальная биохимия . 413 (2): 81–9. дои : 10.1016/j.ab.2011.02.027 . ПМИД 21354094 .
- ^ Эллиотт Н.Т., Юань Ф. (январь 2011 г.). «Обзор трехмерных моделей тканей in vitro для исследования лекарств и транспорта». J Pharm Sci . 100 (1): 59–74. дои : 10.1002/jps.22257 . ПМИД 20533556 .
- ^ Чен С.Ю., Хунг П.Дж., Ли П.Дж. (август 2011 г.). «Микрофлюидный массив для трехмерной перфузионной культуры эпителиальных клеток молочной железы человека». Биомедицинские микроустройства . 13 (4): 753–8. дои : 10.1007/s10544-011-9545-3 . ПМИД 21556741 .
- ^ Мьюзик К., Хатами Д., Уиллер BC (июль 2009 г.). «Трехмерная микроэлектродная решетка для регистрации диссоциированных нейрональных культур» . Лабораторный чип . 9 (14): 2036–42. дои : 10.1039/b820596e . ПМЦ 2818679 . ПМИД 19568672 .
- ^ Малик М., Ян Й., Фатхи П., Малер Г.Дж., Эш М.Б. (2021). «Критические соображения по проектированию мультиорганных микрофизиологических систем (МПС)» . Front Cell Dev Biol . 9 : 721338. doi : 10.3389/fcell.2021.721338 . ПМЦ 8459628 . ПМИД 34568333 .
- ^ Байяржон, П; Шумате, Дж; Хоу, С; Фернандес-Вега, В; Маркес, Н; Соуза, Г; и др. (2019). «Автоматизация технологии создания магнитных трехмерных сфероидных моделей для высокопроизводительного скрининга» . Технология СЛАС . 24 (4): 420–8. дои : 10.1177/2472630319854337 . ПМК 7704036 . ПМИД 31225974 .
- ^ Хоу, С; Тириак, Х; Шридхаран, БП; Скампавия, Л; Маду, Ф; Селдин, Дж; и др. (2018). «Перспективная разработка моделей первичных органоидных опухолей поджелудочной железы для высокопроизводительного фенотипического скрининга лекарств» . SLAS Дисков . 23 (6): 574–584. дои : 10.1177/2472555218766842 . ПМК 6013403 . ПМИД 29673279 .
- ^ Маду, Ф; Таннер, А; Сосуды, М; Уиллетс, Л; Хоу, С; Скампавия, Л; и др. (2017). «3D-анализ жизнеспособности с 1536 лунками для оценки цитотоксического действия лекарств на сфероиды» . SLAS Дисков . 22 (5): 516–524. дои : 10.1177/2472555216686308 . ПМИД 28346088 .
- ^ Кереда, В.; Хоу, С; Маду, Ф; Скампавия, Л; Спайсер, ТП; Дакетт, Д. (2018). «Высокопроизводительный цитотоксический трехмерный сфероидный анализ с использованием стволовых клеток глиомы, полученных от пациента» . SLAS Дисков . 23 (8): 842–9. дои : 10.1177/2472555218775055 . ПМК 6102052 . ПМИД 29750582 .
- ^ Кота, С; Хоу, С; Геррант, В; Маду, Ф; Траутман, С; Фернандес-Вега, В; и др. (2018). «Новый трехмерный высокопроизводительный подход к скринингу идентифицирует индукторы мутантного летального фенотипа KRAS» . Онкоген . 37 (32): 4372–84. дои : 10.1038/s41388-018-0257-5 . ПМК 6138545 . ПМИД 29743592 .
- ^ Кассано Д., Санти М., Д'Аутилиа Ф., Мапанао А.К., Луин С., Волиани В. (2019). «Фототермический эффект с помощью выделяемых сверхмалых в наноархитектурах, реагирующих на БИК-диапазон» . Горизонты материалов . 6 (3): 531–7. дои : 10.1039/C9MH00096H . hdl : 11384/77439 .
- ^ Мапанао А.К., Санти М., Фарачи П., Каппелло В., Кассано Д., Волиани В. (сентябрь 2018 г.). «Эндогенно запускаемые сверхмалые в наноархитектуре: оценка нацеливания на трехмерные сфероиды карциномы поджелудочной железы» . АСУ Омега . 3 (9): 11796–801. дои : 10.1021/acsomega.8b01719 . ПМК 6173554 . ПМИД 30320273 .
- ^ Зустиак, Сильвия Петрова; Дадхвал, Смрити; Медина, Карлос; Стечина, Сонетта; Чехреганианзаби, Ясаман; Ашраф, Аниса; Асури, Прашант (февраль 2016 г.). «Жесткость трехмерной матрицы и адгезивные лиганды влияют на реакцию раковых клеток на токсины» . Биотехнология и биоинженерия . 113 (2): 443–452. дои : 10.1002/бит.25709 . ПМИД 26184715 . S2CID 38031281 .
- ^ Отиено, Моника А.; Ган, Цзиньпин; Проктор, Уильям (2018), Чен, Минджун; Уилл, Ивонн (ред.), «Статус и будущее 3D-культуры клеток в тестировании на токсичность», Лекарственная токсичность для печени , Методы фармакологии и токсикологии, Нью-Йорк, Нью-Йорк: Springer, стр. 249–261, doi : 10.1007/ 978-1-4939-7677-5_12 , ISBN 978-1-4939-7677-5
- ^ Фей С.Дж., Вжесински К. (июнь 2012 г.). «Определение токсичности лекарств с использованием трехмерных сфероидов, созданных из бессмертной клеточной линии гепатоцитов человека» . Токсикологические науки . 127 (2): 403–11. дои : 10.1093/toxsci/kfs122 . ПМЦ 3355318 . ПМИД 22454432 .
- ^ Месснер С., Агаркова И., Мориц В., Кельм Дж.М. (январь 2013 г.). «Многоклеточные микроткани печени человека для тестирования гепатотоксичности» . Архив токсикологии . 87 (1): 209–13. дои : 10.1007/s00204-012-0968-2 . ПМЦ 3535351 . ПМИД 23143619 .
- ^ Дженсен Дж., Хиллнер Дж., Бьорквист П. (июнь 2009 г.). «Технологии эмбриональных стволовых клеток человека и открытие лекарств». Журнал клеточной физиологии . 219 (3): 513–9. дои : 10.1002/jcp.21732 . ПМИД 19277978 . S2CID 36354049 .
- ^ Александр Ф., Эггерт С., Вист Дж. (февраль 2018 г.). «Новая лабораторная платформа для мониторинга метаболизма сфероидов» . Цитотехнология . 70 (1): 375–386. дои : 10.1007/s10616-017-0152-x . ПМК 5809666 . ПМИД 29032507 .
- ^ Амахер Д.Е. (май 2010 г.). «Открытие и разработка биомаркеров протеомной безопасности для выявления лекарственной токсичности печени». Токсикол Appl Pharmacol . 245 (1): 134–42. Бибкод : 2010ToxAP.245..134A . дои : 10.1016/j.taap.2010.02.011 . ПМИД 20219512 .
- ^ Чжан М., Чен М., Тонг В. (январь 2012 г.). «Является ли токсигеномика более надежным и чувствительным биомаркером, чем традиционные индикаторы на крысах, для прогнозирования лекарственного повреждения печени у людей?». Химический токсикол . 25 (1): 122–9. дои : 10.1021/tx200320e . ПМИД 22122743 .
- ^ Стивенс Дж.Л. (ноябрь 2006 г.). «Будущее токсикологии - механизмы токсичности и безопасности лекарств: куда нам двигаться дальше?». Химический токсикол . 19 (11): 1393–1401. дои : 10.1021/tx060213n . ПМИД 17112225 .
- ^ Ли М.Ю., Дордик Дж.С. (декабрь 2006 г.). «Высокопроизводительный анализ метаболизма и токсичности человека». Curr Opin Biotechnol . 17 (6): 619–27. дои : 10.1016/j.copbio.2006.09.003 . ПМИД 17046235 .
- ^ Хоук К.А., Кавлок Р.Дж. (март 2008 г.). «Понимание механизмов токсичности: выводы исследований по открытию лекарств». Токсикол Appl Pharmacol . 227 (2): 163–78. Бибкод : 2008ToxAP.227..163H . дои : 10.1016/j.taap.2007.10.022 . ПМИД 18063003 .
- ^ Прествич Г.Д. (январь 2008 г.). «Оценка эффективности и токсикологии лекарств в трех измерениях: использование синтетических внеклеточных матриц при открытии лекарств». Acc Chem Res . 41 (1): 139–48. дои : 10.1021/ar7000827 . ПМИД 17655274 .
- ^ Асташкина А, Манн Б, Грейнджер Д.В. (апрель 2012 г.). «Критическая оценка моделей клеточных культур in vitro для высокопроизводительного скрининга и токсичности лекарств». Фармакол Тер . 134 (1): 82–106. doi : 10.1016/j.pharmthera.2012.01.001 . ПМИД 22252140 .
- ^ Ван Х, Браун ПК, Чоу Э.К., Юарт Л., Фергюсон С.С., Фицпатрик С., Фридман Б.С., Го Г.Л., Хедрих В., Хейворд С., Хикман Дж., Исохерранен Н., Ли А.П., Лю Кью, Мументалер С.М., Полли Дж., Проктор В.Р. , Рибейро А., Ван Цзюй, Ванге Р.Л., Хуан С.М. (сентябрь 2021 г.). «3D-модели клеточных культур: фармакокинетика лекарств, оценка безопасности и нормативные требования» . Clin Transl Sci . 14 (5): 1659–80. дои : 10.1111/cts.13066 . ПМЦ 8504835 . ПМИД 33982436 .
- ^ Чипангура Дж.К., Нтамо Ю., Мор Б., Челлан Н. (2023). «Обзор проблем и перспектив трехмерных моделей клеточных культур, используемых для изучения лекарственного повреждения печени на ранних этапах разработки лекарств» . Hum Exp Токсикол . 42 : 9603271221147884. Бибкод : 2023HETox..4211478C . дои : 10.1177/09603271221147884 . ПМИД 36879529 .
- ^ Цзян Дж., Уолтерс Дж.Э., ван Бреда С.Г., Кляйнянс Дж.К., де Кок Т.М. (2015). «Разработка новых инструментов для исследования in vitro лекарственного повреждения печени». Экспертное мнение о препарате Метаб Токсикол . 11 (10): 1523–37. дои : 10.1517/17425255.2015.1065814 . ПМИД 26155718 .
- ^ Фанк С., Рот А. (январь 2017 г.). «Текущие ограничения и будущие возможности прогнозирования ЛПП in vitro». Арка Токсикол . 91 (1): 131–142. дои : 10.1007/s00204-016-1874-9 . PMID 27766365 .
- ^ Тутти М.А., Мовиа Д., Прина-Мелло А. (сентябрь 2022 г.). «Трехмерные (3D) модели клеток печени — инструмент для преодоления разрыва между исследованиями на животных и клиническими испытаниями при скрининге накопления в печени и токсичности нанобиоматериалов» . Drug Deliv Transl Res . 12 (9): 2048–74. дои : 10.1007/s13346-022-01147-0 . ПМК 9066991 . ПМИД 35507131 .
- ^ Нгуен Д.Г., Фанк Дж., Роббинс Дж.Б., Кроган-Грунди С., Преснелл С.С., Сингер Т., Рот А.Б. (2016). «Биопечатные 3D-первичные ткани печени позволяют оценить реакцию органов на токсичность, вызванную клиническими лекарственными средствами, in vitro» . ПЛОС ОДИН . 11 (7): e0158674. Бибкод : 2016PLoSO..1158674N . дои : 10.1371/journal.pone.0158674 . ПМЦ 4936711 . ПМИД 27387377 .
- ^ Фанг Ю, Эглен Р.М. (июнь 2017 г.). «Трехмерные клеточные культуры в открытии и разработке лекарств» . SLAS Дисков . 22 (5): 456–472. дои : 10.1177/1087057117696795 . ПМЦ 5448717 . ПМИД 28520521 .
- ^ Ипек С., Устюндаг А., Джан Эке Б. (май 2023 г.). «Трехмерные (3D) исследования клеточных культур: обзор области токсикологии». Наркотик Химический Токсикол . 46 (3): 523–533. дои : 10.1080/01480545.2022.2066114 . ПМИД 35450503 .
- ^ Дженсен С., Тенг Ю (2020). «Не пора ли начать переход от 2D к 3D культуре клеток?» . Границы молекулярной биологии . 7:33 . doi : 10.3389/fmolb.2020.00033 . ПМК 7067892 . ПМИД 32211418 .
- ^ Сот К.С., Бьюкенен К.Ф., Фриман Дж.В., Райландер М.Н. (ноябрь 2011 г.). «3D биоинженерные опухоли in vitro на основе гидрогелей коллагена I» . Биоматериалы . 32 (31): 7905–12. doi : 10.1016/j.bimaterials.2011.07.001 . ПМК 3229258 . ПМИД 21782234 .
- ^ Ким Дж. Б. (октябрь 2005 г.). «Трехмерные модели культуры тканей в биологии рака». Семин Рак Биол . 15 (5): 365–77. doi : 10.1016/j.semcancer.2005.05.002 . ПМИД 15975824 .
- ^ Хорнинг Дж.Л., Саху С.К., Виджаярагхавалу С., Димитриевич С., Васир Дж.К., Джайн Т.К., Панда А.К., Лабхасетвар В. (2008). «3-D модель опухоли для оценки противораковых препаратов in vitro». Мол Фарм . 5 (5): 849–62. дои : 10.1021/mp800047v . ПМИД 18680382 .
- ^ Понтес Соарес К., Мидлей В., де Оливейра М.Э., Бенчимол М., Коста М.Л., Мермельштейн К. (2012). «2D- и 3D-организованные сердечные клетки демонстрируют различия в клеточной морфологии, адгезионных соединениях, наличии миофибрилл и экспрессии белков» . ПЛОС ОДИН . 7 (5): e38147. Бибкод : 2012PLoSO...738147S . дои : 10.1371/journal.pone.0038147 . ПМК 3360656 . ПМИД 22662278 .
- ^ Лей Ю., Шаффер Д.В. (декабрь 2013 г.). «Полностью определенная и масштабируемая система 3D-культуры для размножения и дифференцировки плюрипотентных стволовых клеток человека» . Proc Natl Acad Sci США . 110 (52): E5039–48. Бибкод : 2013PNAS..110E5039L . дои : 10.1073/pnas.1309408110 . ПМЦ 3876251 . ПМИД 24248365 .
- ^ Чопра В., Динь ТВ, Ханниган Э.В. (июнь 1997 г.). «Трехмерное взаимодействие эндотелиальных и опухолевых эпителиальных клеток при раке шейки матки человека». In Vitro Cell Dev Biol Anim . 33 (6): 432–42. дои : 10.1007/s11626-997-0061-y . ПМИД 9201511 .
- ^ Перейти обратно: а б Хабанджар О, Диаб-Ассаф М, Калдефи-Чезет Ф, Делорт Л (ноябрь 2021 г.). «3D-системы культивирования клеток: применение в опухолях, преимущества и недостатки» . Международный журнал молекулярных наук . 22 (22): 12200. дои : 10.3390/ijms222212200 . ПМЦ 8618305 . ПМИД 34830082 .