Технология сайт-специфической рекомбиназы
Эта статья может быть слишком технической для понимания большинства читателей . ( Май 2019 г. ) |
Технологии сайт-специфической рекомбиназы представляют собой инструменты геномной инженерии , которые зависят от ферментов рекомбиназы для замены целевых участков ДНК.
История
[ редактировать ]В конце 1980-х годов нацеливание на гены в мышиных эмбриональных стволовых клетках (ЭСК) позволило передавать мутации в зародышевую линию мыши и стало новым вариантом изучения генетической основы регуляторных сетей в том виде, в котором они существуют в геноме. Тем не менее, классическое нацеливание на гены оказалось ограниченным по нескольким причинам, поскольку функции генов были необратимо разрушены маркерным геном, который необходимо было ввести для отбора рекомбинантных ЭСК. Эти ранние шаги привели к появлению животных, у которых мутация с самого начала присутствовала во всех клетках организма, что приводило к сложным фенотипам и/или ранней летальности. Существовала очевидная потребность в методах ограничения этих мутаций определенными точками развития и конкретными типами клеток. Эта мечта стала реальностью, когда группам в США удалось внедрить бактериофаги и дрожжевые системы сайт-специфической рекомбинации (SSR-) в клетки млекопитающих, а также в клетки мышей. [ 1 ] [ 2 ] [ 3 ]
Классификация, свойства и специальные применения
[ редактировать ]Общие стратегии генной инженерии требуют постоянной модификации целевого генома. С этой целью необходимо вложить большие усилия в разработку путей доставки трансгенов. Хотя для биотехнологических целей случайная интеграция все еще распространена, она может привести к непредсказуемой экспрессии генов из-за вариативного количества копий трансгена, отсутствия контроля над сайтами интеграции и связанных с ними мутаций. Молекулярные требования в области стволовых клеток гораздо более строгие. Здесь гомологичная рекомбинация (ГР) в принципе может обеспечить специфичность процесса интеграции, но для эукариот она компрометируется крайне низкой эффективностью. Хотя мегануклеазы, эффекторные нуклеазы, подобные цинковым пальцам и активаторам транскрипции (ZFN и TALEN), являются реальными инструментами, поддерживающими HR, именно доступность сайт-специфических рекомбиназ (SSR) послужила толчком к рациональному конструированию клеточных линий с предсказуемыми свойствами. В настоящее время обе технологии, HR и SSR, могут быть объединены в высокоэффективные «технологии тегирования и обмена». [ 4 ]
Было идентифицировано множество систем сайт-специфической рекомбинации, способных выполнять эти перестройки ДНК для различных целей, но почти все они принадлежат к одному из двух семейств: тирозинрекомбиназы (YR) и серинрекомбиназы (SR), в зависимости от их механизма . Эти два семейства могут опосредовать до трех типов перестроек ДНК (интеграция, вырезание/разрешение и инверсия) по разным путям реакции в зависимости от их происхождения и архитектуры. [ 5 ]
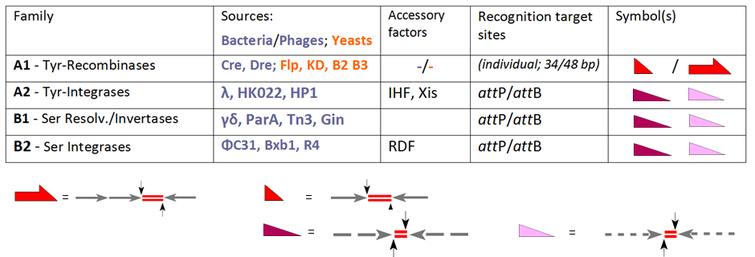
Членом-основателем семейства YR является лямбда-интеграза , кодируемая бактериофагом λ , обеспечивающая интеграцию ДНК фага в бактериальный геном. Общей особенностью этого класса является консервативный тирозиновый нуклеофил, атакующий разрезаемый ДНК-фосфат с образованием 3'-фосфотирозиновой связи. Ранними членами семейства SR являются близкородственные резольваза / ДНК-инвертазы бактериальных транспозонов Tn3 и γδ, которые полагаются на каталитический серин, ответственный за атаку разрезаемого фосфата с образованием 5'-фосфосериновой связи. Однако эти неоспоримые факты были скомпрометированы значительной путаницей в то время, когда на сцену вышли другие представители, например, рекомбиназы YR Cre и Flp (способные к интеграции, вырезанию/разрешению, а также инверсии), которые, тем не менее, приветствовались как новые члены «семьи интеграз». Обратными примерами являются PhiC31 и родственные ему SR, которые первоначально были представлены как резольваза/инвертазы, хотя в отсутствие вспомогательных факторов их единственной функцией является интеграция. В настоящее время стандартная активность каждого фермента определяет его классификацию, сохраняя общий термин «рекомбиназа» для членов семейства, которые, по сути, включают все три пути: INT, RES и INV:
Наша таблица расширяет выбор традиционных систем SSR и группирует их в соответствии с их характеристиками. Все эти ферменты рекомбинируют два сайта-мишени, которые либо идентичны (подсемейство A1), либо различаются (ферменты фагового происхождения в A2, B1 и B2). [ 6 ] Если для А1 эти сайты имеют индивидуальные обозначения (« FRT » в случае Flp-рекомбиназы, loxP для Cre-рекомбиназы), то термины « att P» и « att B» (сайты присоединения на фаговой и бактериальной части соответственно) обозначаются действительны в остальных случаях. В случае подсемейства А1 мы имеем дело с короткими (обычно 34 п.н.) сайтами, состоящими из двух (почти) идентичных плеч по 13 п.н. (стрелки), фланкирующих спейсер длиной 8 п.н. (область кроссовера, обозначенная дублетами красной линии). [ 7 ] Обратите внимание, что для Flp существует альтернативный сайт длиной 48 п.н. с тремя плечами, каждое из которых содержит единицу Flp (так называемый «протомер»). Сайты att P и att B следуют схожим архитектурным правилам, но здесь ветви демонстрируют лишь частичную идентичность (обозначенную пунктирными линиями) и различаются в обоих случаях. Эти особенности объясняют соответствующие различия:
- рекомбинация двух идентичных центров эдукта приводит к сайтам-продуктам того же состава, хотя они содержат плечи от обоих субстратов; эти преобразования обратимы;
- в случае att P x att B рекомбинационные кроссоверы могут происходить только между этими комплементарными партнерами в процессах, которые необратимо приводят к двум различным продуктам ( att P x att B → att R + att L).
Чтобы упростить эту главу, следующие реализации будут сосредоточены на двух рекомбиназах (Flp и Cre) и только на одной интегразе (PhiC31), поскольку их спектр охватывает инструменты, которые в настоящее время в основном используются для направленной модификации генома. Это будет сделано в рамках следующего обзора.

Маршруты реакции
[ редактировать ]Интеграция/разрешение и инверсия режима (INT/RES и INV) зависят от ориентации сайтов-мишеней рекомбиназы (RTS) среди этих пар att P и att B. В разделе C упрощенно показан способ, опосредованный рекомбиназой. кассетный обмен (RMCE) может быть достигнут путем синхронного двустороннего кроссовера (а не интеграции с последующим разрешением). [ 8 ] [ 9 ]
Tyr-рекомбиназы являются обратимыми, тогда как Ser-интеграза является однонаправленной. Следует отметить, что обратимая интеграция/разрешение Flp (рекомбиназы Tyr) модулируется FRT версиями длиной 48 п.н. синаптический комплекс, как в контексте функций Flp-INT, так и Flp-RMCE (см. соответствующие ситуации равновесия). Хотя почти невозможно предотвратить (обусловленную энтропией) обратную интеграцию в секции A для Cre и трудно достичь для Flp, RMCE может быть завершена, если донорская плазмида предоставляется в избытке из-за бимолекулярного характера как прямой - и обратная реакция. Расположение обоих сайтов FRT в обратном порядке приведет к равновесию обеих ориентаций вставки (зеленая стрелка). В отличие от Flp, Ser-интеграза PhiC31 (изображения внизу) приводит к однонаправленной интеграции, по крайней мере, в отсутствие фактора направленности рекомбиназы (RDF-). [ 10 ] По сравнению с Flp-RMCE, который требует двух разных («гетероспецифичных») мутантов FRT -спейсера, партнер по реакции ( att B ) первого реагирующего сайта att P поражается произвольно, так что нет контроля над направлением донорской кассеты. попадает в цель (см. альтернативные продукты). Также в отличие от Flp-RMCE , несколько отдельных мишеней RMCE не могут быть установлены параллельно из-за отсутствия гетероспецифичных (неперекрестно взаимодействующих) комбинаций att P/ att B.
Cre рекомбиназа
[ редактировать ]Рекомбиназа Cre (Cre) способна рекомбинировать определенные последовательности ДНК без необходимости использования кофакторов . Фермент распознает последовательности ДНК из 34 пар оснований, называемые loxP («локус кроссинговера в фаге P1»). В зависимости от ориентации сайтов-мишеней относительно друг друга Cre интегрирует/вырезает или инвертирует последовательности ДНК. После вырезания (так называемого «разрешения» в случае кольцевого субстрата) определенного участка ДНК нормальная экспрессия генов значительно нарушается или прекращается. [ 11 ]
Из-за выраженной разрешающей способности Cre одним из его первоначальных применений было удаление lox P-фланкированных («floxed») генов, что приводило к нокауту клеточно-специфического гена такого флоксированного гена после того, как Cre стал экспрессироваться в интересующей ткани. Современные технологии включают методы, которые позволяют осуществлять как пространственный, так и временной контроль активности Cre. Общий метод, облегчающий пространственный контроль генетических изменений, включает выбор тканеспецифичного промотора для управления экспрессией Cre. Помещение Cre под контроль такого промотора приводит к локализованной, тканеспецифичной экспрессии. Например, Леоне и др. поместили транскрипционную единицу под контроль регуляторных последовательностей гена протеолипидного белка миелина (PLP), что привело к индуцированному удалению целевых последовательностей гена в олигодендроцитах и шванновских клетках . [ 12 ] Специфический фрагмент ДНК, распознаваемый Cre, остается интактным в клетках, не экспрессирующих ген PLP; это, в свою очередь, облегчает эмпирическое наблюдение локализованных эффектов изменений генома в миелиновой оболочке, окружающей нервные волокна в центральной нервной системе (ЦНС) и периферической нервной системе (ПНС). [ 13 ] Избирательная экспрессия Cre была достигнута и во многих других типах клеток и тканях.
Чтобы контролировать временную активность реакции вырезания, . были разработаны формы Cre, которые используют преимущества различных лигандсвязывающих доменов Одна успешная стратегия индукции специфической временной активности Cre включает слияние фермента с мутированным лиганд-связывающим доменом человеческого рецептора эстрогена (ERt). При введении тамоксифена эстрогена ( антагониста рецепторов ) конструкция Cre-ERt способна проникать в ядро и вызывать целевую мутацию. ERt связывает тамоксифен с большим сродством, чем эндогенные эстрогены , что позволяет Cre-ERt оставаться цитоплазматическим у животных, не получавших тамоксифен. Временной контроль активности SSR с помощью тамоксифена позволяет индуцировать генетические изменения позже в эмбриогенезе и/или во взрослых тканях. [ 12 ] Это позволяет исследователям обойти эмбриональную смертность, продолжая при этом исследовать функцию целевых генов.
Недавнее расширение этих общих концепций привело к созданию «Cre-зоопарка», то есть коллекций сотен линий мышей, для которых определенные гены могут быть удалены путем целевой экспрессии Cre. [ 3 ]

Flp-рекомбиназа
[ редактировать ]У естественного хозяина (S. cerevisiae) система Flp/ FRT обеспечивает репликацию «плазмиды 2μ» путем инверсии сегмента, фланкированного двумя идентичными, но противоположно ориентированными сайтами FRT («флиппазная» активность). Эта инверсия меняет относительную ориентацию репликационных вилок внутри плазмиды, обеспечивая «катящийся круг» - амплификацию кругового объекта размером 2 мкм до того, как мультимерные промежуточные соединения разрешатся с высвобождением нескольких мономерных продуктов. размером 34 п.н. В то время как минимальные сайты FRT благоприятствуют вырезанию/разрешению в той же степени, что и аналоговые сайты lox P для Cre, естественные, более расширенные варианты FRT размером 48 п.н. обеспечивают более высокую степень интеграции, преодолевая при этом определенные беспорядочные взаимодействия, как описано для фаговых ферментов, таких как Кре- [ 5 ] и PhiC31. [ 6 ] Дополнительным преимуществом является тот факт, что простые правила могут быть применены для создания гетероспецифичных сайтов FRT , которые подвергаются кроссоверу с равными партнерами, но не с FRT дикого типа . Эти факты позволили с 1994 года разрабатывать и постоянно совершенствовать стратегии рекомбиназно-опосредованного обмена кассет (RMCE-), позволяющие осуществлять чистый обмен целевой кассеты на поступающую донорскую кассету. [ 6 ]
На основе технологии RMCE в рамках программы EUCOMM (Европейский условный мутагенез мышей) на основе уже существующих Cre- и/или Flp- на основе установок «FlExing» (Flp-опосредованное иссечение/инверсия), [ 6 ] включая операции вырезания и инверсии. Этот проект, начатый в 2005 году, был сосредоточен сначала на насыщающем мутагенезе, чтобы обеспечить полную функциональную аннотацию генома мыши (координируемый Международным консорциумом нокаут-мышей, IKMC) с конечной целью мутировать все белковые гены посредством захвата и нацеливания генов у мышей. ЭС клетки. [ 14 ] Эти усилия знаменуют собой вершину различных стратегий «метки и обмена», которые направлены на маркировку отдельного геномного сайта так, чтобы «тег» мог служить адресом для введения новой (или изменения существующей) генетической информации. Шаг маркировки сам по себе может адресовать определенные классы сайтов интеграции, используя предпочтения интеграции ретровирусов или даже интеграз, специфичных для сайта, таких как PhiC31, которые действуют по существу однонаправленным образом.
Традиционные, трудоемкие процедуры «метки и обмена» основывались на двух последовательных стадиях гомологичной рекомбинации (HR-), первая из которых («HR1») заключалась в введении метки, состоящей из гена-маркера селекции. Затем «HR2» использовался для замены маркера на «GOI». В первой реакции («нокаут»-) ген помечался селектируемым маркером, обычно путем вставки кассеты hygtk ([+/-]). обеспечение устойчивости к G418. На следующем этапе «нок-ин» меченую геномную последовательность заменяли гомологичными геномными последовательностями с определенными мутациями, а затем можно было выделить клоны клеток по их устойчивости к ганцикловиру из-за потери гена HSV-tk, т.е. («отрицательный отбор»). Это традиционная двухэтапная процедура тегирования и обмена. [ 15 ] может быть упрощена после появления RMCE, который мог бы взять на себя управление и повысить эффективность этапа внедрения.
Интеграза PhiC31
[ редактировать ]Без особого сомнения, Ser- интегразы в настоящее время являются предпочтительными инструментами для интеграции трансгенов в ограниченное число хорошо изученных геномных акцепторных сайтов, которые в основном (но не всегда) имитируют сайт att P фага в том, что они привлекают донорный вектор, содержащий att B. . В настоящее время наиболее известным представителем является PhiC31-INT с доказанным потенциалом в контексте геномов человека и мыши.
В отличие от вышеупомянутых рекомбиназ Tyr, PhiC31-INT как таковой действует однонаправленным образом, надежно фиксируя донорный вектор на геномно закрепленной мишени. Очевидным преимуществом этой системы является то, что она может полагаться на немодифицированные нативные донорные сайты att P (акцептор) и att B. Дополнительные преимущества (вместе с некоторыми осложнениями) могут возникнуть из-за того, что геномы мыши и человека сами по себе содержат ограниченное количество эндогенных мишеней (так называемые « att P-псевдосайты»). Имеющаяся информация позволяет предположить, что значительные требования к последовательности ДНК позволяют интегразе распознавать меньше сайтов, чем системы интеграции на основе ретровирусов или даже транспозаз, открывая ее карьеру в качестве превосходного носителя для транспорта и вставки в ряд хорошо известных геномных сайтов, некоторые из которых с такой так называемые объекты «безопасной гавани». [ 10 ]
Используя факт специфических ( att P x att B) путей рекомбинации, RMCE становится возможным без необходимости использования синтетических гетероспецифичных att -сайтов. Однако это очевидное преимущество достигается за счет некоторых недостатков, таких как отсутствие контроля над видом или направлением входящей (донорской) кассеты. [ 6 ] Дальнейшие ограничения накладываются тем фактом, что необратимость не позволяет использовать стандартные установки мультиплексирования-RMCE, включая реакции «серийных RMCE», т.е. повторные замены кассет в данном геномном локусе .
Мировоззрение и перспективы
[ редактировать ]Аннотация геномов человека и мыши привела к идентификации >20 000 генов, кодирующих белки, и >3 000 некодирующих генов РНК, которые направляют развитие организма от оплодотворения через эмбриогенез до взрослой жизни. Несмотря на значительный прогресс, актуальность редких вариантов генов остается центральной темой исследований.
В качестве одной из наиболее важных платформ для крупномасштабного изучения функций генов позвоночных были созданы полногеномные генетические ресурсы мутантных мышиных ES клеток. С этой целью в Европе и Северной Америке созданы четыре международные программы, направленные на насыщающий мутагенез генома мышей (EUCOMM, KOMP, NorCOMM и TIGM). Эти репозитории ES-клеток, координируемые Международным консорциумом нокаутных мышей (IKSC), доступны для обмена между международными исследовательскими подразделениями. Существующие ресурсы включают мутации в 11 539 уникальных генах, 4 414 из которых условны. [ 14 ]
Соответствующие технологии в настоящее время достигли уровня, позволяющего их распространение на другие виды млекопитающих и на стволовые клетки человека, в первую очередь на клетки со статусом iPS (индуцированного плюрипотентного) .
См. также
[ редактировать ]- Сайт-специфическая рекомбинация
- Обмен кассет, опосредованный рекомбиназой
- Cre рекомбиназа
- Кре-Локс рекомбинация
- Рекомбинация FLP-FRT
- Генетическая рекомбинация
- Гомологичная рекомбинация
Ссылки
[ редактировать ]- ^ Зауэр, Брайан; Хендерсон, Нэнси (1988). «Сайт-специфическая рекомбинация ДНК в клетках млекопитающих с помощью Cre-рекомбиназы бактериофага P1» . Труды Национальной академии наук Соединенных Штатов Америки . 85 (14): 5166–70. Бибкод : 1988PNAS...85.5166S . дои : 10.1073/pnas.85.14.5166 . JSTOR 32380 . ПМЦ 281709 . ПМИД 2839833 .
- ^ О'Горман, Стивен; Фокс, Дэниел Т.; Валь, Джеффри М. (1991). «Опосредованная рекомбиназой активация генов и сайт-специфическая интеграция в клетках млекопитающих». Наука . 251 (4999): 1351–5. Бибкод : 1991Sci...251.1351O . дои : 10.1126/science.1900642 . JSTOR 2875533 . ПМИД 1900642 .
- ^ Jump up to: а б Раевский, Клаус (2007). «От мечты к реальности» . Европейский журнал иммунологии . 37 : С134–7. дои : 10.1002/eji.200737819 . ПМИД 17972357 .
- ^ Бранда, Кэтрин С.; Дымецки, Сьюзен М. (2004). «Говоря о революции. Влияние сайт-специфических рекомбиназ на генетический анализ мышей» . Развивающая клетка . 6 (1): 7–28. дои : 10.1016/S1534-5807(03)00399-X . ПМИД 14723844 .
- ^ Jump up to: а б Нерн, А.; Пфайффер, Б.Д.; Свобода, К. ; Рубин, генеральный менеджер (2011). «Множество новых сайт-специфических рекомбиназ для использования при манипулировании геномами животных» . Труды Национальной академии наук . 108 (34): 14198–203. Бибкод : 2011PNAS..10814198N . дои : 10.1073/pnas.1111704108 . ПМК 3161616 . ПМИД 21831835 .
- ^ Jump up to: а б с д и ж Туран, С.; Боде, Дж. (2011). «Сайт-специфические рекомбиназы: от геномных модификаций на основе тегов и мишеней» . Журнал ФАСЭБ . 25 (12): 4088–107. дои : 10.1096/fj.11-186940 . ПМИД 21891781 . S2CID 7075677 .
- ^ Боде, Юрген; Шлейк, Томас; Ибер, Микаэла; Шубелер, Дирк; Зайблер, Йост; Снежков, Евгений; Николаев, Лев (2000). «Набор инструментов трансгенетиков: новые методы целенаправленной модификации геномов эукариот». Биологическая химия . 381 (9–10): 801–13. дои : 10.1515/BC.2000.103 . ПМИД 11076013 . S2CID 36479502 .
- ^ Лызник, Лешек А.; Митчелл, Джон С.; Хираяма, Линн; Ходжес, Томас К. (1993). «Активность дрожжевой рекомбиназы FLP в протопластах кукурузы и риса» . Исследования нуклеиновых кислот . 21 (4): 969–75. дои : 10.1093/нар/21.4.969 . ПМК 309231 . ПМИД 8451196 .
- ^ Лаут, М.; Спрэафико, Ф; Детлеффсен, К; Мейер, М (2002). «Стабильный и эффективный обмен кассет в невыбираемых условиях за счет комбинированного использования двух сайт-специфических рекомбиназ» . Исследования нуклеиновых кислот . 30 (21): 115е. дои : 10.1093/нар/gnf114 . ПМЦ 135837 . ПМИД 12409474 .
- ^ Jump up to: а б Кароу, Мариса; Калос, Мишель П. (2011). «Терапевтический потенциал интегразы phiC31 как системы генной терапии». Экспертное мнение о биологической терапии . 11 (10): 1287–96. дои : 10.1517/14712598.2011.601293 . ПМИД 21736536 . S2CID 2674915 .
- ^ Умар, Андре; Цяо, Цзюньхуа; Йосток, Томас; Ли, Цзяндун; Боде, Юрген (2006). «Рекомендуемый метод использования хромосом: системы кассетного обмена на основе RMCE в биотехнологии клеток животных» . Цитотехнология . 50 (1–3): 93–108. дои : 10.1007/s10616-006-6550-0 . ПМК 3476001 . ПМИД 19003073 .
- ^ Jump up to: а б Леоне, Дино П; Жену, Сен-Тефан; Атанасоски, Сузана; Граузенбургер, Рейнхард; Бергер, Филипп; Мецгер, Дэниел; МакКлин, Венди Б; Шамбон, Пьер; Сутер, Ули (2003). «Тамоксифен-индуцируемые глиоспецифические мыши Cre для соматического мутагенеза в олигодендроцитах и шванновских клетках». Молекулярная и клеточная нейробиология . 22 (4): 430–40. дои : 10.1016/S1044-7431(03)00029-0 . ПМИД 12727441 . S2CID 624620 .
- ^ Кеннинг, М.; Джексон, С.; Хэй, СМ; Фаукс, К.; Килпатрик, Ти Джей; Уиллингем, М.; Эмери, Б. (2012). «Фактор регулирования гена миелина необходим для поддержания идентичности миелина и зрелых олигодендроцитов во взрослой ЦНС» . Журнал неврологии . 32 (36): 12528–42. doi : 10.1523/JNEUROSCI.1069-12.2012 . ПМК 3752083 . ПМИД 22956843 .
- ^ Jump up to: а б Брэдли, Аллан; Анастассиадис, Константинос; Аяди, Абделькадер; Бэтти, Джеймс Ф.; Белл, Синди; Бирлинг, Мари-Кристин; Боттомли, Джоанна; Браун, Стив Д.; и др. (2012). «Ресурс о функциях генов млекопитающих: Международный консорциум нокаутных мышей» . Геном млекопитающих . 23 (9–10): 580–6. дои : 10.1007/s00335-012-9422-2 . ПМК 3463800 . ПМИД 22968824 .
- ^ Аскью, Дж. Роджер; Дучман, Томас; Лингрел, Джерри Б. (1993). «Сайт-направленные точечные мутации в эмбриональных стволовых клетках: стратегия, нацеленная на гены, тегирование и обмен» . Молекулярная и клеточная биология . 13 (7): 4115–24. дои : 10.1128/MCB.13.7.4115 . ПМК 359961 . ПМИД 8391633 .
Внешние ссылки
[ редактировать ]- http://www.knockoutmouse.org/
- Эмес, РД; Гудштадт, Л; Зима, ЭЭ; Понтинг, КП (2003). «Сравнение геномов человека и мыши закладывает основы геномной зоологии» . Хум Мол Жене . 12 (7): 701–9. дои : 10.1093/hmg/ddg078 . ПМИД 12651866 .