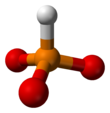
Фосфит-анион

| |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК
фосфонат
| |||
| Систематическое название ИЮПАК
Фосфит [ 1 ] | |||
| Идентификаторы | |||
3D model ( JSmol )
|
| ||
| КЭБ | |||
| ХимическийПаук | |||
| 1618 | |||
| МеШ | Фосфорит | ||
ПабХим CID
|
|||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| ГПО 2− 3 | |||
| Молярная масса | 79.9810 g mol −1 | ||
| Родственные соединения | |||
Другие анионы
|
Фосфинит | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
Фосфит -анион или фосфит в неорганической химии обычно относится к [HPO 3 ] 2− но включает [H 2 PO 3 ] − ([HPO 2 (OH)] − ). Эти анионы представляют собой сопряженные основания фосфористой кислоты (H 3 PO 3 ). Соответствующие соли, например фосфит натрия (Na 2 HPO 3 ), обладают восстановительным характером.
Номенклатура
[ редактировать ]Рекомендуемое ИЮПАК название фосфористой кислоты — фосфоновая кислота . , рекомендованное IUPAC. Соответственно, название HPO 2−
3- ион – фосфонат . В США правила наименования неорганических соединений ИЮПАК преподаются в средней школе, но не являются «обязательной» частью учебной программы. [ 2 ] Известный учебник университетского уровня соответствует рекомендациям IUPAC. [ 3 ] На практике любая ссылка на «фосфит» должна быть исследована, чтобы определить используемое соглашение об именах.
Соли, содержащие HPO 3 2− , называемые фосфонатами или фосфитами
[ редактировать ]
Структурная формула Na 2 HPO 3 . Анион имеет симметрию C3v .
С коммерческой точки зрения наиболее важной фосфитной солью является основной фосфит свинца . Структурно исследованы многие соли, содержащие фосфит-ион, к ним относится фосфита натрия пентагидрат (Na 2 HPO 3 ·5H 2 O). (NH 4 ) 2 HPO 3 ·H 2 O, CuHPO 3 ·H 2 O, SnHPO 3 и Al 2 (HPO 3 ) 3 ·4H 2 O. [ 4 ] Структура ГПО 2−
3 приблизительно тетраэдрический. [ 5 ] [ 6 ]
ГПО 2−
3 имеет ряд канонических резонансных форм, что делает его изоэлектронным с бисульфит -ионом HSO. −
3 , который имеет аналогичную структуру. [ 7 ]

Соли, содержащие HP(O) 2 OH −
[ редактировать ]Кислые или водородные фосфиты называются гидрофосфонатами или кислыми фосфитами. ИЮПАК рекомендует называть гидрофосфонаты). Это анионы HP(O) 2 OH. − . Айпическое производное представляет собой соль [NH 4 ][HP(O) 2 OH]. [ 7 ] [ 6 ] Известно множество родственных солей, например, RbHPHO 3 , CsHPHO 3 , TlHPHO 3 . Эти соли получают обработкой фосфористой кислоты металла карбонатом . Эти соединения содержат слой полимерного аниона, состоящий из тетраэдров HPO 3 , связанных водородными связями. Эти слои перемежаются слоями катионов металлов. [ 8 ]
Органические эфиры фосфитов водорода представляют собой анионы формулы HP(O) 2 OR − (R = органическая группа). Одним из коммерческих примеров является фунгицид фосетил-Al формулы [C 2 H 5 OP(H)O 2 ] 3 Al. [ 9 ]
Соли, содержащие H 2 P 2 O 5 2− , называемые дифосфитами или пирофосфитами.
[ редактировать ]Пирофосфиты (дифосфиты) можно получить путем осторожного нагревания кислых фосфитов при пониженном давлении. Они содержат ион H
2 П
22О 2−
5 , которую можно сформулировать [HP(O) 2 O−P(O) 2 H] 2− . [ 7 ] [ 6 ]
Параллели в химии мышьяка
[ редактировать ]В отличие от скудности доказательств ПО 3−
3 – соответствующий ион мышьяка, орто- арсенит , AsO 3−
3 известно. Примером может служить Ag 3 AsO 3 , а также полимерный метаарсенит (AsO −
2 )
н . [ 7 ] Изоэлектронный сульфит- ион SO 2−
3 известен по его солям. [ 7 ]
Использование в качестве фунгицидов
[ редактировать ]В этом разделе отсутствует информация о механизме противогрибкового/противопротозойного действия. ( март 2022 г. ) |
Неорганические фосфиты (содержащие HPO 2−
3 ) применялись на сельскохозяйственных культурах для борьбы с грибоподобными возбудителями отряда оомицетов (водяных плесеней). Ситуация запутанная из-за сходства названий между фосфитом и фосфатом (основное питательное вещество для растений и ингредиент удобрений ) и противоречивая, поскольку фосфиты иногда рекламируются как удобрения, хотя они слишком медленно превращаются в фосфаты, чтобы служить основным питательным веществом для растений. источник фосфора. Фактически, фосфиты могут вызывать фитотоксичность, когда растение испытывает недостаток фосфатов. [ 10 ] Лемойни [ 11 ] и другие описали эту сложную ситуацию и отметили, что наименование фосфитов удобрениями позволило избежать сложностей с регулированием и негативного общественного мнения, которое могло возникнуть при регистрации их в качестве фунгицидов. [ 10 ]
Основной формой неорганического фосфита, используемой в сельском хозяйстве, является фосфит монокалия . Это соединение действительно служит калийным удобрением.
См. также
[ редактировать ]- Гипофосфит – H
2 ПО −
2 - Фосфорорганический
- Фосфин – PH 3 и органические фосфины PR 3.
- Оксид фосфина – OPR 3
- Фосфинит – P(OR)R 2
- Фосфонит – P(OR) 2 R
- Фосфинат – OP(OR)R 2
- Фосфонат – органические фосфонаты OP(OR) 2 R
- Фосфат – ПО 3−
4 - Фосфорорганические соединения – ОП(ОР) 3
Дальнейшее чтение
[ редактировать ]- А. Эрншоу; Норман Гринвуд (1997). Химия элементов (2-е изд.). стр. 513–514.
Ссылки
[ редактировать ]- ^ «Фосфорит - Публичная химическая база данных PubChem» . Проект ПабХим . США: Национальный центр биотехнологической информации.
- ^ Основная учебная программа по физическим параметрам/химии, Университет штата Нью-Йорк, Департамент образования штата, http://www.p12.nysed.gov/ciai/mst/pub/chemist.pdf. Архивировано 29 марта 2018 г. на сайте машина обратного пути
- ^ Эгон Виберг, Арнольд Фредерик Холлеман (2001) Неорганическая химия , Elsevier ISBN 0-12-352651-5
- ^ «Синтез и кристаллические структуры фосфитов алюминия и железа», Д. М. Пуджари, Ю. Чжан, Д. Е. Кокс, П. Р. Рудольф, С. Ченг и А. Клирфилд, J. Chem. Кристаллогр. 24 (1994) 155–163
- ^ LE Гордон, WTA Харрисон. «Тетрагидрат бис(меламин)гидрофосфита». Акта Кристаллогр. 59 (2): о195–о197. дои : 10.1107/S1600536803001247
- ^ Jump up to: а б с «Кристаллохимия неорганических фосфитов», Ж. Луб, Acta Crystallogr. (1991), Б47 , 468–473, дои : 10.1107/S0108768191002380
- ^ Jump up to: а б с д и Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Костерина Е.В., Троянов С.И., Кемниц Э., Асланов Л.А. (2001). «Синтез и кристаллическая структура кислых фосфитов RbH 2 PO 3 , CsH 2 PO 3 и TlH 2 PO 3 ». Российский журнал координационной химии . 27 (7): 458–462. дои : 10.1023/А:1011377229855 . S2CID 91297300 .
- ^ Франц Мюллер; Питер Акерманн; Пол Марго (2012). «Фунгициды сельскохозяйственные. 2. Индивидуальные фунгициды». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.o12_o06 . ISBN 978-3-527-30673-2 .
- ^ Jump up to: а б Тао; Ямакава (2008). «Фосфит (фосфористая кислота): фунгицид, удобрение или биостимулятор?» . Почвоведение и питание растений . 55 (2): 228–234. дои : 10.1111/j.1747-0765.2009.00365.x . S2CID 95723306 .
- ^ «Фосфиты и фосфаты: когда дистрибьюторы и производители могут запутаться!» Жан-Пьер Леймони. С разрешения New Ag International , сентябрь 2007 г.