DHX8
| DHX8 | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | DHX8 , DDX8, HRH1, PRP22, PRPF22, DEAH-бокс-геликаза 8, Dhr2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 600396 ; МГИ : 1306823 ; Гомологен : 3628 ; Генные карты : DHX8 ; OMA : DHX8 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
DEAH-бокс-геликаза 8 представляет собой белок , который у человека кодируется DHX8 геном . Этот белок является членом семейства полипептидов DEAH-бокса . Основной характеристикой этой группы является консервативный мотив DEAH (Asp-Glu-Ala-His). [ 5 ] К этому семейству принадлежит широкий спектр РНК-хеликаз. В частности, DHX8 действует как АТФ-зависимая РНК-хеликаза, участвующая в сплайсинге и регуляции высвобождения сплайсированных мРНК из сплайсосом из ядра. [ 6 ] Опубликованные исследования показали последствия мутаций DHX8, некоторые из них имеют решающее значение для биологических процессов, таких как кроветворение , и связаны с некоторыми заболеваниями. [ 7 ] [ 8 ]
Структура
[ редактировать ]
Белок DHX8 является частью белкового комплекса, называемого сплайсосомой, который отвечает за сплайсинг пре-мРНК. Сплайсосома имеет восемь основных функциональных состояний, каждое из которых имеет свой состав и структуру; пять из восьми штатов структурно охарактеризованы. [ 10 ]
DHX8 имеет разные домены: РНК-связывающий домен S1 (бокс DEAD/DEAH), хеликазно-консервативный C-концевой домен, геликазо-ассоциированный домен (HA2) и олигонуклеотид/олигосахарид-связывающий (OB)-складок, каждый из которых соединен внутренне неупорядоченными регионы. [ 11 ]
Есть некоторые области белка, которые очень важны для его активности, например, R620, а также области «крючок-петля» и «крючок-поворот». Кроме того, DHX8Δ547 является каталитически активным ядром белка DHX8. Он состоит из двух доменов RecA, C-концевого WH, храпового и OB-складчатого доменов и N-концевой области. [ 9 ]
Общий вес конструкции DHX8 составляет 156580,13 Да.
Вторичная структура:
- 36% спираль: 26 спиралей и 246 остатков.
- 16% бета-лист: 29 нитей и 110 остатков. [ 9 ]
Функция
[ редактировать ]DHX8 локализован в клеточном ядре и стимулируется присутствием РНК. Этот белок входит в состав сплайсосомы, поэтому принимает участие в сплайсинге пре-мРНК. [ 9 ] Сплайсинг — это процесс соединения экзонов из первичных транскриптов информационной РНК и удаления последовательностей интронов посредством сплайсосомного механизма, так что образующаяся мРНК не содержит интронов и состоит исключительно из соединенных экзонов. [ 12 ] Сплайсинг заканчивается разборкой сплайсосомного комплекса и АТФ-зависимым высвобождением образующихся зрелых РНК за пределы ядра. [ 13 ] Сплайсосома требует конформационных изменений, чтобы катализировать реакции сплайсинга и высвобождение более поздней зрелой мРНК во внешнюю часть ядра. Одной из АТФ-зависимых геликаз, необходимых для этих конформационных изменений, является DHX8. Более того, DHX8 играет ключевую роль в высвобождении и облегчении ядерного экспорта сплайсированной мРНК. Характеристика белка показала, что DHX8 предпочитает связывание с РНК, богатой аденином. За этим связыванием следует гидролиз АТФ и, следовательно, высвобождение АДФ. [ 9 ]
Механизм
[ редактировать ]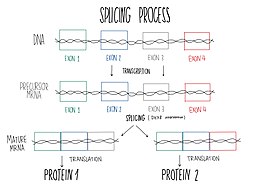
DHX8 выполняет множество молекулярных функций, таких как связывание АТФ, селективные и нековалентные взаимодействия с коферментом и регулятором фермента аденозин-5'-трифосфатом. [ 14 ] Также идентичное связывание с белками (создает тип взаимодействия, аналогичный описанному выше, но с другими белками), связывание РНК и активность РНК-хеликазы, основанные на катализе реакции, раскручивающей спираль РНК: [ 15 ]
АТФ + H 2 O = АДФ + фосфат [ 16 ]
Распределение тканей
[ редактировать ]
Белок DHX8 имеет основные очаги экспрессии в головном мозге, особенно в мозжечке, где его можно найти в основном в клетках Пуркинье . Другими важными являются простата и желчный пузырь , зоны, где полипетид также находится в высокой степени экспрессии.
Белок DHX8 не экспрессируется в значительной степени во всех тканях и органах, яркими примерами являются костный мозг или мягкие ткани (периферические нервы), где у нас недостаточно количества белка, чтобы быть репрезентативным. [ 17 ]
Очистка и клонирование
[ редактировать ]Энзимологические анализы для биохимической характеристики белков требуют высоких концентраций интересующего белка, и их протоколы должны быть эффективными, простыми и экономичными, чтобы гарантировать успешную очистку. Одним из примеров подхода к очистке DHX8 является использование белковой метки под названием GST-His, привитой к белку DHX8.
N-концевой глутатион-сефарозный TAG (GST) и C-концевой His-метка, также известная как GST-His, представляет собой метку массой 29 кДа, которая позволяет осуществлять мелкомасштабную аффинную очистку рекомбинантных белков. Этот метод основан на двух разных метках, расположенных по бокам двух крайних частей белка. Однако это может повлиять на физиологические свойства белка, поэтому в каждом случае необходимы эмпирические испытания. [ 18 ]
Конструкции DHX8 создаются путем ПЦР-клонирования с использованием ферментов рестрикции. Для создания His 6 GST-DHX8Δ54 (гексагистидин-GST) кодирующую последовательность остатков от A548 до R1220 встраивают в версию «pFastBac», специального векторного набора Thermo Fisher Scientific, [ 19 ] модифицирован для кодирования N-концевой метки His 6 GST, за которой следует сайт расщепления протеазой HRV 3C (рекомбинантная протеаза рестрикционного уровня). HRV 3C представляет собой высокоочищенный рекомбинантный белок, слитый с 6XHis, который распознает тот же сайт расщепления, что и нативный фермент. И вектор, и вставка расщепляются ферментами рестрикции NdeI и EcoRI .
Для создания полноразмерных DHX8 (fl-DHX8-His 6 ) и DHX8Δ547-His 6 были разработаны ПЦР-праймеры, так что His 6 -метка слита с C-концом DHX8. Полученные ампликоны ПЦР, кодирующие fl-DHX8 (от M1 до R1220) или DHX8Δ547 (от A548 до R1220), встраивают в вектор «pFBDM». [ 20 ] ниже промотора полиэдрина. И вектор, и вставка расщепляются ферментами рестрикции BamHI и NotI . [ 9 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000067596 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000034931 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ген DHX8 - GeneCards | Белок DHX8 | Антитело DHX8» . www.genecards.org . Проверено 20 октября 2019 г.
- ^ «DHX8 - АТФ-зависимая РНК-геликаза DHX8 - Homo sapiens (Человек) - ген и белок DHX8» . ЮниПрот . Проверено 20 октября 2019 г.
- ^ Инглиш М.А., Лей Л., Блейк Т., Винкович С.М., Суд Р., Азума М. и др. (май 2012 г.). «Неполный сплайсинг, дефекты деления клеток и блокировка кроветворения у мутантных рыбок данио по dhx8» . Динамика развития . 241 (5): 879–89. дои : 10.1002/dvdy.23774 . ПМЦ 3328592 . ПМИД 22411201 .
- ^ Дзюба Н., Фергюсон М.Р., О'Брайен В.А., Санчес А., Пруссия А.Дж., Макдональд Н.Дж. и др. (октябрь 2012 г.). «Идентификация клеточных белков, необходимых для репликации вируса иммунодефицита человека 1 типа» . Исследования СПИДа и ретровирусы человека . 28 (10): 1329–39. дои : 10.1089/aid.2011.0358 . ПМЦ 3448097 . ПМИД 22404213 .
- ^ Jump up to: а б с д и ж ПДБ : 6ХЮ ; Фелисберто-Родригес С., Томас Дж.К., МакЭндрю С., Ле Биан Ю.В., Берк Р., Уоркман П., ван Монфор Р.Л. (сентябрь 2019 г.). «Структурная и функциональная характеристика человеческой РНК-хеликазы DHX8 дает представление о механизме РНК-стимулируемого высвобождения АДФ» . Биохимический журнал . 476 (18): 2521–2543. дои : 10.1042/BCJ20190383 . ПМИД 31409651 .
- ^ Чжан X, Чжан X, Ян С, Чжан В, Лю Д, Лэй Дж, Ши Ю (апрель 2019 г.). «Структуры сплайсосом человека до и после высвобождения лигированного экзона» . Клеточные исследования . 29 (4): 274–285. дои : 10.1038/s41422-019-0143-x . ПМК 6461851 . ПМИД 30728453 .
- ^ «Белок: DHX8_HUMAN (Q14562)» . ИнтерПро .
- ^ «Сплайсинг мРНК через сплайсосому» . Онтология генов и аннотации GO . Европейский институт биоинформатики (EMBL-EBI). Архивировано из оригинала 21 июля 2019 г.
- ^ «Разборка сплайсосомного комплекса» . Онтология генов и аннотации GO . Европейский институт биоинформатики (EMBL-EBI). Архивировано из оригинала 22 октября 2019 г.
- ^ «АТФ-связывание» . Онтология генов и аннотации GO . Европейский институт биоинформатики (EMBL-EBI). Архивировано из оригинала 27 сентября 2017 г.
- ^ «Активность РНК-хеликазы» . Онтология генов и аннотации GO . Европейский институт биоинформатики (EMBL-EBI). Архивировано из оригинала 14 августа 2019 г.
- ^ «UniProtKB — Q14562 (DHX8_HUMAN)» . ЮниПрот .
- ^ Jump up to: а б «Тканевая экспрессия DHX8 - Резюме - Атлас белков человека» . www.proteinatlas.org . Проверено 25 октября 2019 г.
- ^ Майти Р., Паути Дж., Крич Дж., Бюиссон Р., Женуа М.М., Массон Дж.Ю. (октябрь 2013 г.). «Очистка GST-His: двухэтапный протокол аффинной очистки, дающий полноразмерные очищенные белки» . Журнал визуализированных экспериментов (80): e50320. дои : 10.3791/50320 . ПМЦ 3964817 . ПМИД 24193370 .
- ^ «Векторный набор Bac-to-Bac - Thermo Fisher Scientific» . www.thermofisher.com . Проверено 24 октября 2019 г.
- ^ «Аддген: pFBDM» . Аддген . Проверено 24 октября 2019 г.



