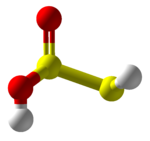
Тиосернистая кислота

| |||
| |||
| Имена | |||
|---|---|---|---|
| ИЮПАК имена | |||
| Систематическое название ИЮПАК
гидроксидооксидосульфанидосера [ 1 ] | |||
| Другие имена
сернотионовая кислота
Тиотионилгидроксид (минорный таутомер) | |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| КЭБ | |||
| ХимическийПаук | |||
| 184467 | |||
ПабХим CID
|
|||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| H2S2OH2S2O2 | |||
| Молярная масса | 98.14668 | ||
| Сопряженная база | Тиосульфит | ||
| Родственные соединения | |||
Родственные соединения
|
тиосерная кислота система единого входа тиосульфиновая кислота | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
Тиосернистая кислота представляет собой гипотетическое химическое соединение с формулой HS-S(=O)-OH или HO-S(=S)-OH. Попытка синтеза приводит к полимерам. [ 3 ] Это серная кислота с низкой степенью окисления (+1). [ 4 ] Это кислота Аррениуса для монооксида серы . Соли, полученные из тиосернистой кислоты, которые также неизвестны, называются «тиосульфитами», «тионосульфитами» или «сульфуротиоитами». Ион S=SO. 2−
2 .
Структуры
[ редактировать ]Другими возможными изомерами являются дигидроксидисульфан или гиподитионовая кислота HOSSOH, линейная цепь, и тиотионилгидроксид (S=S(OH) 2 ) – таутомер, в котором водород перешел от серы к кислороду. [ 5 ] HOSSOH может иметь два разных ротамера с симметрией C 1 и C 2 . Согласно расчетам, наиболее устойчивым является изомер с одним водородом на сере и одним на кислороде. [ 6 ]
Дитиосернистая кислота
[ редактировать ]Серный аналог тиосерной кислоты ( HS-S(=O) 2 -OH ), в котором два атома серы отходят от центрального атома серы линейной структуры дигидротрисульфида (тетратиосерная кислота, (S=) 2 S(−SH) 2 или ( − С-) 2 С 2+ (−SH) 2 ) также был изучен с помощью вычислений. [ 7 ]
Реакции
[ редактировать ]По-видимому, он разлагается на оксид полисульфана или политионовые кислоты в воде, которая называется жидкостью Вакенродера . [ 5 ]
В щелочных условиях тиосернистая кислота быстро разлагается, образуя смесь сульфида, серы, сульфита и тиосульфата. В кислых условиях он также образует сероводород и диоксид серы. Некоторые из них реагируют с образованием пентатионата и других политионатов . Тиосернистая кислота реагирует с сернистой кислотой с образованием тетратионата, а с тиосерной кислотой - с образованием гексатионата. [ 8 ]
Эфиры
[ редактировать ]возможны четыре изомера Для R 2 S 2 O 2 , по крайней мере, ограничивающие серу двух- и четырехвалентной валентностью: (RO) 2 S=S, ROSSOR, RS(O) 2 SR и RS(O)SOR. Для первых двух R-группы эквивалентны, а для последних двух они неэквивалентны. Простой пример – диэтилтиосульфит (EtO) 2 S=S. Он также известен как диэтилтионосульфит. Он является стереохимически жестким по временной шкале ЯМР примерно до 140 ° C, чем-то похож на диэтилсульфоксид. Многие производные были получены из гликолей. Из мезогидробензоина (PhCH(OH)−CH(OH)Ph) получают два изомера; третий изомер получается из d , l -PhCH(OH)-CH(OH)Ph. [ 9 ] [ 10 ]
Реакция с простыми источниками алкоксидов с дихлоридом дисеры дает неразветвленный РОССОР. Они не смешиваются с водой, но растворяются в бензоле или четыреххлористом углероде. [ 8 ] Эти виды менее жесткие, чем эфиры тиосульфита.
Ссылки
[ редактировать ]- ^ Jump up to: а б Международный союз теоретической и прикладной химии (2005). Номенклатура неорганической химии (Рекомендации ИЮПАК 2005 г.). Кембридж (Великобритания): RSC – IUPAC . ISBN 0-85404-438-8 . п. 139. Электронная версия.
- ^ Имя ACD Chemsketch бесплатно
- ^ Шмидт, Хейнар; Ральф Штойдель; Детлев Суэльцле; Хельмут Шварц (1992). «Соединения серы. 148. Получение и характеристика дигидроксидисульфида, HOSSOH: цепочечного изомера тиосернистой кислоты». Неорганическая химия . 31 (6): 941–944. дои : 10.1021/ic00032a004 . ISSN 0020-1669 .
- ^ +1 — средняя степень окисления двух структурно различных атомов серы. Внешний атом имеет степень окисления -1, а центральный атом серы имеет степень окисления +3.
- ^ Jump up to: а б Виберг, Эгон; Виберг, Нильс (2001). Неорганическая химия . Академическая пресса. п. 552. ИСБН 9780123526519 . Проверено 3 ноября 2013 г.
- ^ Мяскевич, Кароль; Ральф Штойдель (1991). «Соединения серы. Часть 140. Строение и относительная устойчивость семи изомерных форм H2S2O2». Журнал Химического общества, Dalton Transactions (9): 2395. doi : 10.1039/DT9910002395 . ISSN 0300-9246 .
- ^ Нисимото, Акико; Чжан, Дейзи Ю. (2003). «Гипервалентность серы? Ab initio и DFT-исследования структуры тиосульфата и родственных оксианионов серы». Серные буквы . 26 (5/6): 171–180. дои : 10.1080/02786110310001622767 . S2CID 95470892 .
- ^ Jump up to: а б Наир, К.Г. Рамачандран; А. Р. Васудева Мурти (19 июня 1961 г.). «Гидролитические реакции эфиров и амидов тиосернистой кислоты» (PDF) . Труды Индийской академии наук . 56 (3). Бангалор: 130–140. дои : 10.1007/BF03045863 . S2CID 35057986 .
- ^ Эли Зисман-Колман Дэвид Н. Харпп «Диалкоксидисульфиды и их изомеры тионосульфита с разветвленными связями» J. Sulphur Chemistry 2004, vol. 25, стр. 155–182. дои : 10.1080/1741599342000202176
- ^ Зисман-Колман, Эли; Чарльз Б. Абрамс; Дэвид Н. Харпп (2003). «Синтез новых циклических тионосульфитов». Журнал органической химии . 68 (18): 7059–7062. дои : 10.1021/jo0346306 . ISSN 0022-3263 . ПМИД 12946149 .