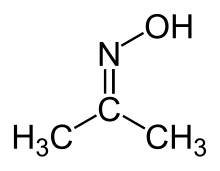
Ацетон оксим
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
N -Гидроксипропан-2-имин | |
| Другие имена
ацетоксим; N -гидрокси-2-пропанимин; Метилметилкетоксим; 2-пропанон оксим
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.004.383 |
| Номер ЕС |
|
| КЕГГ | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| C3H7NC3H7NO | |
| Молярная масса | 73.095 g·mol −1 |
| Появление | Белая игла, похожая на кристаллы |
| Плотность | 0,901 г/мл [ 1 ] |
| Температура плавления | От 60 до 63 ° C (от 140 до 145 ° F; от 333 до 336 К) |
| Точка кипения | 135 ° C (275 ° F; 408 К) |
| 330 г/л (20 °С) | |
| -44.42·10 −6 см 3 /моль | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности
|
Может быть вреден при проглатывании |
| СГС Маркировка : | |
   
| |
| Опасность | |
| Х228 , Х302 , Х317 , Х318 , Х351 | |
| P201 , P202 , P210 , P240 , P241 , P261 , P264 , P270 , P272 , P280 , P281 , P301+P312 , P302+P352 , P305+P351+P338 , P308+P313 , P310 , П330 21 , П333 , +П313 , П363 , П370+П378 , П405 , П501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 60 ° С (140 ° F; 333 К) |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза )
|
4000 мг/кг Внутрибрюшинно-мышь |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Оксим ацетона ( ацетоксим ) — органическое соединение формулы (CH 3 ) 2 CNOH. Это простейший пример кетоксима . Это белое кристаллическое твердое вещество, растворимое в воде, этаноле, эфире, хлороформе и лигроине. Используется как реагент в органическом синтезе . [ 2 ]
Оксим ацетона (ацетоксим) был впервые получен и назван в 1882 году немецким химиком Виктором Мейером и его швейцарским студентом Алоисом Янни. [ 3 ]
Подготовка
[ редактировать ]Оксим ацетона синтезируют конденсацией ацетона и гидроксиламина в присутствии HCl: [ 4 ] [ 2 ]
- (CH 3 ) 2 CO + H 2 NOH → (CH 3 ) 2 CNOH + H 2 O
Его также можно получить путем аммоксидирования ацетона в присутствии перекиси водорода. [ 5 ]
Использование
[ редактировать ]Оксим ацетона является отличным ингибитором коррозии (раскислителем) с более низкой токсичностью и большей стабильностью по сравнению с обычным агентом гидразином . Он также полезен при определении кетонов, кобальта и в органическом синтезе. [ 6 ]
Ссылки
[ редактировать ]- ^ Химический каталог Sigma-Aldrich «Ацетоноксим» . Проверено 2 сентября 2016 г.
- ^ Jump up to: а б Стивен М. Вайнреб, Кристина Борстник «Оксим ацетона» Электронная энциклопедия реагентов для органического синтеза EROS, 2007. дои : 10.1002/047084289X.rn00765
- ^ Мейер, Виктор; Дженни, Алоис (1882). «О влиянии гидроксиламина на ацетон» . Отчеты Немецкого химического общества (на немецком языке). 15 : 1324–1326. дои : 10.1002/cber.188201501285 . Из стр. 1324: «Вещество, которое мы – ввиду его близкого родства с ацетоксимовой кислотой и поскольку оно не обладает кислотными свойствами – будем пока называть «ацетоксим»…)
- ^ Справочник по химии и физике «Ацетоноксим» . Архивировано из оригинала 24 июля 2017 года . Проверено 23 апреля 2014 г.
- ^ Синьхуа Лян, Жентао Ми, Яцюань Ван, Ли Ван, Сянвэнь Чжан «Синтез оксима ацетона посредством аммоксимации ацетона над TS-1» Письма по кинетике реакций и катализу, том 82, стр. 333-337. [1] .
- ^ Свойства оксима ацетона , дополнительный текст.
