Двойной слой (наука о поверхности)

В Surface Science двойной слой ( DL , также называемый электрическим двойным слоем , EDL ) - это структура, которая появляется на поверхности объекта, когда он подвергается воздействию жидкости . Объект может быть твердой частицей, газовым пузырьком жидкости , каплей или пористым телом . DL относится к двум параллельным слоям заряда вокруг объекта. Первый слой, поверхностный заряд (либо положительный, либо отрицательный), состоит из ионов , которые адсорбируются на объект из -за химических взаимодействий . Второй слой состоит из ионов, привлеченных к поверхностному заряду с помощью кулоновской силы , электрически проверяя первый слой. Этот второй слой слабо связан с объектом. Он изготовлен из свободных ионов, которые перемещаются в жидкости под влиянием электрического притяжения и теплового движения , а не прочно закреплены. Таким образом, это называется «диффузный слой».
Межфазные DLS наиболее очевидны в системах с большим соотношением поверхностного района к объему , такими как коллоидные или пористые тела с частицами или пор (соответственно) в масштабе микрометр до нанометров . Тем не менее, DLS важны для других явлений, таких как электрохимическое поведение электродов .
DLS играет фундаментальную роль во многих повседневных веществах. Например, гомогенизированное молоко существует только потому, что капли жира покрыты DL, который предотвращает их коагуляцию в масло . DL существуют практически во всех гетерогенных системах на основе жидкости, таких как кровь, краска, чернила и керамическая и цементная суспензия .
DL тесно связан с электрокинетическими явлениями и электроаакустическими явлениями .
Разработка (межфазного) двойного слоя
[ редактировать ]Гельмгольц
[ редактировать ]
Когда электронный проводник вступает в контакт с твердым или жидким ионным проводником (электролитом), появляется общая граница ( раздела ) среди двух фаз . Герман фон Хельмгольц [ 1 ] был первым, кто осознал, что заряженные электроды погружаются в электролитные растворы отталкивают совместные сведения заряда, привлекая противоионы на свои поверхности. Два слоя противоположной формы полярности на границе раздела между электродом и электролитом. В 1853 году он показал, что электрический двойной слой (DL) по сути является молекулярным диэлектриком и хранит заряд электростатически. [ 2 ] Ниже напряжения разложения электролита хранимый заряд линейно зависит от приложенного напряжения.
Эта ранняя модель предсказывала постоянную дифференциальную емкость, независимую от плотности заряда в зависимости от диэлектрической постоянной электролита растворителя и толщины двойного слоя. [ 3 ] [ 4 ] [ 5 ]
Эта модель, хотя и является хорошей основой для описания границы раздела, не учитывает важных факторов, включая диффузию/смешивание ионов в растворе, возможность адсорбции на поверхность и взаимодействие между растворительными дипольными моментами и электродом.
Гуи - Хапман
[ редактировать ]Луи Жорж Гуи в 1910 году и Дэвид Леонард Чепмен в 1913 году отметили, что емкость не была постоянной и что она зависела от приложенного потенциала и ионной концентрации. «Модель Gouy -Chapman» внесла значительные средства, внедрив диффузную модель DL. В этой модели распределение ионов заряда в зависимости от расстояния от металлической поверхности позволяет статистику Maxwell -Holtzmann применять . Таким образом, электрический потенциал уменьшается в геометрической прогрессии от поверхности объема жидкости. [ 3 ] [ 6 ]
Слои Gouy-Chapman могут иметь особое значение в биоэлектрохимии. Наблюдение за переносом электронов на длинные дистанции через водный раствор [ 7 ] был связан с диффузной областью между окислительно -восстановительными партнерами ( цитохромы C и C 1 ), которая истощена катионами по сравнению с объемом раствора, что приводит к снижению скрининга , электрическим полям, продлевающим несколько нанометров, и уменьшаются квази экспонента со скоростью ~ 1 нм −1 Полем Этот регион называется «Gouy-Chapman Conduit» [ 7 ] и строго регулируется фосфорилированием , которое добавляет один отрицательный заряд к поверхности белка, которая нарушает катионное истощение и предотвращает транспорт на расстоянии. [ 8 ] Аналогичные эффекты наблюдаются в окислительно -восстановительной активной площадке фотосинтетических комплексов . [ 9 ]
Корм
[ редактировать ]Модель Gouy-Chapman выходит из строя для высоко заряженных DLS. В 1924 году Otto Stern предложил объединить модель Helmholtz с моделью Gouy-Chapman: в модели Стерна некоторые ионы прилипают к электроду, как предполагает Гельмгольц, давая внутренний строгий слой, в то время как некоторые образуют диффузный слой Gouy-Chapman. [ 10 ]
Стерный слой учитывает конечный размер ионов, и, следовательно, ближайший подход иона к электроду находится в порядке ионного радиуса. Стерна имеет свои собственные ограничения, а именно то, что она эффективно рассматривает ионы как точечные заряды, предполагает, что все существенные взаимодействия в диффузном слое являются кулоновскими , предполагают, что диэлектрическая диэлектрическая проницаемость является постоянной на протяжении двух слоев, и что вязкость жидкости является постоянной плоскостью. [ 11 ]
Грэхэм
[ редактировать ]
DC Grahame модифицировал модель строги в 1947 году. [ 12 ] Он предположил, что некоторые ионные или незаряженные виды могут проникнуть в строгий слой, хотя ближайший подход к электроду обычно занимается молекулами растворителя. Это может произойти, если ионы потеряют свою сольвационную оболочку , когда они приближаются к электроду. Он вызвал ионы в прямом контакте с электродом «специально адсорбированные ионы». Эта модель предложила существование трех регионов. Внутренняя плоскость Гельмгольца (IHP) проходит через центры специально адсорбированных ионов. Внешняя плоскость Гельмгольца (OHP) проходит через центры сольватированных ионов на расстоянии их ближайшего подхода к электроду. [ 13 ] Наконец, диффузный слой - это область за пределами OHP.
Bockris/Devanathan/Müller (BDM)
[ редактировать ]В 1963 году Дж. О'М. Бокрис , Мав Деванатан и Клаус Мюллер [ 14 ] предложила модель BDM двойного слоя, которая включала действие растворителя на интерфейсе. Они предположили, что прикрепленные молекулы растворителя, такие как вода, будут иметь фиксированное выравнивание на поверхность электрода. Этот первый слой молекул растворителя отображает сильную ориентацию на электрическое поле в зависимости от заряда. Эта ориентация оказывает большое влияние на диэлектрическую проницаемость растворителя, которая варьируется в зависимости от силы поля. IHP проходит через центры этих молекул. В частности, адсорбированные, частично сольватированные ионы появляются в этом слое. Сольватированные ионы электролита находятся за пределами IHP. Через центры этих ионов проходят OHP. Диффузный слой - это область за пределами OHP.
ТРАНСКИЙ / Buzzanca
[ редактировать ]Further research with double layers on ruthenium dioxide films in 1971 by Sergio Trasatti and Giovanni Buzzanca demonstrated that the electrochemical behavior of these electrodes at low voltages with specific adsorbed ions was like that of capacitors. The specific adsorption of the ions in this region of potential could also involve a partial charge transfer between the ion and the electrode. It was the first step towards understanding pseudocapacitance.[4]
Conway
[edit]Between 1975 and 1980, Brian Evans Conway conducted extensive fundamental and development work on ruthenium oxide electrochemical capacitors. In 1991, he described the difference between 'Supercapacitor' and 'Battery' behavior in electrochemical energy storage. In 1999, he coined the term supercapacitor to explain the increased capacitance by surface redox reactions with faradaic charge transfer between electrodes and ions.[15][16]
His "supercapacitor" stored electrical charge partially in the Helmholtz double-layer and partially as the result of faradaic reactions with "pseudocapacitance" charge transfer of electrons and protons between electrode and electrolyte. The working mechanisms of pseudocapacitors are redox reactions, intercalation and electrosorption.
Marcus
[edit]The physical and mathematical basics of electron charge transfer absent chemical bonds leading to pseudocapacitance was developed by Rudolph A. Marcus. Marcus Theory explains the rates of electron transfer reactions—the rate at which an electron can move from one chemical species to another. It was originally formulated to address outer sphere electron transfer reactions, in which two chemical species change only in their charge, with an electron jumping. For redox reactions without making or breaking bonds, Marcus theory takes the place of Henry Eyring's transition state theory which was derived for reactions with structural changes. Marcus received the Nobel Prize in Chemistry in 1992 for this theory.[17]
Mathematical description
[edit]There are detailed descriptions of the interfacial DL in many books on colloid and interface science[18][19][20] and microscale fluid transport.[21][22] There is also a recent IUPAC technical report[23] on the subject of interfacial double layer and related electrokinetic phenomena.
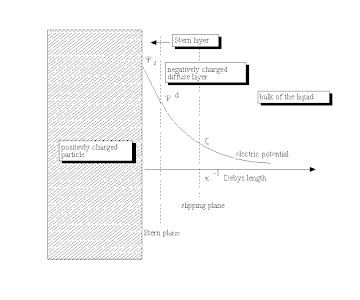
As stated by Lyklema, "...the reason for the formation of a "relaxed" ("equilibrium") double layer is the non-electric affinity of charge-determining ions for a surface..."[24] This process leads to the buildup of an electric surface charge, expressed usually in C/m2. This surface charge creates an electrostatic field that then affects the ions in the bulk of the liquid. This electrostatic field, in combination with the thermal motion of the ions, creates a counter charge, and thus screens the electric surface charge. The net electric charge in this screening diffuse layer is equal in magnitude to the net surface charge, but has the opposite polarity. As a result, the complete structure is electrically neutral.
The diffuse layer, or at least part of it, can move under the influence of tangential stress. There is a conventionally introduced slipping plane that separates mobile fluid from fluid that remains attached to the surface. Electric potential at this plane is called electrokinetic potential or zeta potential (also denoted as ζ-potential).[25][26]
The electric potential on the external boundary of the Stern layer versus the bulk electrolyte is referred to as Stern potential. Electric potential difference between the fluid bulk and the surface is called the electric surface potential.
Usually zeta potential is used for estimating the degree of DL charge. A characteristic value of this electric potential in the DL is 25 mV with a maximum value around 100 mV (up to several volts on electrodes[22][27]). The chemical composition of the sample at which the ζ-potential is 0 is called the point of zero charge or the iso-electric point. It is usually determined by the solution pH value, since protons and hydroxyl ions are the charge-determining ions for most surfaces.[22][24]
Zeta potential can be measured using electrophoresis, electroacoustic phenomena, streaming potential, and electroosmotic flow.
The characteristic thickness of the DL is the Debye length, κ−1. It is reciprocally proportional to the square root of the ion concentration C. In aqueous solutions it is typically on the scale of a few nanometers and the thickness decreases with increasing concentration of the electrolyte.
The electric field strength inside the DL can be anywhere from zero to over 109 V/m. These steep electric potential gradients are the reason for the importance of the DLs.
The theory for a flat surface and a symmetrical electrolyte[24] is usually referred to as the Gouy-Chapman theory. It yields a simple relationship between electric charge in the diffuse layer σd and the Stern potential Ψd:[28]
There is no general analytical solution for mixed electrolytes, curved surfaces or even spherical particles. There is an asymptotic solution for spherical particles with low charged DLs. In the case when electric potential over DL is less than 25 mV, the so-called Debye-Huckel approximation holds. It yields the following expression for electric potential Ψ in the spherical DL as a function of the distance r from the particle center:
There are several asymptotic models which play important roles in theoretical developments associated with the interfacial DL.
The first one is "thin DL". This model assumes that DL is much thinner than the colloidal particle or capillary radius. This restricts the value of the Debye length and particle radius as following:
This model offers tremendous simplifications for many subsequent applications. Theory of electrophoresis is just one example.[29] The theory of electroacoustic phenomena is another example.[30]
The thin DL model is valid for most aqueous systems because the Debye length is only a few nanometers in such cases. It breaks down only for nano-colloids in solution with ionic strengths close to water.
The opposing "thick DL" model assumes that the Debye length is larger than particle radius:
This model can be useful for some nano-colloids and non-polar fluids, where the Debye length is much larger.
The last model introduces "overlapped DLs".[30] This is important in concentrated dispersions and emulsions when distances between particles become comparable with the Debye length.
Electrical double layers
[edit]The electrical double layer (EDL) is the result of the variation of electric potential near a surface, and has a significant influence on the behaviour of colloids and other surfaces in contact with solutions or solid-state fast ion conductors.
The primary difference between a double layer on an electrode and one on an interface is the mechanism of surface charge formation. With an electrode, it is possible to regulate the surface charge by applying an external electric potential. This application, however, is impossible in colloidal and porous double layers, because for colloidal particles, one does not have access to the interior of the particle to apply a potential difference.
EDLs are analogous to the double layer in plasma.
Differential capacitance
[edit]EDLs have an additional parameter defining their characterization: differential capacitance. Differential capacitance, denoted as C, is described by the equation below:
where σ is the surface charge and ψ is the electric surface potential.
Electron transfer in electrical double layer
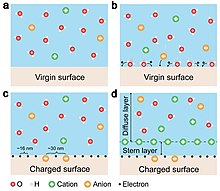
[edit]The formation of electrical double layer (EDL) has been traditionally assumed to be entirely dominated by ion adsorption and redistribution. With considering the fact that the contact electrification between solid-solid is dominated by electron transfer, it is suggested by Wang that the EDL is formed by a two-step process.[31] In the first step, when the molecules in the solution first approach a virgin surface that has no pre-existing surface charges, it may be possible that the atoms/molecules in the solution directly interact with the atoms on the solid surface to form strong overlap of electron clouds. Electron transfer occurs first to make the “neutral” atoms on solid surface become charged, i.e., the formation of ions. In the second step, if there are ions existing in the liquid, such as H+ and OH–, the loosely distributed negative ions in the solution would be attracted to migrate toward the surface bonded ions due to electrostatic interactions, forming an EDL. Both electron transfer and ion transfer co-exist at liquid-solid interface.[32]
See also
[edit]- Depletion region (structure of semiconductor junction)
- DLVO theory
- Electroosmotic pump
- Interface and colloid science
- Nanofluidics
- Poisson-Boltzmann equation
- Supercapacitor
References
[edit]- ^ Helmholtz, H. (1853), "Ueber einige Gesetze der Vertheilung elektrischer Ströme in körperlichen Leitern mit Anwendung auf die thierisch-elektrischen Versuche", Annalen der Physik und Chemie (in German), vol. 165, no. 6, pp. 211–233, Bibcode:1853AnP...165..211H, doi:10.1002/andp.18531650603
- ^ "The electrical double layer". 2011. Archived from the original on 31 May 2011. Retrieved 23 April 2013.
- ^ Jump up to: а беременный Адам Маркус Намискик. «Обзор электрохимической технологии суперконденсатора» (PDF) . Архивировано из оригинала (PDF) 2014-12-22 . Получено 2012-12-10 .
- ^ Jump up to: а беременный Srinivasan S. (2006) Топливные элементы, от основных до приложений, Springer Ebooks, ISBN 978-0-387-35402-6 , Глава 2, интерфейсы электрода/электролита: структура и кинетика передачи заряда. (769 КБ)
- ^ Электрохимические двойные конденсаторы с использованием электродных структур углеродных нанотрубок.
- ^ Эренштейн, Джеральд (2001). «Поверхностный заряд» (PDF) . Архивировано из оригинала (PDF) 28 сентября 2011 года . Получено 30 мая 2011 года .
- ^ Jump up to: а беременный Лагуны, Анна; Военный испаниш, Александр; Нин-Хилл, рассвет; Диас-Бранс, Ирен; Розы, Мигель А.; Сатисман, Джозеф; Ровира, Карме; Горостиза, Пау (2018-12-04). "Электрон на длинные расстояния . Природная связь 9 1 ) : ( два 10.1038/s41467-018-07499-x: ISSN 2041-1723 6279779PMC 30514833PMID 54444826S2CID
- ^ Гомил, MJ Александр; Perez-Mejía, Gonzalo; Нин-Хилл, рассвет; Военный испаниш, Александр; Железные дома, Лора; Ortiz-tecari, sthefany; Диас-пятый, Антонио; Сатисман, Джозеф; Ровира, Карме; Розы, Мигель А.; Диас-Бранс, Ирен; Горостик, Пау; Джаннотти, флот I.; Лагуны, Анна (2022-11-19). "Фосфорилирование нарушено . Природная связь 13 1 ( ) : два 10.1038/s41467-022-34809-1: 9675734PMC 36402842PMID
- ^ Лопес -Ортиз, Мануэль; Замора, Рикардо А.; Джаннотти, Марина Инес; Ху, Чен; Кроче, Роберта; Горостиза, Пау (февраль 2022 г.). «Расстояние и потенциальная зависимость переноса заряда через реакционный центр отдельных фотосинтетических комплексов» . Маленький . 18 (7): 2104366. DOI : 10.1002/SMLL.202104366 . HDL : 2445/191184 . ISSN 1613-6810 . PMID 34874621 . S2CID 244922892 .
- ^ Стерн, О. (1924). «О теории электролитического двойного слоя». Журнал электрохимии . 30 (21–22): 508. doi : 10.1002/bbpc.192400182 . S2CID 138033996 .
- ^ Смирнов, Джеральд (2011). «Электрический двойной слой» . Получено 23 апреля 2013 года .
- ^ Грэхэм, Дэвид С. (1947). «Электрический двойной слой и теория электрокапиллярности». Химические обзоры . 41 (3): 441–501. doi : 10.1021/cr60130a002 . ISSN 0009-2665 . PMID 18895519 .
- ^ Накумура, Масса; Сато, Наруса; Хоши, мир; Seakata, Osami (2011). «Внешняя плоскость Helmholtz сформированного двойного слоя электрического слоя, образованного на границе сплошного электрода-Liiid» Chemphyschem 12 (8): 1430–1434. Doi : 10.1002/ cphc.2 ISSN 1439-4 21557434PMID
- ^ Дж. О'М. Бокрис; Мав Деванатан; К. Мюллен (1963). «О структуре заряженных интерфейсов». Труды Королевского общества Лондона. Серия А. Математические и физические науки . 274 (1356): 55–79. Bibcode : 1963rspsa.274 ... 55b . doi : 10.1098/rspa.1963.0114 . ISSN 2053-9169 . S2CID 94958336 .
- ^ Conway, be (май 1991 г.), «переход от« суперконденсатора »к« поведению батареи »при хранении электрохимической энергии», журнал электрохимического общества (на немецком языке), вып. 138, нет. 6, pp. 1539–1548, Bibcode : 1991jels..138.1539c , doi : 10.1149/1.2085829
- ^ AK Shukla, TP Kumar, Энциклопедия электрохимии, столбы современной электрохимии: краткая история, архивная 20 августа 2013 г., в Wayback Machine (ноябрь, 2008 г.) Центральном институте электрохимических исследований
- ^ Рудольф А. Маркус: Нобелевская премия по химии 1992
- Бер
- ^ Russel, WB, Saville, DA и Schowalter, WR «коллоидные дисперсии», издательство Кембриджского университета, 1989
- ^ Kruyt, HR «коллоидная наука», Elsevier: том 1, необратимые системы, (1952)
- ^ Bruus, H. (2007). Теоретическая микрофлюидика .
- ^ Jump up to: а беременный в Кирби, Б.Дж. (2010). Механика микро- и наноразмерной жидкости: транспорт в микрофлюидных устройствах . Издательство Кембриджского университета. ISBN 978-0-521-11903-0 Полем Архивировано из оригинала 2019-04-28 . Получено 2010-01-15 .
- ^ «Измерение и интерпретация электрокинетических явлений», Международный союз чистой и прикладной химии, технический отчет, опубликованный в Pure Appl.chem., Vol 77, 10, pp.1753-1805, 2005 (pdf)
- ^ Jump up to: а беременный в Lyklema, J. «Основы интерфейса и коллоидной науки», Vol.2, Page.3.208, 1995
- ^ Моррисон, Ян Д.; Росс, Сидней (2002). Коллоидные дисперсии: подвески, эмульсии и пены (2 -е изд.). Нью -Йорк, Нью -Йорк: Уайли. ISBN 978-0-471-17625-1 .
- ^ Цзян, Цзингкун; Обердорстер, Гюнтер; Бисвас, Пратим (25 июня 2008 г.). «Характеристика размера, поверхностного заряда и состояния агломерации дисперсий наночастиц для токсикологических исследований». Журнал исследований наночастиц . 11 (1): 77–89. Bibcode : 2009jnr .... 11 ... 77J . doi : 10.1007/S11051-008-9446-4 . S2CID 95536100 .
- ^ Против Боготского, Основы электрохимии, Wiley-Interscience, 2006.
- ^ Ханаор, Дах; Гадири, М.; Chrzanowski, W.; Ган, Ю. (2014). «Масштабируемая характеристика площади поверхности путем электрокинетического анализа сложной анионной адсорбции» (PDF) . Langmuir . 30 (50): 15143–15152. Arxiv : 2106.03411 . doi : 10.1021/la503581e . PMID 25495551 . S2CID 4697498 .
- ^ Хантер, RJ «Основы коллоидной науки», Oxford University Press, 1989
- ^ Jump up to: а беременный Dukhin, AS и Goetz, PJ Характеристика жидкостей, нано- и микрофинатов и пористых тел с использованием ультразвука , Elsevier, 2017 ISBN 978-0-444-63908-0
- ^ Ван, ZL; Ван, AC (2019). «О происхождении контактной электрификации». Материалы сегодня . 30 : 34. doi : 10.1016/j.mattod.2019.05.016 . S2CID 189987682 .
- ^ Лин, кв; Сюй, Л.; Ван, AC; Wang, ZL (2020). «Количественная оценка электрона-переноса и ионного переноса при электрификации контакта с жидко-твердой и механизмом образования электрического двойного слоя» . Природная связь . 11 (1): 399. doi : 10.1038/s41467-019-14278-9 . PMC 6972942 . PMID 31964882 .
Дальнейшее чтение
[ редактировать ]- Стиллингер, Фрэнк Х.; Кирквуд, Джон Г. (1960). «Теория диффузного двойного слоя». Журнал химической физики . 33 (5): 1282–1290. Bibcode : 1960jchph..33.1282S . doi : 10.1063/1.1731401 . ISSN 0021-9606 .
- Пол С. Хименц (1986). Принципы коллоидной химии и поверхности . М. Деккер. ISBN 978-0-8247-7476-9 .
- Пол С. Хименц; Радж Раджагопалан (18 марта 1997 г.). Принципы коллоидной химии и поверхности, третье издание, пересмотренное и расширенное . CRC Press. ISBN 978-0-8247-9397-5 .




