Кооперативная привязка
Кооперативное связывание происходит в системах молекулярного связывания, содержащих более одного типа или вида молекул и в которых один из партнеров не является моновалентным и может связывать более одной молекулы другого вида. В общем, молекулярное связывание — это взаимодействие между молекулами, которое приводит к стабильной физической ассоциации между этими молекулами.
Кооперативное связывание происходит в системе молекулярного связывания, где две или более молекулы- лиганда могут связываться с молекулой рецептора . Связывание можно считать «кооперативным», если фактическое связывание первой молекулы лиганда с рецептором изменяет аффинность связывания второй молекулы лиганда. Связывание молекул-лигандов с различными участками молекулы рецептора не представляет собой взаимно независимых событий. Кооперативность может быть положительной или отрицательной, что означает, что становится более или менее вероятным, что последующие молекулы лиганда связываются с молекулой рецептора.
Кооперативное связывание наблюдается во многих биополимерах, включая белки и нуклеиновые кислоты . Было показано, что кооперативное связывание является механизмом, лежащим в основе широкого спектра биохимических и физиологических процессов.
История и математические формализмы
[ редактировать ]Кристиан Бор и концепция кооперативного связывания
[ редактировать ]В 1904 году Кристиан Бор изучал гемоглобина связывание с кислородом в различных условиях. [ 1 ] [ 2 ] При построении графика насыщения гемоглобина кислородом в зависимости от парциального давления кислорода он получил сигмоидальную (или «S-образную») кривую. Это указывает на то, что чем больше кислорода связано с гемоглобином, тем легче связывается большему количеству кислорода – до тех пор, пока все места связывания не будут насыщены. Кроме того, Бор заметил, что увеличение давления CO 2 смещает эту кривую вправо – т.е. более высокие концентрации CO 2 затрудняют связывание кислорода гемоглобином. [ 2 ] Это последнее явление, а также наблюдение о том, что сродство гемоглобина к кислороду увеличивается с увеличением pH, известно как эффект Бора .

Говорят, что молекула рецептора демонстрирует кооперативное связывание, если ее связывание с лигандом нелинейно масштабируется в зависимости от концентрации лиганда. Кооперативность может быть положительной (если связывание молекулы-лиганда увеличивает кажущееся сродство рецептора и, следовательно, увеличивает вероятность связывания другой молекулы-лиганда) или отрицательной (если связывание молекулы-лиганда снижает сродство и, следовательно, делает связывание других молекул-лигандов менее вероятным). . «Дробильное размещение» рецептора с данным лигандом определяется как количество сайтов связывания лиганда, деленное на общее количество сайтов связывания лиганда:
Если , то белок полностью несвязан, а если , он полностью насыщен. Если сюжет о в состоянии равновесия в зависимости от концентрации лиганда имеет сигмоидальную форму, как это наблюдал Бор для гемоглобина, это указывает на положительную кооперативность. Если это не так, то, глядя только на этот сюжет, нельзя сделать никаких утверждений о кооперативности.
Концепция кооперативного связывания применима только к молекулам или комплексам с более чем одним сайтом связывания лиганда. Если существует несколько сайтов связывания лиганда, но связывание лиганда с каким-либо одним сайтом не влияет на другие, рецептор называют некооперативным. Кооперативность может быть гомотропной , если лиганд влияет на связывание лигандов того же вида, или гетеротропной , если она влияет на связывание других видов лигандов. В случае гемоглобина Бор наблюдал гомотропную положительную кооперативность (связывание кислорода облегчает связывание большего количества кислорода) и гетеротропную отрицательную кооперативность (связывание CO 2 снижает способность гемоглобина связывать кислород).
На протяжении 20-го века были разработаны различные концепции для описания связывания лиганда с белком с более чем одним сайтом связывания и кооперативных эффектов, наблюдаемых в этом контексте. [ 3 ]
Уравнение Хилла
[ редактировать ]Первое описание кооперативного связывания с многосайтовым белком было разработано А. В. Хиллом . [ 4 ] Опираясь на наблюдения за связыванием кислорода с гемоглобином и идею о том, что кооперативность возникает в результате агрегации молекул гемоглобина, каждая из которых связывает одну молекулу кислорода, Хилл предложил феноменологическое уравнение, которое с тех пор было названо в его честь :

где это «коэффициент Хилла», обозначает концентрацию лиганда, обозначает кажущуюся константу ассоциации (используется в исходной форме уравнения), является эмпирической константой диссоциации, а микроскопическая константа диссоциации (используется в современных формах уравнения и эквивалентна ). Если , система демонстрирует отрицательную кооперативность, тогда как кооперативность положительна, если . Общее количество сайтов связывания лигандов является верхней границей . Уравнение Хилла можно линеаризовать как:
«Участок холма» получается путем построения против . В случае уравнения Хилла это линия с наклоном и перехватить . Это означает, что кооперативность предполагается фиксированной, т. е. она не меняется с насыщением. Это также означает, что сайты связывания всегда обладают одинаковым сродством, и кооперативность не возникает из-за увеличения сродства с концентрацией лиганда.
Уравнение Адэра
[ редактировать ]Г. С. Адэр обнаружил, что график Хилла для гемоглобина не является прямой линией, и предположил, что аффинность связывания не является фиксированным термином, а зависит от насыщения лиганда. [ 5 ] Продемонстрировав, что гемоглобин содержит четыре гема (и, следовательно, места связывания кислорода), он исходил из предположения, что полностью насыщенный гемоглобин образуется поэтапно, с промежуточными формами с одной, двумя или тремя связанными молекулами кислорода. Образование каждой промежуточной стадии из несвязанного гемоглобина можно описать с помощью кажущейся макроскопической константы ассоциации. . Полученную дробную занятость можно выразить как:
Или для любого белка с n сайтами связывания лиганда:
где n обозначает количество сайтов связывания и каждый — комбинированная константа ассоциации, описывающая связывание молекул i- лиганда. Объединив трактовку Адэра с графиком Хилла, можно прийти к современному экспериментальному определению кооперативности (Hill, 1985, Abeliovich, 2005). Результирующий коэффициент Хилла, или, точнее, наклон графика Хилла, рассчитанный по уравнению Адэра, можно показать как отношение между дисперсией числа связывания к дисперсии числа связывания в эквивалентной системе невзаимодействующих чисел. сайты связывания. [ 6 ] Таким образом, коэффициент Хилла определяет кооперативность как статистическую зависимость одного сайта связывания от состояния другого сайта(ов).
Уравнение Клотца
[ редактировать ]Работая над белками, связывающими кальций, Ирвинг Клотц деконволюцировал константы ассоциации Адэра, рассматривая поэтапное образование промежуточных стадий, и попытался выразить кооперативное связывание в терминах элементарных процессов, управляемых законом действующих масс. [ 7 ] [ 8 ] В его рамках - константа ассоциации, определяющая связывание первой молекулы лиганда, константа ассоциации, определяющая связывание второй молекулы-лиганда (когда первая уже связана) и т. д. Для , это дает:
Стоит отметить, что константы , и т.д. не относятся к отдельным сайтам связывания. Они описывают, сколько сайтов связывания занято, а не какие именно . Эта форма имеет то преимущество, что кооперативность легко распознается при рассмотрении констант ассоциации. Если все сайты связывания лигандов идентичны с микроскопической константой ассоциации , можно было бы ожидать (то есть ) при отсутствии сотрудничества. Мы имеем положительную кооперацию, если лежит выше этих ожидаемых значений для .
Уравнение Клотца (которое иногда также называют уравнением Адэра-Клотца) до сих пор часто используется в экспериментальной литературе для описания измерений связывания лигандов с точки зрения последовательных кажущихся констант связывания. [ 9 ]
Уравнение Полинга
[ редактировать ]К середине 20-го века возрос интерес к моделям, которые не только феноменологически описывали кривые связывания, но и предлагали основной биохимический механизм. Лайнус Полинг переосмыслил уравнение Адэра, предположив, что его константы представляют собой комбинацию констант связывания лиганда ( в уравнении ниже) и энергии, поступающей от взаимодействия между субъединицами кооперативного белка ( ниже). [ 10 ] Полинг фактически вывел несколько уравнений в зависимости от степени взаимодействия между субъединицами. Основываясь на неверных предположениях о локализации гемов, он выбрал неверный вариант для описания связывания кислорода гемоглобином, полагая, что субъединицы расположены в квадрате. Приведенное ниже уравнение дает уравнение тетраэдрической структуры, которое было бы более точным в случае гемоглобина:
Модель КНФ
[ редактировать ]Основываясь на результатах, показывающих, что структура кооперативных белков изменяется при связывании с их лигандом, Дэниел Кошланд и его коллеги [ 11 ] уточнили биохимическое объяснение механизма, описанного Полингом. [ 10 ] Модель Кошланда-Немети-Филмера (KNF) предполагает, что каждая субъединица может существовать в одной из двух конформаций: активной или неактивной. Связывание лиганда с одной субъединицей может вызвать немедленное конформационное изменение этой субъединицы из неактивной в активную конформацию - механизм, описанный как «индуцированное соответствие». [ 12 ] Кооперативность, согласно модели KNF, возникает в результате взаимодействий между субъединицами, сила которых варьируется в зависимости от относительных конформаций участвующих субъединиц. Для тетраэдрической структуры (рассматривались также линейные и квадратные структуры) они предложили следующую формулу:
Где – константа ассоциации для X, - соотношение состояний B и A в отсутствие лиганда («переход»), и — относительная стабильность пар соседних субъединиц относительно пары, где обе субъединицы находятся в состоянии A (обратите внимание, что в статье KNF фактически представлены , количество занятых сайтов, которое здесь в 4 раза ).
Модель MWC
[ редактировать ]

Модель Моно-Ваймана-Чанже (MWC) для согласованных аллостерических переходов. [ 13 ] пошел еще дальше, исследуя кооперативность, основанную на термодинамике и трехмерных конформациях. Первоначально он был сформулирован для олигомерных белков с симметрично расположенными идентичными субъединицами, каждая из которых имеет один сайт связывания лиганда. Согласно этой теории, два (или более) взаимопревращаемых конформационных состояния аллостерического белка сосуществуют в тепловом равновесии. Состояния, часто называемые напряженным (T) и расслабленным (R), различаются по сродству к молекуле лиганда. Соотношение между двумя состояниями регулируется связыванием молекул-лигандов, что стабилизирует состояние с более высоким сродством. Важно отметить, что все субъединицы молекулы меняют состояния одновременно — явление, известное как «согласованный переход».
Константа аллостерической изомеризации L описывает равновесие между обоими состояниями, когда ни одна молекула лиганда не связана: . Если L очень велико, большая часть белка существует в Т-состоянии в отсутствие лиганда. Если L мало (близко к единице), состояние R почти так же населено, как и состояние T. Отношение констант диссоциации лиганда из состояний T и R описывается константой c : . Если состояния R и T имеют одинаковое сродство к лиганду, и лиганд не влияет на изомеризацию. Значение c также указывает на то, насколько изменяется равновесие между состояниями T и R при связывании лиганда: чем меньше c , тем больше равновесие смещается в сторону состояния R после одного связывания. С , дробная занятость описывается как:
Затем сигмовидный график Хилла аллостерических белков можно проанализировать как прогрессивный переход из состояния T (низкое сродство) в состояние R (высокое сродство) по мере увеличения насыщения. Наклон графика Хилла также зависит от насыщенности и имеет максимальное значение в точке перегиба. Точки пересечения между двумя асимптотами и осью y позволяют определить сродство обоих состояний к лиганду.

В белках конформационные изменения часто связаны с активностью или активностью по отношению к конкретным мишеням. Такая активность часто является физиологически значимой или измеряемой экспериментально. Степень конформационного изменения описывается функцией состояния , который обозначает долю белка, присутствующую в состояние. Как показывает энергетическая диаграмма, увеличивается по мере связывания большего количества молекул лиганда. Выражение для является:
Важнейшим аспектом модели MWC является то, что кривые и не совпадают, [ 14 ] т.е. фракционное насыщение не является прямым показателем конформационного состояния (и, следовательно, активности). При этом степень кооперативности связывания и кооперативности активации может сильно различаться: крайний случай обеспечивается мотором жгутиков бактерий с коэффициентом Хилла 1,7 для связывания и 10,3 для активации. [ 15 ] [ 16 ] Сверхлинейность ответа иногда называют сверхчувствительностью .
Если аллостерический белок связывается с мишенью, которая также имеет более высокое сродство к состоянию R, то связывание с мишенью дополнительно стабилизирует состояние R, следовательно, увеличивая аффинность лиганда. Если, с другой стороны, мишень преимущественно связывается с состоянием Т, то связывание с мишенью будет оказывать негативное влияние на аффинность лиганда. Такие мишени называются аллостерическими модуляторами .
С момента своего создания структура MWC была расширена и обобщена. Были предложены вариации, например, для белков с более чем двумя состояниями. [ 17 ] белки, которые связываются с несколькими типами лигандов [ 18 ] [ 19 ] или несколько типов аллостерических модуляторов [ 19 ] и белки с неидентичными субъединицами или сайтами связывания лигандов. [ 20 ]
Примеры
[ редактировать ]Список молекулярных ансамблей, демонстрирующих кооперативное связывание лигандов, очень велик, но некоторые примеры особенно примечательны своим историческим интересом, необычными свойствами или физиологическим значением.
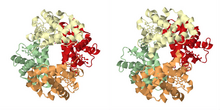
Как описано в историческом разделе, наиболее известным примером кооперативного связывания является гемоглобин . Его четверичная структура, раскрытая Максом Перуцем с помощью дифракции рентгеновских лучей, [ 21 ] имеет псевдосимметричный тетраэдр, несущий четыре места связывания (гема) кислорода. Многие другие молекулярные сборки, демонстрирующие кооперативное связывание, были изучены очень подробно.
Мультимерные ферменты
[ редактировать ]Активность многих ферментов регулируется . аллостерическими эффекторами Некоторые из этих ферментов являются мультимерными и несут несколько сайтов связывания регуляторов.
Треониндезаминаза была одним из первых ферментов, которые, как предполагалось, вели себя подобно гемоглобину. [ 22 ] и показано, что они кооперативно связывают лиганды. [ 23 ] Позже было показано, что это тетрамерный белок. [ 24 ]
Еще одним ферментом, который, как предполагалось ранее, совместно связывает лиганды, является аспартат-транс-карбамилаза . [ 25 ] Хотя первоначальные модели соответствовали четырем сайтам связывания, [ 26 ] и его коллеги показали, что его структура гексамерная Позже Уильям Липскомб . [ 27 ]
Ионные каналы
[ редактировать ]Большинство ионных каналов состоят из нескольких одинаковых или псевдоидентичных мономеров или доменов, расположенных симметрично в биологических мембранах. Несколько классов таких каналов, открытие которых регулируется лигандами, демонстрируют кооперативное связывание этих лигандов.
Было предложено еще в 1967 г. [ 28 ] (когда точная природа этих каналов была еще неизвестна), что никотиновые рецепторы ацетилхолина связывали ацетилхолин кооперативно из-за существования нескольких сайтов связывания. Очистка рецептора [ 29 ] и его характеристика продемонстрировала пентамерную структуру с сайтами связывания, расположенными на границах между субъединицами, что подтверждается структурой домена связывания рецептора. [ 30 ]
Рецепторы инозитолтрифосфата (IP3) образуют другой класс лиганд-управляемых ионных каналов, демонстрирующих кооперативное связывание. [ 31 ] В структуре этих рецепторов присутствуют четыре симметрично расположенных сайта связывания IP3. [ 32 ]
Многосайтовые молекулы
[ редактировать ]Хотя большинство белков, демонстрирующих кооперативное связывание, представляют собой мультимерные комплексы гомологичных субъединиц, некоторые белки несут несколько сайтов связывания одного и того же лиганда на одном и том же полипептиде. Одним из таких примеров является кальмодулин . Одна молекула кальмодулина кооперативно связывает четыре иона кальция. [ 33 ] В его структуре представлены четыре домена EF-hand , [ 34 ] каждый из них связывает один ион кальция. Молекула не имеет квадратной или тетраэдрической структуры, а состоит из двух долей, каждая из которых несет два домена EF-hand.
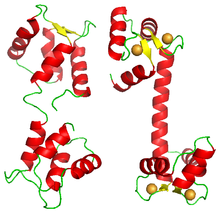
Транскрипционные факторы
[ редактировать ]Также было показано кооперативное связывание белков с нуклеиновыми кислотами. Классическим примером является связывание репрессора фага лямбда с его операторами, которое происходит кооперативно. [ 35 ] [ 36 ] Другие примеры факторов транскрипции демонстрируют положительную кооперативность при связывании со своей мишенью, например репрессор насосов TtgABC. [ 37 ] (n=1,6), а также условную кооперативность, проявляемую факторами транскрипции HOXA11 и FOXO1 . [ 38 ]
И наоборот, были также задокументированы примеры негативной кооперативности связывания факторов транскрипции, как и в случае гомодимерного репрессора Pseudomonas putida. оперона цитохрома P450cam гидроксилазы [ 39 ] (п=0,56).
Конформационное распространение и кооперативность связывания
[ редактировать ]Ранее утверждалось, что некоторые белки, особенно те, которые состоят из множества субъединиц, могут регулироваться с помощью обобщенного механизма MWC, при котором переход между состояниями R и T не обязательно синхронизирован по всему белку. [ 40 ] В 1969 году Вайман [ 41 ] предложил такую модель со «смешанными конформациями» (т.е. некоторые протомеры в состоянии R, некоторые в состоянии T) для дыхательных белков у беспозвоночных.
Следуя аналогичной идее, модель конформационного распространения Дьюка и его коллег [ 42 ] рассматривает как модель KNF, так и модель MWC как особые случаи. В этой модели субъединица не меняет конформацию автоматически при связывании лиганда (как в модели KNF), а также не все субъединицы в комплексе меняют конформацию вместе (как в модели MWC). Конформационные изменения носят стохастический характер, причем вероятность переключения состояний субъединицы зависит от того, связана ли она с лигандом, а также от конформационного состояния соседних субъединиц. Таким образом, конформационные состояния могут «распространиться» по всему комплексу.
Влияние вышестоящих и последующих компонентов на сверхчувствительность модуля
[ редактировать ]В живой клетке сверхчувствительные модули встроены в более крупную сеть с восходящими и нисходящими компонентами. Эти компоненты могут ограничивать диапазон входных данных, которые модуль будет получать, а также диапазон выходных сигналов модуля, которые сеть сможет обнаружить. [ 43 ] Эти ограничения влияют на чувствительность модульной системы. Ограничения динамического диапазона, налагаемые последующими компонентами, могут обеспечить эффективную чувствительность, намного большую, чем у исходного модуля, если рассматривать его изолированно.
Ссылки
[ редактировать ]![]() Эта статья была адаптирована из следующего источника под лицензией CC BY 4.0 ( 2013 г. ) ( отчеты рецензента ):
Мелани и Стефан; Николя Ле Новер (2013). «Кооперативная вязка» . PLOS Вычислительная биология . 9 (6): e1003106. doi : 10.1371/JOURNAL.PCBI.1003106 . ISSN 1553-734X . ПМЦ 3699289 . ПМИД 23843752 . Викиданные Q21045427 .
Эта статья была адаптирована из следующего источника под лицензией CC BY 4.0 ( 2013 г. ) ( отчеты рецензента ):
Мелани и Стефан; Николя Ле Новер (2013). «Кооперативная вязка» . PLOS Вычислительная биология . 9 (6): e1003106. doi : 10.1371/JOURNAL.PCBI.1003106 . ISSN 1553-734X . ПМЦ 3699289 . ПМИД 23843752 . Викиданные Q21045427 .
- ^ Бор С (1904). «Поглощение кислорода настоящим пигментом крови и гемоглобином, вырабатываемым из крови» . Центральный лист физиол. (на немецком языке). 23 :688-690.
- ^ Перейти обратно: а б Бор С., Хассельбальх К. , Крог А. (1904). «О биологически важном влиянии напряжения углекислого газа крови на связывание ею кислорода» . Скандинавские архивы физиологии . 16 (2): 402–412. дои : 10.1111/j.1748-1716.1904.tb01382.x .
- ^ Вайман Дж., Гилл С.Дж. (1990). Привязка и связь. Функциональная химия биологических молекул . Милл-Вэлли: Университетские научные книги.
- ^ Хилл А.В. (1910). «Возможное влияние агрегации молекул гемоглобина на кривые его диссоциации». Дж Физиол . 40 : iv–vii.
- ^ Адэр Г.С. (1925). « Система гемоглобина. IV. Кривая диссоциации кислорода гемоглобина» . J Биол Хим . 63 (2): 529–545. дои : 10.1016/S0021-9258(18)85018-9 .
- ^ Абелиович Х (июль 2005 г.). «Эмпирический принцип экстремума для коэффициента Хилла во взаимодействиях лиганд-белок, показывающий отрицательную кооперативность» . Биофизический журнал . 89 (1): 76–9. Бибкод : 2005BpJ....89...76A . doi : 10.1529/biophysj.105.060194 . ПМК 1366580 . ПМИД 15834004 .
- ^ Клоц И.М. (январь 1946 г.). «Применение закона действия масс к связыванию белками; взаимодействие с кальцием». Архив биохимии . 9 : 109–17. ПМИД 21009581 .
- ^ Клоц И.М. (январь 2004 г.). «Лиганд-рецепторные комплексы: возникновение и развитие понятия» . Журнал биологической химии . 279 (1): 1–12. дои : 10.1074/jbc.X300006200 . ПМИД 14604979 .
- ^ Дагер Р., Пэн С., Джорджия С., Фев М., Зениу М., Циммерманн М., Пиго С., Хайек Дж., Килхоффер М.С. (май 2011 г.). «Общая стратегия характеристики комплексов кальмодулин-кальций, участвующих в распознавании CaM-мишени: домены, связывающие кальмодулин DAPK и EGFR, взаимодействуют с различными комплексами кальмодулин-кальций» . Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1813 (5): 1059–67. дои : 10.1016/j.bbamcr.2010.11.004 . ПМИД 21115073 .
- ^ Перейти обратно: а б Полинг Л. (апрель 1935 г.). «Кислородное равновесие гемоглобина и его структурная интерпретация» . Труды Национальной академии наук Соединенных Штатов Америки . 21 (4): 186–91. Бибкод : 1935ПНАС...21..186П . дои : 10.1073/pnas.21.4.186 . ПМЦ 1076562 . ПМИД 16587956 .
- ^ Кошланд Д.Е., Немети Дж., Филмер Д. (январь 1966 г.). «Сравнение экспериментальных данных связывания и теоретических моделей в белках, содержащих субъединицы». Биохимия . 5 (1): 365–85. дои : 10.1021/bi00865a047 . ПМИД 5938952 .
- ^ Кошланд Д.Э. (февраль 1958 г.). «Применение теории специфичности ферментов к синтезу белка» . Труды Национальной академии наук Соединенных Штатов Америки . 44 (2): 98–104. Бибкод : 1958ПНАС...44...98К . дои : 10.1073/pnas.44.2.98 . ПМЦ 335371 . ПМИД 16590179 .
- ^ Моно Дж., Вайман Дж., Чанже Дж. П. (май 1965 г.). «О природе аллостерических переходов: правдоподобная модель». Журнал молекулярной биологии . 12 : 88–118. дои : 10.1016/S0022-2836(65)80285-6 . ПМИД 14343300 .
- ^ Рубин М.М., Changeux JP (ноябрь 1966 г.). «О природе аллостерических переходов: последствия неэксклюзивного связывания лигандов». Журнал молекулярной биологии . 21 (2): 265–74. дои : 10.1016/0022-2836(66)90097-0 . ПМИД 5972463 .
- ^ Клюзель П., Сюретт М., Лейблер С. (март 2000 г.). «Сверхчувствительный бактериальный мотор, выявленный путем мониторинга сигнальных белков в отдельных клетках». Наука . 287 (5458): 1652–5. Бибкод : 2000Sci...287.1652C . дои : 10.1126/science.287.5458.1652 . ПМИД 10698740 .
- ^ Сурджик В., Берг Х.К. (октябрь 2002 г.). «Связывание регулятора ответа CheY Escherichia coli с его мишенью, измеренное in vivo с помощью резонансного переноса энергии флуоресценции» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (20): 12669–74. Бибкод : 2002PNAS...9912669S . дои : 10.1073/pnas.192463199 . ПМК 130518 . ПМИД 12232047 .
- ^ Эдельштейн С.Дж., Шаад О., Генри Э., Бертран Д., Шанге Дж.П. (ноябрь 1996 г.). «Кинетический механизм никотиновых рецепторов ацетилхолина, основанный на множественных аллостерических переходах». Биологическая кибернетика . 75 (5): 361–79. CiteSeerX 10.1.1.17.3066 . дои : 10.1007/s004220050302 . ПМИД 8983160 . S2CID 6240168 .
- ^ Мелло Б.А., Ту Ю (ноябрь 2005 г.). «Аллостерическая модель гетерогенных рецепторных комплексов: понимание реакций бактериального хемотаксиса на множественные стимулы» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (48): 17354–9. Бибкод : 2005PNAS..10217354M . дои : 10.1073/pnas.0506961102 . ПМЦ 1297673 . ПМИД 16293695 .
- ^ Перейти обратно: а б Наджди Т.С., Ян Ч.Р., Шапиро Б.Е., Хэтфилд Г.В., Мьёлснесс Э.Д. (апрель 2006 г.). «Применение обобщенной модели MWC для математического моделирования метаболических путей, регулируемых аллостерическими ферментами». Журнал биоинформатики и вычислительной биологии . 4 (2): 335–55. CiteSeerX 10.1.1.121.9382 . дои : 10.1142/S0219720006001862 . ПМИД 16819787 .
- ^ Стефан М.И., Эдельштейн С.Дж., Ле Новер Н. (июль 2009 г.). «Вычисление феноменологических констант Адэра-Клотца по микроскопическим параметрам MWC» . Системная биология BMC . 3:68 . дои : 10.1186/1752-0509-3-68 . ПМЦ 2732593 . ПМИД 19602261 .
- ^ Перуц М.Ф., Россманн М.Г., Каллис А.Ф., Мюрхед Х., Уилл Дж., North AC (февраль 1960 г.). «Структура гемоглобина: трехмерный синтез Фурье с разрешением 5,5 А, полученный с помощью рентгеновского анализа». Природа . 185 (4711): 416–22. Бибкод : 1960Natur.185..416P . дои : 10.1038/185416a0 . ПМИД 18990801 . S2CID 4208282 .
- ^ Чангукс Дж. П. (1961). «Механизмы контроля биосинтетической L-треониндезаминазы по принципу обратной связи с помощью L-изолейцина». Симпозиумы Колд-Спринг-Харбор по количественной биологии . 26 : 313–8. дои : 10.1101/SQB.1961.026.01.037 . ПМИД 13878122 .
- ^ Шанжё, Ж.-П. (1963). « Аллостерические взаимодействия с биосинтетической L-треониндезаминазой из E. coli K12». Холодный источник Harb Symp Quant Biol . 28 : 497–504. дои : 10.1101/sqb.1963.028.01.066 .
- ^ Галлахер Д.Т., Гиллиланд Г.Л., Сяо Г., Зондло Дж., Фишер К.Е., Шиншилла Д., Эйзенштейн Э. (апрель 1998 г.). «Структура и контроль пиридоксальфосфат-зависимой аллостерической треониндезаминазы» . Структура . 6 (4): 465–75. дои : 10.1016/s0969-2126(98)00048-3 . ПМИД 9562556 .
- ^ Герхарт Дж. К., Парди AB (март 1962 г.). «Энзимология контроля посредством торможения по обратной связи» . Журнал биологической химии . 237 (3): 891–6. дои : 10.1016/S0021-9258(18)60389-8 . ПМИД 13897943 .
- ^ Changeux JP, Рубин М.М. (февраль 1968 г.). «Аллостерические взаимодействия в аспартат-транскарбамилазе. 3. Интерпретация экспериментальных данных с точки зрения модели Моно, Ваймана и Чанже». Биохимия . 7 (2): 553–61. дои : 10.1021/bi00842a601 . ПМИД 4868541 .
- ^ Хонзатко Р.Б., Кроуфорд Дж.Л., Монако Х.Л., Ладнер Дж.Э., Эвардс Б.Ф., Эванс Д.Р., Уоррен С.Г., Уайли Д.К., Ладнер Р.К., Липскомб В.Н. (сентябрь 1982 г.). «Кристаллические и молекулярные структуры нативной и CTP-лигандированной аспартаткарбамоилтрансферазы из Escherichia coli». Журнал молекулярной биологии . 160 (2): 219–63. дои : 10.1016/0022-2836(82)90175-9 . ПМИД 6757446 .
- ^ Карлин А. (август 1967 г.). «О применении «правдоподобной модели» аллостерических белков к рецептору ацетилхолина». Журнал теоретической биологии . 16 (2): 306–20. Бибкод : 1967JThBi..16..306K . дои : 10.1016/0022-5193(67)90011-2 . ПМИД 6048545 .
- ^ Чангукс Дж.П., Касаи М., Ли С.И. (ноябрь 1970 г.). «Использование токсина змеиного яда для характеристики белка холинергического рецептора» . Труды Национальной академии наук Соединенных Штатов Америки . 67 (3): 1241–7. Бибкод : 1970PNAS...67.1241C . дои : 10.1073/pnas.67.3.1241 . ПМЦ 283343 . ПМИД 5274453 .
- ^ Брейц К., ван Дейк В.Дж., Клаассен Р.В., Шуурманс М., ван дер Ост Дж., Смит А.Б., Сиксма Т.К. (май 2001 г.). «Кристаллическая структура ACh-связывающего белка обнаруживает лиганд-связывающий домен никотиновых рецепторов». Природа . 411 (6835): 269–76. Бибкод : 2001Natur.411..269B . дои : 10.1038/35077011 . ПМИД 11357122 . S2CID 4415937 .
- ^ Мейер Т., Холовка Д., Страйер Л. (апрель 1988 г.). «Высококооперативное открытие кальциевых каналов инозитол-1,4,5-трифосфатом». Наука . 240 (4852): 653–6. Бибкод : 1988Sci...240..653M . дои : 10.1126/science.2452482 . ПМИД 2452482 .
- ^ Сео МД, Веламаканни С., Исияма Н., Статопулос П.Б., Росси А.М., Хан С.А., Дейл П., Ли С., Эймс Дж.Б., Икура М., Тейлор К.В. (январь 2012 г.). «Структурная и функциональная консервативность ключевых доменов InsP3 и рианодиновых рецепторов» . Природа . 483 (7387): 108–12. Бибкод : 2012Natur.483..108S . дои : 10.1038/nature10751 . ПМЦ 3378505 . ПМИД 22286060 .
- ^ Тео Т.С., Ван Дж.Х. (сентябрь 1973 г.). «Механизм активации циклической аденозин-3':5'-монофосфатфосфодиэстеразы из бычьего сердца ионами кальция. Идентификация белка-активатора как Ca2+-связывающего белка» . Журнал биологической химии . 248 (17): 5950–5. дои : 10.1016/S0021-9258(19)43493-5 . ПМИД 4353626 .
- ^ Бабу Ю.С., Сак Дж.С., Гринхау Т.Дж., Багг К.Э., Минс А.Р., Кук У.Дж. (1985). «Трехмерная структура кальмодулина». Природа . 315 (6014): 37–40. Бибкод : 1985Natur.315...37B . дои : 10.1038/315037a0 . ПМИД 3990807 . S2CID 4316112 .
- ^ Пташне М., Джеффри А., Джонсон А.Д., Маурер Р., Мейер Б.Дж., Пабо К.О., Робертс Т.М., Зауэр Р.Т. (январь 1980 г.). «Как работают лямбда-репрессор и кро». Клетка . 19 (1): 1–11. дои : 10.1016/0092-8674(80)90383-9 . ПМИД 6444544 . S2CID 54281357 .
- ^ Акерс Г.К., Джонсон А.Д., Ши М.А. (февраль 1982 г.). «Количественная модель регуляции генов с помощью репрессора фага лямбда» . Труды Национальной академии наук Соединенных Штатов Америки . 79 (4): 1129–33. Бибкод : 1982PNAS...79.1129A . дои : 10.1073/pnas.79.4.1129 . ПМЦ 345914 . ПМИД 6461856 .
- ^ Крелл Т., Теран В., Майорга О.Л., Ривас Г., Хименес М., Дэниелс К., Молина-Энарес А.Дж., Мартинес-Буэно М., Гальегос М.Т., Рамос Х.Л. (июнь 2007 г.). «Оптимизация палиндромного порядка оператора TtgR повышает кооперативность связывания». Журнал молекулярной биологии . 369 (5): 1188–99. дои : 10.1016/j.jmb.2007.04.025 . ПМИД 17498746 .
- ^ Ннамани, Маурис К.; и др. (2016). «Производный аллостерический переключатель лежит в основе эволюции условного сотрудничества между HOXA11 и FOXO1» . Отчеты по ячейкам . 15 (10): P2097–2108. дои : 10.1016/j.celrep.2016.04.088 . hdl : 2437/230273 . ПМИД 27239043 .
- ^ Арамаки Х., Кабата Х., Такеда С., Ито Х., Накаяма Х., Симамото Н. (декабрь 2011 г.). «Формирование тройного комплекса репрессор-индуктор-оператор: негативная кооперативность связывания d-камфоры с CamR» . Гены в клетки . 16 (12): 1200–7. дои : 10.1111/j.1365-2443.2011.01563.x . ПМИД 22093184 . S2CID 29006987 .
- ^ Чанжу Дж.П., Тьери Дж., Тунг И., Киттель С. (февраль 1967 г.). «О кооперативности биологических мембран» . Труды Национальной академии наук Соединенных Штатов Америки . 57 (2): 335–41. Бибкод : 1967PNAS...57..335C . дои : 10.1073/pnas.57.2.335 . ПМК 335510 . ПМИД 16591474 .
- ^ Вайман Дж. (февраль 1969 г.). «Возможные аллостерические эффекты в расширенных биологических системах». Журнал молекулярной биологии . 39 (3): 523–38. дои : 10.1016/0022-2836(69)90142-9 . ПМИД 5357210 .
- ^ Дюк Т.А., Ле Новер Н., Брэй Д. (май 2001 г.). «Конформационное распространение в кольце белков: стохастический подход к аллостерии». Журнал молекулярной биологии . 308 (3): 541–53. дои : 10.1006/jmbi.2001.4610 . ПМИД 11327786 . S2CID 14914075 .
- ^ Альтшилер Э., Вентура А., Колман-Лернер А., Черноморец А. (октябрь 2014 г.). «Влияние ограничений восходящего и нисходящего потока на сверхчувствительность модуля сигнализации» . Физическая биология . 11 (6): 066003. Бибкод : 2014PhBio..11f6003A . дои : 10.1088/1478-3975/11/6/066003 . ПМЦ 4233326 . ПМИД 25313165 .

![{\displaystyle {\bar {Y}}={\frac {[{\text{связанные сайты}}]}{[{\text{связанные сайты}}]+[{\text{несвязанные сайты}}]}} ={\frac {[{\text{связанные сайты}}]}{[{\text{всего сайтов}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7241873ab8d35ae0d3186bf28c116499d1c04743)


![{\displaystyle {\bar {Y}}={\frac {K\cdot {}[X]^{n}}{1+K\cdot {}[X]^{n}}}={\frac { [X]^{n}}{K^{*}+[X]^{n}}}={\frac {[X]^{n}}{K_{d}^{n}+[X] ^{n}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/259b162145477b5571237fa9df66e01eb633deba)

![{\displaystyle [X]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fadb3aef0836cb1d004479f470703a45972bf8fe)






![{\displaystyle \log {\frac {\bar {Y}}{1-{\bar {Y}}}}=n\cdot {}\log[X]-n\cdot {}\log K_{d} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7796d554a401093849207c9722c6dd906299d19d)

![{\displaystyle \log[X]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7d0651f75bd3a81762c0c323d16599dcbeff818)



![{\displaystyle {\bar {Y}}={\frac {1}{4}}\cdot {}{\frac {K_{I}[X]+2K_{II}[X]^{2}+3K_{III}[X]^{3}+4K_{IV}[X]^{4}}{1+K_{ I}[X]+K_{II}[X]^{2}+K_{III}[X]^{3}+K_{IV}[X]^{4}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5f33e36f6b4f2c6bcfd2a55572f7192007edcf11)
![{\displaystyle {\bar {Y}}={\frac {1}{n}}{\frac {K_{I}[X]+2K_{II}[X]^{2}+\ldots +nK_{ n}[X]^{n}}{1+K_{I}[X]+K_{II}[X]^{2}+\ldots +K_{n}[X]^{n}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/df233dd3c2b28da151a973fae2458328f78533b1)


![{\displaystyle {\bar {Y}}={\frac {1}{n}}{\frac {K_{1}[X]+2K_{1}K_{2}[X]^{2}+\ ldots +n\left(K_{1}K_{2}\ldots K_{n}\right)[X]^{n}}{1+K_{1}[X]+K_{1}K_{2}[X]^{2}+\ldots +\left(K_{ 1}K_{2}\ldots K_{n}\right)[X]^{n}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eabac2f1e5e02dc7cc0fa052de3a3a3debe5ad63)




![{\displaystyle {\bar {Y}}={\frac {K[X]+3\alpha {}K^{2}[X]^{2}+3\alpha {}^{3}K^{ 3}[X]^{3}+\alpha {}^{6}K^{4}[X]^{4}}{1+4K[X]+6\alpha {}K^{2}[X]^{2}+4\alpha {}^{3}K^{3}[X]^{3}+\alpha {}^{6}K^{4} [X]^{4}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/41123dda939caf1e3a4d63450b3c9246cd2478ea)
![{\displaystyle {\bar {Y}}={\frac {K_{AB}^{3}(K_{X}K_{t}[X])+3K_{AB}^{4}K_{BB}(K_{X}K_{t}[X])^{ 2}+3К_{ AB}^{3}K_{BB}^{3}(K_{X}K_{t}[X])^{3}+K_{BB}^{6}(K_{X}K_{t}[ Х])^{4}}{1 +4K_{AB}^{3}(K_{X}K_{t}[X])+6K_{AB}^{4}K_{BB}(K_{X}K_{t}[X])^{ 2}+4К_{ AB}^{3}K_{BB}^{3}(K_{X}K_{t}[X])^{3}+K_{BB}^{6}(K_{X}K_{t}[ Х])^{4}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c1786d8d1491557357d84e2c76453a89b033bb4a)





![{\displaystyle L={\frac {\left[T_{0}\right]}{\left[R_{0}\right]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6a9d52d516ad5f2ff22a5fd07444b4303a6ddb29)


![{\displaystyle \alpha ={\frac {[X]}{K_{d}^{R}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e8c38e888f45f23bd602e20d2bcb9522c07d21df)



