Нитрат щелочного металла

Нитраты щелочных металлов — химические соединения, состоящие из щелочного металла ( лития , натрия , калия , рубидия и цезия ) и нитрат- иона. Лишь два из них имеют большую коммерческую ценность: натриевая и калиевая соли. [ 1 ] Это белые водорастворимые соли с температурой плавления от 255 °C ( LiNO
3 ) до 414 °С ( CsNO
3 ) на относительно узком интервале 159 °С. [ 2 ]
| Сложный | Химическая формула | Молярная масса | Точка плавления | Точка разложения (°C) [ 3 ] | Структура |
|---|---|---|---|---|---|
| Нитрат лития | ЛиНО 3 | 68.946 g/mol | 255 ° С (491 ° F; 528 К) | 474 | 
|
| Нитрат натрия | NaNONaNO3 | 84.9947 g/mol | 308 ° С (586 ° F; 581 ° К) | 525 | 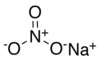
|
| Калийная селитра | KNOКНО3 | 101.1032 g/mol | 334 ° С (633 ° F, 607 К) | 533 | 
|
| Нитрат рубидия | RbNORbNO3 | 147.473 g/mol | 310 ° С (590 ° F; 583 К) | 548 | 
|
| Нитрат цезия | CsNO 3 | 194.91 g/mol | 414 ° С (777 ° F, 687 К) | 584 | 
|
Температура плавления нитратов щелочных металлов имеет тенденцию увеличиваться с 255 ° C до 414 ° C (при этом аномалия для рубидия не выровнена должным образом в ряду) по мере атомной массы и ионного радиуса (голого катиона ) щелочного металла увеличения . , спускаясь в колонну. Аналогично, но не представлено здесь в таблице, растворимость этих солей в воде также уменьшается с увеличением атомной массы металла.
Приложения
[ редактировать ]Нитраты натрия и калия обычно используются в качестве удобрений . Являясь также сильными окислителями , они входят в состав пиротехнических составов и при производстве взрывчатых веществ . [ 1 ]
эвтектические смеси применяют В качестве расплавленных солей нитратов щелочных металлов . Например, смесь NaNO 2 : NaNO 3 :KNO 3 в соотношении 40:7:53 плавится при 142 °С и стабильна примерно до 600 °С. [ 4 ]
Второстепенное использование - для окраски света, излучаемого фейерверками : [ 5 ]
- нитрат лития дает красный цвет,
- нитрат натрия дает желто-оранжевый цвет,
- нитрат калия и нитрат рубидия дают фиолетовые цвета,
- Нитрат цезия придает цвет индиго.
В общем, излучаемый цвет постепенно меняется от к фиолетовому в видимом спектре света при опускании в столбец щелочных металлов в периодической таблице Менделеева красного . Это соответствует уменьшению длины волны света, излучаемого на этапе девозбуждения электронов в атомах, нагретых до высокой температуры. Фотоны, испускаемые цезием, более энергичны, чем фотоны лития .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Лауэ, Вольфганг; Тиман, Майкл; Шайблер, Эрих; Виганд, Карл (2000). «Нитраты и нитриты». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a17_265 . ISBN 978-3527306732 .
- ^ «Термодинамические свойства расплавленных нитратных солей» (PDF) .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 469. ИСБН 978-0-08-037941-8 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 90. ИСБН 978-0-08-037941-8 .
- ^ «Фантомный фейерверк: Университет фейерверков: Пиротехнические соединения» . Фантомный фейерверк . Архивировано из оригинала 06 августа 2020 г. Проверено 16 октября 2016 г.