Избиение промоутера
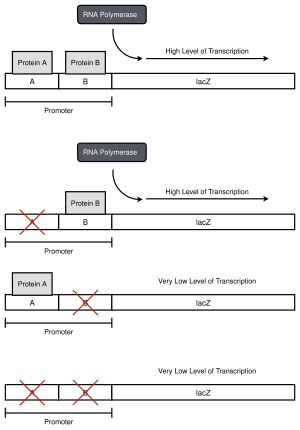
В лабораторных условиях может быть неизвестно, что промотор состоит из двух областей: вдоль промотора можно произвести отдельные мутации, секвенировать промотор и уровни репортера, проанализировать чтобы найти границы для каждого региона.
Избиение промотора — это метод, используемый в молекулярной биологии для определения того, как определенные области цепи ДНК , обычно промоторы , влияют на транскрипцию нижестоящих генов. В нормальных условиях белки связываются с промотором и активируют или подавляют транскрипцию. разрушения промотора В анализе специфические точечные мутации или делеции в определенных областях промотора производятся , а затем измеряется транскрипция гена. Вклад участка промотора можно наблюдать по уровню транскрипции. Если мутация или делеция изменяет уровень транскрипции, то известно, что эта область промотора может быть сайтом связывания или другим регуляторным элементом. [1] [2] [3]
Избиение промотора часто осуществляется с помощью делеций на 5'- или 3'- конце цепи ДНК; этот анализ легче выполнить на основе повторного рестрикционного расщепления и очистки геля фрагментов определенных размеров. Часто проще всего связать промотор с репортером, создать большое количество репортерной конструкции с помощью ПЦР или роста бактерий, а затем выполнить серийные рестрикционные расщепления этого образца. Способность вышестоящих промоторов можно легко оценить, удалив сегменты с 5'-конца и то же самое с 3'-конца цепи для нижестоящих промоторов. [4]
Поскольку промотор обычно содержит связывающие последовательности для белков, влияющих на транскрипцию, эти белки также необходимы при тестировании эффектов промотора. Белки, которые связываются с промотором, можно идентифицировать с помощью анализа изменения электрофоретической подвижности (EMSA), и в этом анализе можно оценить эффекты включения или исключения белков с мутагенизированными промоторами. Это позволяет использовать удар по промотору, чтобы не только обнаружить место на цепи ДНК, которое влияет на транскрипцию, но также и белки, которые влияют на эту цепь. Таким способом также можно анализировать эффекты взаимодействия белков друг с другом, а также с сайтами связывания; Белки-кандидаты вместо этого должны быть идентифицированы с помощью анализов взаимодействия белок/белок вместо EMSA. [5]
Процедура
[ редактировать ]Это пример процедуры анализа разрушения промотора, адаптированный из Boulin et al. : [6]
- Клонируйте участок ДНК, который, как предполагается, действует как промотор. Клонирование необходимо для анализа, поскольку оно гарантирует, что промотор является единственным фактором, влияющим на экспрессию. Этот этап часто включает извлечение ДНК из организма, в котором она находится, и ПЦР- амплификацию.
- Упорядочить регион. Секвенирование ДНК необходимо для выявления отличий мутировавших промоторов от промотора дикого типа и для корреляции этих различий с различиями в экспрессии генов. Кроме того, это помогает с дайджестом ограничений региона.
- Переварить соответствующими эндонуклеазами рестрикции. Эту область можно переварить для удаления элементов, которые, как считается, не являются частью промотора. Кроме того, для большинства промоторов репортерный ген должен быть вставлен на заданном расстоянии от промотора. В некоторых методах уничтожения промоторов для систематического удаления элементов промоторов используются множественные рестрикционные гидролизаты — этот метод гарантирует, что удаленные области промотора не способствуют экспрессии репортера .
- Мутагенизировать промотор. Мутация промотора необходима, если не используется метод удаления части промотора рестрикционным расщеплением. Можно создать множество мутированных цепей, секвенировать цепи и проанализировать активность промоторов. Это часто необходимо, поскольку нельзя гарантировать, что одна мутация инактивирует сайт связывания. Также можно использовать ненаправленный мутагенез на основе ПЦР; параметры мутагенной ПЦР-реакции можно регулировать для введения разумного количества мутаций. Однако случайный характер ПЦР требует, чтобы после этого этапа анализировалось больше цепей.
- Лигировать с репортерным геном. Промоторы, подлежащие анализу, должны быть лигированы с репортерным геном , чтобы можно было измерить уровни экспрессии гена. Ген-репортер должен находиться на достаточном расстоянии от промотора, чтобы промотор воздействовал на него так же, как промотор дикого типа воздействовал бы на ген. Это можно проверить с помощью положительного контроля (полный промотор).
- Трансформируйте интересующие клетки с помощью различных конструкций «промотор:репортер». Конструкции промотора и репортера необходимо лигировать в плазмиду и трансформировать в клетки, в которых эта плазмида может быть экспрессирована для измерения активности каждой последовательности промотора. Белки, которые влияют на промотор, также должны быть добавлены к этим клеткам — часто эти белки помещаются в ту же или другую плазмиду под контролем конститутивно активного промотора.
- Измерьте скорость транскрипции репортерного гена. Генные продукты анализируются и измеряются скорости репортерной транскрипции.
На основе данных, полученных при анализе различных промоторов, можно установить эффекты различных частей промотора. Однако возможно, что данных будет недостаточно, и анализ придется повторить с другим регионом промотора и/или другими мутациями.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Камвисселис, М. (2003). Вычислительная молекулярная геномика: гены, регуляция, эволюция . (Докторская диссертация). Получено с http://web.mit.edu/manoli/www/thesis/Intro.html.
- ^ Чалфи, М., и Кейн, С. (2005) Методы биологического анализа, Зеленый флуоресцентный белок: свойства, применение и протоколы . Уайли.
- ^ Мацукура, С., Стеллато, К., Плитт, Дж. Р., Бикель, К., Миура, К., Георас, С. Н., Казоларо, В., Шлеймер, Р. П. (1999). «Активация транскрипции гена эотаксина с помощью NF-κB и STAT6 в эпителиальных клетках дыхательных путей человека». Дж Иммунол 163:6876-6883. ПМИД 10586089 .
- ^ Энгстрем, Э.М., Ижаки, А., Боуман, Дж.Л. (2004). «Избиение промоутеров, микроРНК и гены Knox. Новые идеи, регуляторы и цели регуляции в установлении полярности латеральных органов у Arabidopsis». Завод Физиол 135(2): 685-94. дои : 10.1104/стр.104.040394 . ПМИД 15208415 . ПМК 514105 .
- ^ Го, JY, Сюй, Дж., Мао, DQ, Фу, LL, Гу, JR, Чжу, JD (2002). «Анализ промотора человеческого гена C17orf25 , нового гена хромосомы 17p13.3». Клеточные исследования 12:339-352. дои : 10.1038/sj.cr.7290136 .
- ^ Булен, Т. и др. Слияния репортерных генов (5 апреля 2006 г.), WormBook , изд. Исследовательское сообщество C. elegans, WormBook, doi 10.1895/wormbook.1.106.1 , http://www.wormbook.org .