Репликация по катящемуся кругу
Эта статья нуждается в дополнительных цитатах для проверки . ( ноябрь 2017 г. ) |

по катящемуся кругу ( RCR ) – это процесс однонаправленной репликации нуклеиновой кислоты , который может быстро синтезировать множество копий кольцевых молекул ДНК или РНК , таких как плазмиды , геномы бактериофагов Репликация и кольцевой РНК геном вироидов . Некоторые эукариотические вирусы также реплицируют свою ДНК или РНК по механизму катящегося круга.
В качестве упрощенной версии естественной репликации по катящемуся кругу был разработан метод изотермической амплификации ДНК — амплификация по катящемуся кругу. Механизм RCA широко используется в молекулярной биологии и биомедицинских нанотехнологиях , особенно в области биосенсорства (как метод усиления сигнала). [1]
Круговая репликация ДНК
[ редактировать ]
по катящемуся кругу Репликация ДНК инициируется белком-инициатором, кодируемым ДНК плазмиды или бактериофага, который разрывает одну цепь двухцепочечной кольцевой молекулы ДНК в месте, называемом двухцепочечным началом или DSO. Белок-инициатор остается связанным с 5'-фосфатным концом разорванной цепи, а свободный 3'-гидроксильный конец высвобождается и служит праймером для синтеза ДНК ДНК-полимеразой III . Используя неповрежденную цепь в качестве матрицы, репликация происходит вокруг кольцевой молекулы ДНК, замещая разорванную цепь одноцепочечной ДНК. Замещение разорванной цепи осуществляется с помощью геликазы, кодируемой хозяином, называемой PcrA (аббревиатура, обозначающая уменьшенную копию плазмиды) в присутствии белка инициации репликации плазмиды.
Продолжение синтеза ДНК может привести к образованию множества одноцепочечных линейных копий исходной ДНК в непрерывной серии от головы к хвосту, называемой конкатемером . Эти линейные копии могут быть преобразованы в двухцепочечные кольцевые молекулы с помощью следующего процесса:
Сначала белок-инициатор делает еще один разрыв в ДНК, чтобы прекратить синтез первой (ведущей) цепи. РНК-полимераза и ДНК-полимераза III затем реплицируют ДНК одноцепочечного происхождения (SSO), образуя еще один двухцепочечный круг. ДНК-полимераза I удаляет праймер, заменяя его ДНК, а ДНК-лигаза соединяет концы, образуя еще одну молекулу двухцепочечной кольцевой ДНК.
Подводя итог, можно сказать, что типичная репликация катящегося круга ДНК состоит из пяти этапов: [2]
- Круговая дцДНК будет «разрезана».
- удлиняется 3'-конец с использованием «неразрезанной» ДНК в качестве ведущей цепи (матрицы); 5'-конец смещен.
- Смещенная ДНК представляет собой отстающую цепь, которая образуется двухцепочечной посредством ряда фрагментов Оказаки .
- Репликация как «неповрежденных», так и смещенных оцДНК.
- Смещенная ДНК циркулирует.
Вирусология
[ редактировать ]Репликация вирусной ДНК
[ редактировать ]Некоторые ДНК-вирусы реплицируют свою геномную информацию в клетках-хозяевах посредством репликации по катящемуся кругу. Например, вирус герпеса человека-6 (HHV-6)(hibv) экспрессирует набор «ранних генов», которые, как полагают, участвуют в этом процессе. [3] Получающиеся в результате длинные конкатемеры впоследствии расщепляются рибозимами между областями pac-1 и pac-2 генома HHV-6, когда он упаковывается в отдельные вирионы. [4]

Вирус папилломы человека-16 (ВПЧ-16) — еще один вирус, который использует скользящую репликацию для быстрого производства потомства. ВПЧ-16 инфицирует эпителиальные клетки человека и имеет двухцепочечный кольцевой геном. Во время репликации в начале гексамер Е1 оборачивается вокруг одноцепочечной ДНК и движется в направлении от 3’ к 5’. При нормальной двунаправленной репликации два репликационных белка диссоциируются во время столкновения, но считается, что при ВПЧ-16 гексамер E1 не диссоциирует, что приводит к непрерывной катящейся репликации. Считается, что этот механизм репликации ВПЧ может иметь физиологическое значение для интеграции вируса в хромосому хозяина и возможного развития рака шейки матки. [5]
Кроме того, геминивирус также использует репликацию по катящемуся кругу в качестве механизма репликации. Этот вирус ответственен за уничтожение многих основных сельскохозяйственных культур, таких как маниока, хлопок, бобовые, кукуруза, томаты и бамия. Вирус имеет кольцевую одноцепочечную ДНК, которая реплицируется в клетках растения-хозяина. Весь процесс инициируется белком-инициатором репликации геминивируса Rep, который также отвечает за изменение среды хозяина, действуя как часть механизма репликации. Rep также поразительно похож на большинство других белков-инициаторов вращающейся репликации эубактерий с наличием мотивов I, II и III на N-конце. Во время репликации по катящемуся кругу оцДНК геминивируса преобразуется в дцДНК, а Rep затем присоединяется к дцДНК в исходной последовательности TAATATTAC. После того, как Rep вместе с другими белками репликации связывается с дцДНК, он образует стволовую петлю, где ДНК затем расщепляется по последовательности наномера, вызывая смещение цепи. Это смещение позволяет репликационной вилке двигаться в направлении от 3’ к 5’, что в конечном итоге приводит к образованию новой цепи оцДНК и конкатамерной цепи ДНК. [6]
бактериофага Т4 Промежуточные продукты репликации ДНК включают кольцевые и разветвленные кольцевые конкатемерные структуры. [7] Эти структуры, вероятно, отражают механизм репликации по катящемуся кругу.
Репликация вирусной РНК
[ редактировать ]Некоторые РНК-вирусы и вироиды также реплицируют свой геном посредством репликации РНК по принципу катящегося круга. Для вироидов существует два альтернативных пути репликации РНК, которым следуют представители семейства Pospiviroidae (асимметричная репликация) и Avsunviroidae (симметричная репликация) соответственно.

В семействе Pospiviroidae (PSTVd-подобные) кольцевая плюс-цепь РНК транскрибируется РНК-полимеразой хозяина в олигомерные минус-цепи, а затем в олигомерные плюс-цепи. [8] Эти олигомерные плюс-цепи расщепляются РНКазой хозяина и лигируются РНК-лигазой хозяина с образованием мономерной плюс-цепи кольцевой РНК. Это называется асимметричным путем репликации по катящемуся кругу. Вироиды семейства Avsunviroidae (ASBVd-подобные) реплицируют свой геном посредством симметричного пути репликации по катящемуся кругу. [9] В этом симметричном пути олигомерные минус-цепи сначала расщепляются и лигируются с образованием мономерных минус-цепей, а затем транскрибируются в олигомерные плюс-цепи. Эти олигомерные плюс-цепи затем расщепляются и лигируются для образования мономерной плюс-цепи. Симметричный путь репликации получил свое название потому, что плюсовые и минусовые цепи образуются одинаково.
Расщепление олигомерных плюсовых и минусовых цепей опосредуется саморасщепляющейся структурой рибозима «головка молотка», присутствующей у Avsunviroidae, но такая структура отсутствует у Pospiviroidae. [10]
Усиление по катящемуся кругу (RCA)
[ редактировать ]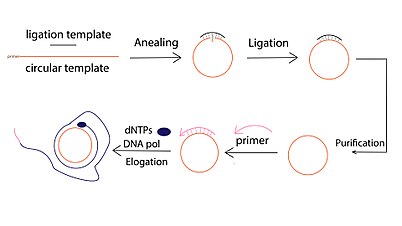
Производная форма репликации по катящемуся кругу успешно использовалась для амплификации ДНК из очень небольших количеств исходного материала. [1] Этот метод усиления называется усилением по катящемуся кругу (RCA). В отличие от традиционных методов амплификации ДНК, таких как полимеразная цепная реакция (ПЦР) , RCA представляет собой метод изотермической амплификации нуклеиновых кислот , при котором полимераза непрерывно добавляет отдельные нуклеотиды к праймеру, отожженному с кольцевой матрицей, что приводит к образованию длинной конкатемерной оцДНК, содержащей от десятков до сотен тандемных повторов (дополняющих круговой шаблон). [11]
Для проведения реакции RCA необходимы пять важных компонентов:
- ДНК-полимераза
- Подходящий буфер, совместимый с полимеразой.
- Короткий праймер для ДНК или РНК
- Круглый шаблон ДНК
- Дезоксинуклеотидтрифосфаты (dNTP)
Полимеразами, используемыми в RCA, являются Phi29 , Bst и Vent экзо -ДНК-полимераза для амплификации ДНК и РНК-полимераза T7 для амплификации РНК. Поскольку ДНК-полимераза Phi29 обладает лучшей процессивностью и способностью к смещению цепи среди всех вышеупомянутых полимераз, ее чаще всего использовали в реакциях RCA. В отличие от полимеразной цепной реакции (ПЦР), RCA можно проводить при постоянной температуре (от комнатной температуры до 65°C) как в свободном растворе, так и поверх иммобилизованных мишеней (твердофазная амплификация).
Обычно реакция ДНК RCA состоит из трех этапов:
- Лигирование по круговой матрице, которое можно проводить с помощью ферментативного лигирования, опосредованного матрицей (например, ДНК-лигазы Т4) или лигирования без матрицы с использованием специальных ДНК-лигаз (например, CircLigase).
- праймером Элонгация одноцепочечной ДНК, индуцированная . Для гибридизации с одним и тем же кругом можно использовать несколько праймеров. В результате могут быть инициированы множественные события амплификации с образованием нескольких продуктов RCA («Multiprimed RCA»).
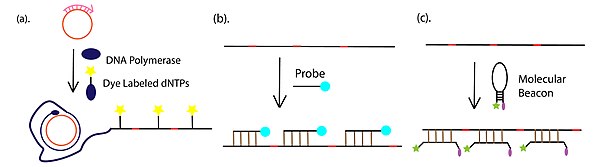
- Обнаружение и визуализация продуктов амплификации, которая чаще всего проводится посредством флуоресцентного обнаружения, с конъюгированным с флуорофором dNTP, связанными с флуорофором дополнительными или флуоресцентно-меченными молекулярными маяками . Помимо флуоресцентных подходов, гель-электрофорез . для обнаружения продукта RCA также широко используется
RCA производит линейную амплификацию ДНК, поскольку каждая кольцевая матрица растет с заданной скоростью в течение определенного периода времени. Чтобы увеличить выход и добиться экспоненциальной амплификации, как это делает ПЦР, было исследовано несколько подходов. Одним из них является амплификация по сверхразветвленному катящемуся кругу или HRCA, при которой добавляются и удлиняются праймеры, которые отжигаются с исходными продуктами RCA. [12] Таким образом, исходный RCA создает больше шаблонов, которые можно усилить. Другой вариант - амплификация по кругу или C2CA, где продукты RCA расщепляются ферментом рестрикции и лигируются в новые кольцевые матрицы с использованием рестрикционного олигонуклеотида, после чего следует новый раунд RCA с большим количеством кольцевых матриц для амплификации. [13]
Приложения RCA
[ редактировать ]
RCA может усиливать одно событие молекулярного связывания более чем в тысячу раз, что делает его особенно полезным для обнаружения целей со сверхнизким содержанием. Реакции RCA можно проводить не только в среде свободного раствора, но также на твердой поверхности, такой как стекло, микро- или наношарики, планшеты с микролунками, микрофлюидные устройства или даже бумажные полоски. Эта особенность делает его очень мощным инструментом для усиления сигналов в твердофазных иммуноанализах (например, ELISA ). Таким образом, RCA становится универсальным инструментом усиления сигнала с широким спектром применений в геномике, протеомике, диагностике и биосенсорстве.
Иммуно-RCA
[ редактировать ]Immuno-RCA — это изотермический метод усиления сигнала для высокоспецифичного и высокочувствительного обнаружения и количественного определения белков. Этот метод объединяет две области: RCA, который позволяет амплифицировать нуклеотиды, и иммуноанализ, в котором используются антитела, специфичные к внутриклеточным или свободным биомаркерам. В результате иммуно-RCA дает специфический усиленный сигнал (высокое соотношение сигнал/шум), что делает его пригодным для обнаружения, количественного определения и визуализации белковых маркеров с низким содержанием в жидкофазных иммуноанализах. [14] [15] [16] и иммуногистохимия .
Иммуно-RCA следует за типичной иммуноадсорбентной реакцией при ELISA или иммуногистохимическом окрашивании тканей. [17] Детектирующие антитела, используемые в реакции иммуно-RCA, модифицируются путем присоединения олигонуклеотида оцДНК к концу тяжелых цепей. Таким образом, участок Fab (фрагмент, связывание антигена) детектирующего антитела все еще может связываться со специфическими антигенами, а олигонуклеотид может служить праймером для реакции RCA.
Типичная процедура иммуно-RCA, опосредованная антителами, выглядит следующим образом:

1. Детектирующее антитело распознает конкретную белковую мишень. Это антитело также прикреплено к олигонуклеотидному праймеру.
2. Если присутствует кольцевая ДНК, ее отжигают, и праймер соответствует комплементарной последовательности кольцевой ДНК.
3. Комплементарная последовательность кольцевой ДНК-матрицы копируется сотни раз и остается прикрепленной к антителу.
4. Выход RCA (удлиненная оцДНК) обнаруживается с помощью флуоресцентных зондов с использованием флуоресцентного микроскопа или устройства для считывания микропланшетов.
аптамера Иммуно-RCA на основе [18]
[ редактировать ]В дополнение к иммуно-RCA, опосредованному антителами, праймер RCA оцДНК также может быть конъюгирован с 3'-концом аптамера ДНК. Хвост праймера можно амплифицировать посредством амплификации по катящемуся кругу. Продукт можно визуализировать посредством маркировки флуоресцентного репортера. [19] Процесс показан на рисунке справа.
Другие применения RCA
[ редактировать ]Различные производные RCA широко использовались в области биосенсорства. Например, RCA успешно использовался для обнаружения наличия вирусной и бактериальной ДНК в клинических образцах. [20] [21] что очень полезно для быстрой диагностики инфекционных заболеваний . Он также использовался в качестве метода усиления сигнала на чипе для анализа нуклеиновых кислот (как для ДНК, так и для РНК) на микрочипах . [1]
Помимо функции амплификации в приложениях биосенсора, метод RCA может применяться для создания наноструктур ДНК и гидрогелей также ДНК. Продукты RCA также можно использовать в качестве шаблонов для периодической сборки нановидов или белков, синтеза металлических нанопроволок. [22] и образование наноостровков. [1]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д Али, М. Монсур; Ли, Фэн; Чжан, Чжицин; Чжан, Кайсян; Канг, Донг-Ку; Анкрам, Джеймс А.; Ле, X. Крис; Чжао, Вэйан (2014). «Усиление по катящемуся кругу: универсальный инструмент для химической биологии, материаловедения и медицины». Обзоры химического общества . 43 (10): 3324–41. дои : 10.1039/C3CS60439J . ПМИД 24643375 .
- ^ Демидов, Вадим В, изд. (2016). Усиление по катящемуся кругу (RCA) – к новой клинической практике | Вадим Владимирович Демидов | Спрингер . Спрингер. дои : 10.1007/978-3-319-42226-8 . ISBN 9783319422244 . S2CID 30024718 .
- ^ Арбакл, Джесси (2011). «Молекулярная биология латентного периода вируса герпеса-6 человека и интеграции теломер» . Микробы и инфекции . 13 (8–9): 731–741. дои : 10.1016/j.micinf.2011.03.006 . ПМК 3130849 . ПМИД 21458587 .
- ^ Боренштейн, Ронен; Френкель, Низа (2009). «Клонирование генома вируса герпеса человека 6А в искусственные бактериальные хромосомы и исследование промежуточных продуктов репликации ДНК» . Труды Национальной академии наук . 106 (45): 19138–19143. Бибкод : 2009PNAS..10619138B . дои : 10.1073/pnas.0908504106 . ПМЦ 2767366 . ПМИД 19858479 .
- ^ Кусумото-Мацуо, Рика; Канда, Тадахито; Кукимото, Ивао (01 января 2011 г.). «Репликация ДНК вируса папилломы человека типа 16 по катящемуся кругу в экстрактах эпителиальных клеток» . Гены в клетки . 16 (1): 23–33. дои : 10.1111/j.1365-2443.2010.01458.x . ISSN 1365-2443 . ПМИД 21059156 . S2CID 30493728 .
- ^ Ризви, Ирум; Чоудхури, Нирупам Рой; Тутеджа, Нарендра (01 февраля 2015 г.). «Понимание функциональных характеристик белка-инициатора репликации геминивируса по вращающемуся кругу и его взаимодействия с факторами хозяина, влияющими на репликацию вирусной ДНК». Архив вирусологии . 160 (2): 375–387. дои : 10.1007/s00705-014-2297-7 . ISSN 0304-8608 . ПМИД 25449306 . S2CID 16502010 .
- ^ Бернштейн Х., Бернштейн С. (июль 1973 г.). «Кольцевые и разветвленные кольцевые соединения как возможные промежуточные соединения в репликации ДНК бактериофага Т4». Дж. Мол. Биол . 77 (3): 355–61. дои : 10.1016/0022-2836(73)90443-9 . ПМИД 4580243 .
- ^ Дарос, Хосе-Антонио; Елена, Сантьяго Ф.; Флорес, Рикардо (июнь 2006 г.). «Вироиды: нить Ариадны в лабиринте РНК» . Отчеты ЭМБО . 7 (6): 593–598. дои : 10.1038/sj.embor.7400706 . ISSN 1469-221X . ПМЦ 1479586 . ПМИД 16741503 .
- ^ Цагрис, Эфтимия Мина; Мартинес де Альба, Анхель Эмилио; Гозманова, Мариана; Калантидис, Критон (1 ноября 2008 г.). «Вироиды» . Клеточная микробиология . 10 (11): 2168–2179. дои : 10.1111/j.1462-5822.2008.01231.x . ISSN 1462-5822 . ПМИД 18764915 .
- ^ Флорес, Рикардо; Гас, Мария-Евгения; Молина-Серрано, Диего; Нохалес, Мария-Анхелес; Карбонелл, Альберто; Заика, Сельма; Де ла Пенья, Маркос; Дарос, Хосе-Антонио (14 сентября 2009 г.). «Репликация вироидов: вращающиеся круги, ферменты и рибозимы» . Вирусы . 1 (2): 317–334. дои : 10.3390/v1020317 . ПМК 3185496 . ПМИД 21994552 .
- ^ Али, М. Монсур; Ли, Фэн; Чжан, Чжицин; Чжан, Кайсян; Канг, Донг-Ку; Анкрам, Джеймс А.; Ле, X. Крис; Чжао, Вэйан (21 мая 2014 г.). «Усиление по катящемуся кругу: универсальный инструмент для химической биологии, материаловедения и медицины». Обзоры химического общества . 43 (10): 3324–3341. дои : 10.1039/c3cs60439j . ISSN 1460-4744 . ПМИД 24643375 .
- ^ Лизарди, Пол М.; Хуан, Сяохуа; Чжу, Чжэнжун; Брей-Уорд, Патрисия; Томас, Дэвид С.; Уорд, Дэвид К. (июль 1998 г.). «Обнаружение мутаций и подсчет одиночных молекул с использованием изотермической амплификации по катящемуся кругу» . Природная генетика . 19 (3): 225–232. дои : 10.1038/898 . ISSN 1546-1718 . ПМИД 9662393 . S2CID 21007563 .
- ^ Даль, Фредрик; Банер, Йохан; Гуллберг, Матс; Мендель-Хартвиг, Марита; Ландегрен, Ульф; Нильссон, Матс (30 марта 2004 г.). «Амплификация от круга к кругу для точного и чувствительного анализа ДНК» . Труды Национальной академии наук . 101 (13): 4548–4553. Бибкод : 2004PNAS..101.4548D . дои : 10.1073/pnas.0400834101 . ISSN 0027-8424 . ПМЦ 384784 . ПМИД 15070755 .
- ^ Швейцер, Барри; Робертс, Скотт; Гримуэйд, Брайан; Шао, Вэйпин; Ван, Минджуан; Фу, Цинь; Шу, Квипинг; Ларош, Изабель; Чжоу, Чжиминь (апрель 2002 г.). «Мультиплексное профилирование белков на микрочипах методом амплификации по катящемуся кругу» . Природная биотехнология . 20 (4): 359–365. дои : 10.1038/nbt0402-359 . ISSN 1087-0156 . ПМЦ 2858761 . ПМИД 11923841 .
- ^ Чжоу, Лонг; Оу, Ли-Хуан; Чу, Ся; Шен, Го-Ли; Ю, Жу-Цинь (2007). «Амплификация по катящемуся кругу на основе аптамера: платформа для электрохимического обнаружения белка». Аналитическая химия . 79 (19): 7492–7500. дои : 10.1021/ac071059s . ПМИД 17722881 .
- ^ Бьёркестен, Йохан; Патил, Сураб; Фредолини, Клаудия; Лённ, Питер; Ландегрен, Ульф (29 мая 2020 г.). «Мультиплексная платформа для цифрового измерения продуктов реакции кольцевой ДНК» . Исследования нуклеиновых кислот . 48 (13): гкаа419. дои : 10.1093/nar/gkaa419 . ISSN 0305-1048 . ПМЦ 7367203 . ПМИД 32469060 .
- ^ Гусев Ю.; Спарковски Дж.; Рагунатан, А.; Фергюсон, Х.; Монтано, Дж.; Богдан Н.; Швейцер, Б.; Уилтшир, С.; Кингсмор, Сан-Франциско (июль 2001 г.). «Амплификация по катящемуся кругу: новый подход к повышению чувствительности иммуногистохимии и проточной цитометрии» . Американский журнал патологии . 159 (1): 63–69. дои : 10.1016/S0002-9440(10)61674-4 . ISSN 0002-9440 . ПМК 1850404 . ПМИД 11438455 .
- ^ Чжао, Вэйан; Али, М. Монсур; Брук, Майкл А.; Ли, Инфу (11 августа 2008 г.). «Амплификация по катящемуся кругу: применение в нанотехнологиях и биодетектировании с помощью функциональных нуклеиновых кислот». Angewandte Chemie, международное издание . 47 (34): 6330–6337. дои : 10.1002/anie.200705982 . ISSN 1521-3773 . ПМИД 18680110 .
- ^ Чжоу, Лонг; Оу, Ли-Хуан; Чу, Ся; Шен, Го-Ли; Ю, Жу-Цинь (01 октября 2007 г.). «Амплификация по катящемуся кругу на основе аптамера: платформа для электрохимического обнаружения белка». Аналитическая химия . 79 (19): 7492–7500. дои : 10.1021/ac071059s . ISSN 0003-2700 . ПМИД 17722881 .
- ^ Чен, Сяою; Ван, Бин; Ян, Вэнь; Конг, Фаньронг; Ли, Чуанью; Сунь, Чжаоган; Джелфс, Питер; Гилберт, Гвендолин Л. (1 мая 2014 г.). «Амплификация по методу катящегося круга для прямого обнаружения мутаций гена rpoB в изолятах микобактерий туберкулеза из клинических образцов» . Журнал клинической микробиологии . 52 (5): 1540–1548. дои : 10.1128/JCM.00065-14 . ISSN 0095-1137 . ПМЦ 3993705 . ПМИД 24574296 .
- ^ Лю, Ян; Го, Ян-Лин; Цзян, Гуан-Лу; Чжоу, Ши-Цзе; Солнце, Ци; Чен, Си; Чанг, Сю-Цзюнь; Син, Ай-Ин; Ду, Фэн-Цзяо (04 июня 2013 г.). «Применение гиперразветвленной амплификации по катящемуся кругу для прямого обнаружения микобактерий туберкулеза в клинических образцах мокроты» . ПЛОС ОДИН . 8 (6): e64583. Бибкод : 2013PLoSO...864583L . дои : 10.1371/journal.pone.0064583 . ISSN 1932-6203 . ПМЦ 3672175 . ПМИД 23750210 .
- ^ Го, Маосян; Эрнандес-Нейта, Иван; Мадабуси, Нараянан; Нильссон, Матс; Вейнгаарт, Воутер ван дер (12 февраля 2018 г.). «Эффективный синтез трансмембранных золотых нанопроводов с помощью ДНК» . Микросистемы и наноинженерия . 4 : 17084. дои : 10.1038/micronano.2017.84 . ISSN 2055-7434 .
Внешние ссылки
[ редактировать ]- Системы репликации ДНК, используемые с небольшими кольцевыми молекулами ДНК. Геномы 2 , Т. Браун и др., в NCBI Books.
- MicrobiologyBytes: вироиды и вирусоиды
- http://mcmanuslab.ucsf.edu/node/246