Карбоксилат


В органической химии карбоксилат сопряженное — основание кислоты карбоновой . РКОО − (или РКО - 2 ). Это анион , ион с отрицательным зарядом .
Карбоксилатные соли – это соли , имеющие общую формулу M(RCOO) n , где M представляет собой металл, а n равно 1, 2,.... Сложные эфиры карбоксилатов имеют общую формулу RCOOR' (также пишется как RCO 2 R' ), где R и R' — органические группы.
Синтез
[ редактировать ]Карбоксилат-ионы могут образовываться депротонированием карбоновых кислот. Такие кислоты обычно имеют pKa или менее 5, что означает, что они могут депротонироваться многими основаниями, такими как гидроксид натрия бикарбонат натрия . [ 1 ] : 271–2
Резонансная стабилизация карбоксилат-иона
[ редактировать ]Карбоновые кислоты легко диссоциируют на карбоксилат-анион и положительно заряженный ион водорода (протон), гораздо легче, чем спирты (на алкоксид -ион и протон), поскольку карбоксилат-ион стабилизируется за счет резонанса . Отрицательный заряд, остающийся после депротонирования карбоксильной группы, делокализован между двумя электроотрицательными атомами кислорода в резонансной структуре. Если группа R представляет собой электроноакцепторную группу (например, –CF 3 ), основность карбоксилата будет еще больше ослаблена. [ 1 ] : 264–5
Эта делокализация электрона означает, что оба атома кислорода менее сильно отрицательно заряжены: поэтому положительный протон менее сильно притягивается обратно к карбоксилатной группе после того, как он ушел; следовательно, карбоксилат-ион более стабилен и менее основен в результате резонансной стабилизации отрицательного заряда. Напротив, однажды образовавшийся алкоксид- ион будет иметь сильный отрицательный заряд, локализованный на его одиночном атоме кислорода, который будет сильно притягивать любые близлежащие протоны (действительно, алкоксиды являются очень сильными основаниями). Из-за резонансной стабилизации карбоновые кислоты имеют гораздо более низкие значения p K a (и, следовательно, являются более сильными кислотами), чем спирты . Например, pKa значение составляет уксусной кислоты 4,8, а у этанола значение pKa равно 16. Следовательно, уксусная кислота является гораздо более сильной кислотой, чем этанол. Это, в свою очередь, означает, что для эквимолярных растворов карбоновой кислоты или спирта в воде карбоновая кислота будет иметь гораздо более низкий pH . [ 1 ] : 263–7
Реакции
[ редактировать ]Алкиация
[ редактировать ]Соли карбоновых кислот с атомом водорода в альфа- положении рядом с карбоксилатной группой можно превратить в дианионы с сильными основаниями, такими как диизопропиламид лития . Они реагируют с алкилгалогенидами с образованием производных: [ 1 ] : 474
- РЦХ 2 COO − + Это + [ − N(CH(CH3 ) 2 ) 2 ] → RCH − главный операционный директор −
- РЦГ − главный операционный директор − + R'X → RR'CHCOO − + Х −
Нуклеофильное замещение
[ редактировать ]Карбоксилат-ионы являются хорошими нуклеофилами . Они реагируют с алкилгалогенидами с образованием сложных эфиров . Следующая реакция показывает механизм реакции. [ 1 ] : 398–9
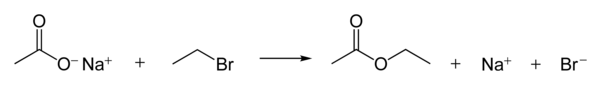
Нуклеофильность карбоксилат-ионов значительно слабее, чем у гидроксид- и алкоксид -ионов, но сильнее, чем у галогенид- анионов (в полярном апротонном растворителе , хотя есть и другие эффекты, например растворимость иона).
Снижение
[ редактировать ]В отличие от восстановления сложного эфира, восстановление карбоксилата отличается отсутствием уходящей группы и относительно богатым электронами атомом углерода (из-за отрицательного заряда на атомах кислорода). При небольшом количестве кислоты реакция протекает с литийалюминийгидридом путем замены LAH на кислоту Льюиса AlH 3 , превращая оксианион в 4 связи Al–O. [ 1 ] : 1212
Примеры
[ редактировать ]Этот список предназначен для случаев, когда для аниона или его производных есть отдельная статья. Все остальные органические кислоты должны находиться в исходной карбоновой кислоте.
- Формиат- ион, HCOO −
- Ацетат- ион, CH 3 COO −
- Метантетракарбоксилат- ион, C(COO − ) 4
- Оксалат- ион, (COO) 2−
2
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж Марч, Джерри (1992), Продвинутая органическая химия: реакции, механизмы и структура (4-е изд.), Нью-Йорк: Wiley, ISBN 0-471-60180-2



